响应面优化紫苏叶中黄酮类物质提取工艺研究
李晓雪 王菲 崔新爽 杨逢建
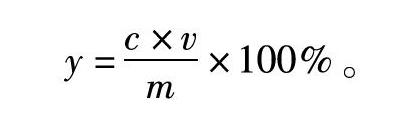
摘 要:为研究紫苏叶中黄酮类物质的最佳工艺条件,本研究以黄酮类物质提取率为评价指标,采用微波辅助提取法从紫苏叶中对其进行提取。在此基础上,应用响应面Box-Benhnken优化技术对紫苏叶中黄酮类物质的微波提取工艺加以完善。得出最佳工艺条件为:微波时间30 min、微波功率268 W、液料比15∶1 ml/g、乙醇体积分数80%,实际提取率高达7.833%,与理论推测值7.849%±0.016%,为开发紫苏叶中黄酮类物质提供支撑材料和理论依据。
关键词:紫苏叶;黄酮;微波辅助;响应面优化;最佳工艺条件
中图分类号:Q946文献标识码:A文章編号:1006-8023(2019)06-0048-07
Optimization of Extraction Process of Flavonoids from Perilla Leaves
by Response Surface Methodology
LI Xiaoxue, WANG Fei, CUI Xinshuang, YANG Fengjian*
(Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin 150040)
Abstract:In order to study the optimal technological conditions of flavonoids in the leaves of perilla, this study took the extraction rate of flavonoids as the evaluation index, and used microwave-assisted extraction method to extract flavonoids from the leaves of Perilla. On this basis, the microwave extraction process of flavonoids was improved by response surface Box-Benhnken optimization technology. The optimum conditions were as follows: microwave time was 30 min, microwave power was 268 W, liquid-material ratio was 15∶1 ml/g, volume fraction of ethanol was 80 %, actual extraction rate was as high as 7.833 % and deviation from theoretical value was 7.849 % ± 0.016 %. It provided support materials and theoretical basis for the development of flavonoids in perilla leaves.
Keywords:Perilla leaves; flavonoids; microwave assisted; response surface optimization; optimal process conditions
0 引言
紫苏(Perilla frutescens( L.) Britt. ),又称白苏,唇形科紫苏属,一年生草本植物[1-3],具有特异芳香气味[4]。紫苏叶中的营养成分极其丰富,包括水、蛋白质、碳水化合物、脂肪以及多种维生素等。不仅如此,紫苏叶中还有紫苏醇、紫苏酮、薄荷醇、薄荷酮、丁香油酚及白苏烯酮等物质[5-8]。其中的黄酮类物质是植物中主要的多酚类天然产物, 是天然酚性化合物之首。其主要药理作用为抗肝脏毒性、抗菌、抗氧化、降血脂、抗衰老、抗疲劳和增强免疫功能等[9-11]。
黄酮类物质的提取方法有很多,其中,微波辅助提取技术是借助微波过程中红外热导作用,具有较好的受热条件及穿透性,在植物活性物质分离和纯化的过程中得以广泛的应用[12]。因此,本研究对紫苏叶中黄酮类物质的微波辅助提取进行了系统性的研究与分析,通过单因素试验和响应面优化对紫苏叶黄酮类物质的最佳提取方法和工艺条件予以分析、确定,为开发紫苏叶总黄酮类化合物提供支撑材料和理论依据[13]。
1 材料与仪器
1.1 材料与试剂
紫苏叶于2018年9月末采自黑龙江地区。芦丁标准品(上海源叶生物科技有限公司)、无水乙醇(天津市致远化学试剂有限公司)、氢氧化钠(天津市恒兴化学试剂制造有限公司)、硝酸铝(天津市凯通化学试剂有限公司)、亚硝酸钠(天津市凯通化学试剂有限公司)等试剂均为分析纯,实验用水为蒸馏水。
1.2 设备与仪器
试验仪器:磁力搅拌水浴锅(常州恩培仪器制造有限公司)、微波炉(佛山市顺德区格兰仕微波炉电器公司)、KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司)、752N型紫外分光光度计(上海精科实业有限公司)、旋转薄膜蒸发器(上海一科仪器有限公司)。
2 实验方法
2.1 紫苏总黄酮含量测定
2.1.1 标准曲线绘制
5 mg芦丁标准品,溶于5 ml甲醇,配置浓度为0.062 5、0.125、0.25、0.5、1 mg/ml的标准溶液,蒸馏水为空白样品。取0.5 ml标准溶液置于比色管中,加入0.5 ml 5%亚硝酸钠、0.5 ml 10%硝酸铝、4.0 ml 4%氢氧化钠和4.5 ml 95%无水乙醇,混匀避光静止15 min,在510 nm波长下测定吸光值[14]。以芦丁标准品的质量浓度为横坐标,吸光值为纵坐标,绘制芦丁标准曲线[15],所得曲线如图1所示。
对芦丁标准曲线图1中所有数据进行回归分析,所得的线性方程y=0.621 1x+0.005 6, R2=0.999 3。
2.1.2 总黄酮含量的测定
将样品用蒸馏水溶解,稀释50倍后,按照上述方法测定OD值(吸光度)。之后,通过芦丁标准曲线来计算样品的总黄酮含量,计算公式:
y=c×vm×100%。
式中: y代表总黄酮含量,%;c代表样品浓度,g/ml;v代表样品液体总体积,ml;m代表样品质量,mg[16]。
2.1.3 数据统计与处理
单因素试验数据采用Excel2010進行绘制处理,响应面试验结果用Design Expert 8.0.6软件分析。
2.2 单因素试验
2.2.1 乙醇体积分数对紫苏叶中黄酮类物质提取率的影响
每组称取紫苏叶5 g,微波功率为230 W,液料比为15∶1 ml/g,微波时间30 min,在乙醇体积分数分别为50%、60%、70%、80%、90%下进行提取,研究不同乙醇体积分数对紫苏叶中黄酮类物质提取率的影响。
2.2.2 液料比对紫苏叶中黄酮类物质提取率的影响
称取紫苏叶5 g,微波功率为230 W,选取80%的无水乙醇,时间30 min,分别在液料比为5∶1、10∶1、15∶1、20∶1、25∶1 ml/g 5种情况下进行提取,探究不同液料比对试验结果的影响。
2.2.3 微波时间对紫苏叶中黄酮类物质提取率的影响
称取5 g干燥的紫苏叶,将其按15∶1 ml/g的液料比溶入80%的无水乙醇中,在微波功率为230 W下分别提取10、20、25、30、35 min,考察不同提取时间对紫苏叶中黄酮类物质提取率的影响。
2.2.4 微波功率对紫苏叶中黄酮类物质提取率的影响
称取5 g干燥的紫苏叶,80%的无水乙醇,将其按15∶1 ml/g的液料比混合,在微波功率分别为120、230、385、540、700 W下提取30 min,探究不同微波功率对紫苏叶中黄酮类物质提取率的影响。
2.3 响应面试验因素与水平的选取
为了更进一步研究微波辅助提取法提取紫苏叶中黄酮物质过程中诸多因素之间的关系,根据以上单因素试验结果,应用Box-Behnken试验设计原理选取微波功率、微波时间和液料比3个影响程度较高的因素,在响应面分析方法下进行试验工艺参数的优化,最大程度地对黄酮类物质进行提取。并且对三个因素的影响程度进行了横向对比。其中试验因素与水平表见表1。
3 结果与讨论
3.1单因素试验结果
3.1.1 乙醇体积分数
黄酮提取率随着乙醇体积分数的增加逐渐发生变化,呈现出先增加后降低的趋势[17],在乙醇体积分数为80%时提取率达到最高(图2)。试验发现,水分子为主要的升温来源,当乙醇体积分数为70%~80%时,水含量较高,增大了溶液对物料的渗透性,从而提高了黄酮类物质的提取率。但随着乙醇比例的增大,水分子逐渐减小,对物料的升温速度产生了影响,阻碍黄酮类物质的溶出,从而影响提取率。故选用70%~90%的无水乙醇进行优化试验。
3.1.2 微波时间
随着提取时间的延长,黄酮提取率也在逐渐上升,在30 min时提取率最高,随后又呈现下降的趋势(图3)。其原因可能是由于随着时间的延长,黄酮类物质不断地从紫苏叶中溶出,在30 min时几乎全部溶出;但由于长时间的微波辐射,使一些热不稳定的黄酮变性损失,或者导致溶剂有所挥发,从而使提取率下降。因此,选用25~35 min的微波提取时间进行优化试验。
3.1.3 微波功率
随着微波功率的增大,黄酮提取率不断升高,但上升速度趋于缓慢(图4)。可能是因为在微波辐射的过程中,溶质吸收微波的能力逐渐增强[18],在微波功率230 W时达到饱和点,黄酮的提取率最大。但随着功率的不断上升,黄酮类物质的损失程度也在不断加大。综合考虑,选择120~385 W的微波功率进行优化试验。
3.1.4 液料比
随着液料比的增大,黄酮类物质的提取率逐渐升高(图5)。这表明在溶质一定的情况下,加入的乙醇比例越多,黄酮提取率越高。这可能是因为浓度差加大利于黄酮类物质从原料中溶出,在15∶1 ml/g的比例下黄酮类物质全部融出;在临界点(15∶1 ml/g)之后,试验产生的杂质一并随着液料比的升高而增大,从而影响黄酮的提取率。综合考虑,应选取10∶1~20∶1 ml/g进行优化试验。
3.2 响应面试验优化结果
3.2.1 响应模型的建立与显著性检验
设计方案与结果见表2。其主要目的是用来分析试验误差,以黄酮得率(R)为响应值进行回归拟合,最终得到二次多元回归方程模型:
R=+7.82+0.025A+0.14B-0.038C-0.10A·B+
0.000A·C+0.025B·C-0.22A2-0.40B2-0.20C2
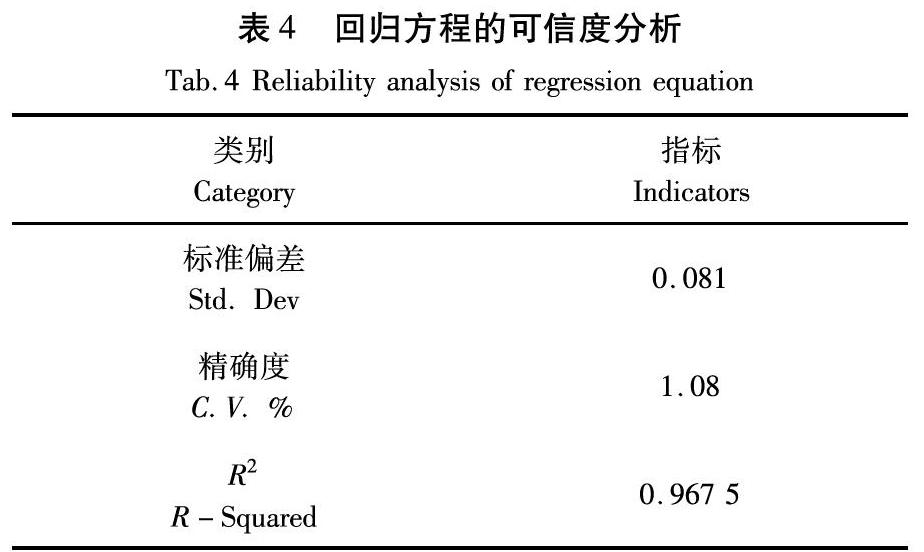
由方差分析结果(表3)可知,所得出的回归方程中不同变量与响应值之间影响的显著程度是由由F值的大小决定的,即F值越大,影响程度越强;相反F值越小,影响程度越弱。因此,在应用微波辅助提取法提取黄酮类物质的过程中各个因素对黄酮提取率的影响程度依次为:B-功率>C-料液比>A-时间。P>0.05差异性不显著,P<0.01差异性极显著。其中总模型方程P模型=0.0002<0.05表现为显著,不同处理条件之间的差异极显著;P失拟=0.541 3>0.05说明差异之间不显著。标准方差反映一个数据集的离散程度,数据整体分布离平均值越近,标准方差就越小(表4)。反之,数据分布离平均值越远,标准方差越大。模型的精确度与变异系数(CV)有关,CV的值(1.08%)越低精确度越高。系数R2的值为0.967 5>0.9,说明该模型的拟合程度良好。
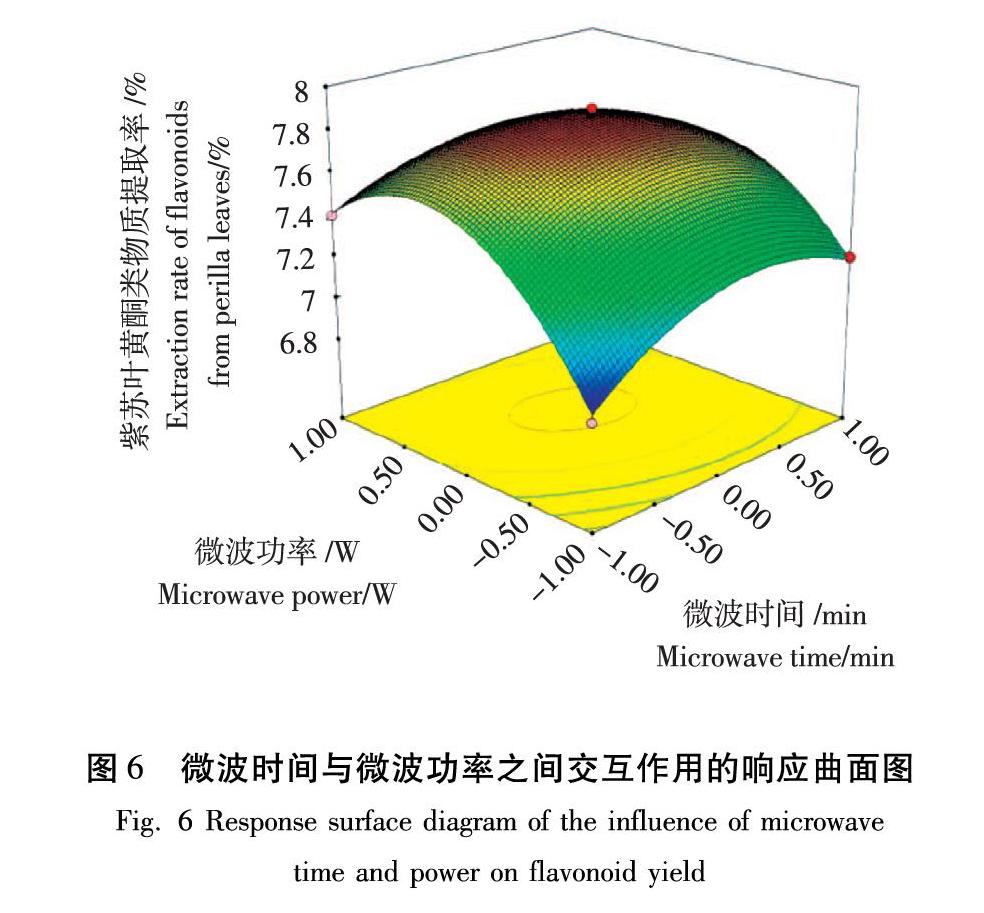
3.2.2 响应曲面图和等高线图分析
利用Design-Expert 8.0.6软件拟合出相应的曲面图和等高线(如图6~图8所示),依据黄酮类物质提取率的回归模型做出响应面图,可以直观地反映各因素之间的交互作用对黄酮提取率的影响,并确定最佳提取工艺条件。
3.2.3 优化结果的验证、对比试验
通过对响应面数据的分析与单因素试验进行综合对比研究,对回归模型方程进行解析得出黄酮的最佳提取率为7.849%。于此同时微波辅助提取法的最佳工艺参数为:提取时间30 min,微波功率268 W,液料比15∶1 ml/g,乙醇体积分数80%。以优化得出的实验参数进行3次重复验证试验,所得到真实的平均提取值为7.833%,与模型预测值较为相符。通过对表5中两个数据对比可知,应用微波辅助提取法得到的提取率高于超声波辅助的得率。同时超声辅助提取法受有效作用区域的限制,容易在提取物周围形成超声空白区;还会造成一定程度的噪音。
4 结论
通过单因素试验,确定了黄酮类物质的最佳提取方法。在此基础上采用响应面分析优化法对微波辅助提取紫苏叶总黄酮的工艺条件进行优化,构建了二次回归方程模型。通过响应面图对各因素及其交互作用予以研究和分析,得出微波辅助提取法的最佳提取工艺条件为:时间30 min、微波功率268 W、液料比15∶1 ml/g、乙醇体积分数80%,为紫苏叶的精深加工利用以及提高其附加值提供了理论的依据。
【参 考 文 献】
[1]刘芳洁.紫苏不同部位乙醇提取物对苹果树腐烂病的影响及机制[J].江苏农业科学,2018,46(17):97-101.
LIU F J. Effect and mechanism of ethanol extracts from different parts of Perilla frutescens on apple tree canker[J]. Jiangsu Agricultural Science, 2018, 46(17):97-101.
[2]张琛武,郭佳琪,郭宝林.紫苏中酚酸类成分研究进展[J].中国现代中药,2017,19(11):1651-1658.
ZHANG C W, GUO J Q, GUO B L. Review on research of phenolic acids in Perilla frutescens[J]. Modern Chinese Medicine, 2017, 19(11):1651-1658.
[3]魏长玲,郭宝林.紫苏叶挥发油的不同化学型及研究进展[J].中国中药杂志,2015,40(15):2937-2944.
WEI C L, GUO B L. Advances in research of volatile oil and its different chemotypes in leaves of Perilla frutescens[J]. Chinese Journal of Traditional Chinese Medicine, 2015, 40(15):2937-2944.
[4]闵文莉,曹喜涛,季更生,等.调控脂肪酸合成植物转录因子的研究进展[J].发酵科技通讯,2017,46(2):107-112.
MIN W L, CAO X T, JI G S, et al. Researches of plant transcription factors involving in fatty acid synthesis[J]. Communications on Fermentation Technology, 2017, 46(2):107-112.
[5]吴存兵,张钰涓,邵伯进,等.响应面优化泡沫法提取紫苏饼粕蛋白的工艺[J].安徽农业大学学报,2017,44(4):574-579.
WU C B, ZHANG Y J, SHAO B J, et al. Optimization of foam separation of protein from perilla seed meal using the response surface method[J]. Journal of Anhui Agricultural University, 2017, 44(4):574-579.
[6]李武强,黄晓鹏,马嘉伟,等.响应面法优化桔梗切片远红外干燥工艺[J].林业机械与木工设备,2019,47(8):47-51.
LI W Q, HUANG X P, MA J W, et al. Optimization of far infrared drying process of platycodon grandiflorum slice by response surface methodology[J].Forestry Machinery & Woodworking Equipment,2019,47(8):47-51.
[7]朱双全.紫苏化学成分及药理学研究进展概要[J].生物化工,2018,4(2):148-149.
ZHU S Q. Summary of research progress on the chemical constituents and pharmacology of Perilla[J]. Biological Chemical, 2018, 4(2):148-149.
[8]楊慧,马培,林明宝,等.紫苏叶化学成分、抗炎作用及其作用机制研究进展[J].中国药理学与毒理学杂志,2017,31(3):279-286.
YANG H, MA P, LIN M B, et al. Research progress in chemical constituents, anti-inflammatory effect and mechanism of Folium Perillae[J]. Chinese Journal of Pharmacology and Toxicology, 2017, 31(3):279-286.
[9]許丹妮,苏秀芳,秦兰清.超声波辅助法提取假苹婆树皮总黄酮及其抗氧化作用研究[J].广东化工,2019,46(6):38-40.
XU D N, SU X F, QIN L Q. Study on ultrasonic-assisted extraction and the antioxidation of total flavonoids from Sterculia Lanceolata Blark[J]. Guangdong Chemical, 2019, 46(6):38-40.
[10]王婷,徐俞悦,陈素红,等.松针的保健功效及相关产品研究进展[J].中草药,2018,49(17):4171-4177
WANG T, XU Y Y, CHEN S H, et al. Research progress on health benefits of pine needles and related health products[J]. Chinese Herbal Medicine, 2018, 49(17):4171-4177.
[11]杨耀森,阚淇滨,苏建青,等.七味地藿颗粒黄酮的提取工艺优化研究[J].动物医学进展,2019,40(4):47-52.
YANG Y S, KAN Q B, SU J Q. Optimization of extraction technology of flavonoids from Qiweidihuo Granule[J]. Advances in Animal Medicine, 2019, 40(4):47-52.
[12]李占君,张志环,张厚良,等.紫苏籽精油提取工艺及其脂肪酸构成的研究[J].森林工程,2019,35(1):36-41.
LI Z J, ZHANG Z H, ZHANG H L, et al. Study on extraction process of essential oil from Perilla frutescens and its fatty acid composition[J]. Forest Engineering, 2019, 35(1):36-41.
[13]黄红雨,赵虎,金晓艳.紫苏叶花青素提取工艺及其活性研究[J].食品研究与开发,2018,39(14):50-57.
HUANG H Y, ZHAO H, JIN X Y. Study on extraction process and activity of anthocyanin from Perilla frutescens leaves[J]. Food Research and Development, 2018, 39(14):50-57.
[14]张子东,张圆圆,孟永斌,等.沙枣果总黄酮类化合物的富集研究[J].植物研究,2018,38(3):467-474.
ZHANG Z D, ZHANG Y Y, MENG Y B, et al. Flavonoids enrichment from Elaeagnus angustifolia fruit[J]. Plant Research, 2018, 38(3):467-474.
[15]罗教,杨玉萍,党宗福.银杏叶总黄酮提取条件研究[J].辽宁化工,2019(4):310-312.
LUO J, YANG Y P, DANG Z F. Study on the condition of extracting favonoids from Ginkgo biloba leaves[J]. Liaoning Chemical Industry, 2019(4):310-312.
[16]杨岚,杨玲,李邦耀,等.宁夏不同产地沙棘黄酮类物质含量及抗氧化活性的研究[J].安徽农学通报,2018,24(14):22-24.
YANG L, YANG L, LI B Y, et al. Study on flavonoid content and antioxidant activity of Hippophae rhamnoides from different areas in Ningxia[J]. Anhui Agricultural Science Bulletin, 2018, 24(14):22-24.
[17]黄艳玲,熊建文,蔡锦源,等.响应面法优化微波辅助提取艾叶总黄酮的工艺研究[J].轻工科技,2019,35(2):40-43.
HUANG Y L, XIONG J W, CAI J Y, et al. Response surface method was used to optimize the microwave-assisted extraction of total flavonoids from Artemisiaargyi leaves[J]. Light Industrial Technology, 2019, 35(2):40-43.
[18]崔建强,唐静,王燕,等.响应曲面法优化花生壳中木犀草素的微波提取工艺[J].化学与生物工程,2017,34(4):42-46.
CUI J Q, TANG J, WANG Y, et al. Optimization on microwave extraction process of mignonette from peanut shells by response surface methodology[J]. Chemical and Biological Engineering, 2017, 34(4):42-46.

