食品质量安全非靶向筛查技术研究进展
王磊 董燕婕 范丽霞 梁京芸 苑学霞 赵善仓
摘要:食品中存在的污染物部分是已知的,部分是未知的。为确保食品质量安全,非针对性的筛查技术是必要的。非靶向筛查主要有两种分析策略,包括非靶向代谢组学和可以用于筛选食品基质中未知污染物的化学数据库。本文概述了当前样品制备、基于分析化学的技术和数据分析以及采用非靶向检测方法分析复杂食品基质的局限性和挑战。
关键词:食品;非靶向筛查;质量安全;质谱;核磁共振
中图分类号:TS201.6-1文献标识号:A文章编号:1001-4942(2019)10-0167-06
Research Development of Non-Targeted Screening Techniques
for Food Quality Safety
Wang Lei, Dong Yanjie, Fan Lixia, Liang Jingyun, Yuan Xuexia,
Zhao Shancang
(Institute of Quality Standards and Testing Technology for Agro-Products, Shandong Academy of Agricultural Sciences/
Shandong Provincial Key Laboratory of Test Technology on Food Quality and Safety, Jinan 250100, China)
Abstract Some of the contaminants in food were known, while some were unknown, so non-targeted work flows for chemical hazard analyses were highly desirable in food safety and integrity fields to ensure human health. Two different analytical strategies, non-targeted metabolomics and chemical database filtering, could be used to screen unknown contaminants in food matrices. In this paper, an overview was provided in the current sample preparation, analytical chemistry-based techniques and data analysis, as well as the limitations and challenges of non-targeted detection methods for analyzing complex food matrices.
Keywords Food; Non-targeted screening; Quality safety; Mass spectrometry; Nuclear magnetic resonance
食品生产过程中违规违法使用的农兽药和非法添加物非常复杂,可能是确切的一种或一类化学物质,也可能是尚未被监测到的、不在食品质量安全监管范围内的组分或其他化学物质。目前常用的食品质量安全检测技术往往侧重于已知的污染物,但对未知的污染物无法进行有效筛查及鉴别[1-3]。随着现代化学工业的发展,越来越多的合成化学物质应运而生。食品安全标准所涵盖的目标化学物质不到1 000个,这只是现有化学物质的冰山一角。因此,未来的食品安全控制必须实施非靶向筛查的方法以实现食品成分和未知化合物的无偏差检测。
非靶向筛查旨在识别食品基质中未知的化学物质。广义的非靶向筛查是指根据组学方法(如代谢组学、蛋白质组学等)筛选未知的化學危害物并识别食品中化学成分的差异[2,4]。狭义的非靶向筛查则指利用已建立的化学危害物数据库鉴别污染物[5]。虽然狭义的非靶向筛查数据库中的化学物质是已知的,但筛查的污染物是未知的,其实用性取决于数据库的大小。广义的非靶向筛查可以使用先进的分析技术筛选可能的化学危害物。高分辨率质谱(HRMS)技术的进步使代谢组学能够实现非靶向筛查的目的,从而能够以无偏差的方式检测危害物[6,7]。非靶向检测方法结合相应的化学计量学工具,增加了传统靶向分析的广度,加速了其应用的新前景[8,9]。针对当前食品的真实性、质量和安全性问题,非靶向筛查正逐渐成为促进食品安全监测从被动检测到主动预防、识别新出现风险的有效手段。
本研究对目前使用的食品质量安全污染物的非靶向筛查技术进行梳理,分析样品制备和基于分析化学的技术以及复杂食品基质的非靶向检测方法的局限性和挑战性,并展望当前的研究和作为食品安全和完整性可靠工具的非靶向检测的前景。
1 前处理方法
非靶向筛查需要从复杂的食品基质中提取大量的化学物质[10-12]。食品中非靶向筛查的样品制备与传统的靶向分析方法基本一致,主要区别在于样品或提取物的分离纯化程度。常见的提取方法包括固-液萃取[6,13]、液-液萃取[2,14]、固相微萃取(SPME)[15,16]以及QuEChERS[17,18]。上述方法各有优点,但也存在着分析时间长、操作困难、使用有毒有机溶剂、选择性低、萃取装置昂贵和仪器性能寿命短等局限性。
非靶向筛查中使用的分析方法在减少复杂基质效应方面具有高度选择性,同时还需要同时检测食品中不同浓度的各种污染物,因此,减少基质效应是非靶向筛查的重要指标。基于新型吸附材料的样品纯化可以减少样品处理,成为无靶向筛查的趋势。目前,分子印迹聚合物(如碳纳米管和金属-有机骨架)已成功应用于食品分析中[19,20]。由金属-有机骨架(MOF)衍生的空心碳纳米管组成的新型涂层材料由于其独特的组成和结构类型、可调的孔径和大的表面积等特点,常被用于固相微萃取的样品制备中[21,22]。Lin等[23]采用MOF-5(铁)涂层搅拌棒吸附萃取结合气相色谱-质谱(GC-MS)测定鱼样品中的多氯联苯。Liu等[24]获得了两种由铝基MOF制成的免疫传感器,对呕吐毒素和沙丁胺醇的检测限分别为0.70、0.40 pg/mL,灵敏度高。基于MOF的样品制备方法灵敏度高、选择性好、操作简单,具有快速、简便检测食品化学危害的潜力。但MOF也存在相应的缺点,一些MOF的水稳定性较差,结构在溶液中容易坍塌。MOF中存在的结构缺陷限制了MOF作为吸附剂的应用[25,26]。
2 仪器分析方法
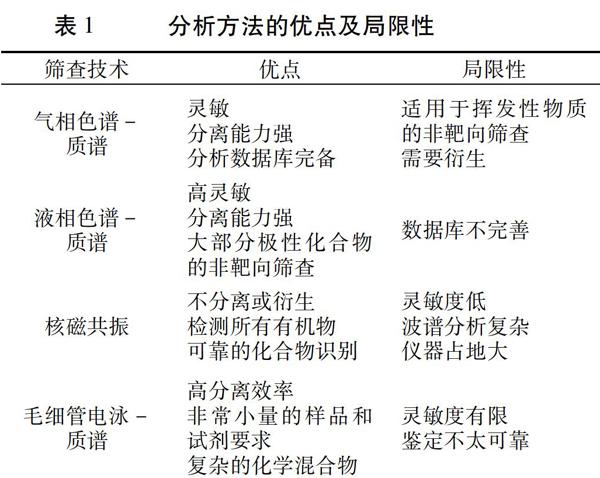
用于非靶向检测的分析技术主要包括气相色谱串联质谱(GC-MS)、液相色谱-质谱(LC-MS)、核磁共振(NMR)、毛细管电泳-质谱(CE-MS)和其他基于光谱的技术[27]。每一种分析技术都有其优点和局限性[28](表1),可根据检测目的和样品性质确定首选方法。如今,由于质谱技术的高选择性和高通量,基于质谱的筛查技术占主导地位。非靶向检测的数据分析包括构建不同的识别数据库、开发数据搜索工具、利用统计模型和数据挖掘以及复合识别。化学计量学方法已经应用于食品分析,使用了如主成分分析(PCA)和多元统计分析等多种方法。
2.1 气相色谱-质谱法
GC-MS已广泛应用于分析食品中挥发物质和非挥发物质衍生物的检测,是一种强大的非靶向筛选工具[5,7,29-31]。气相色谱-飞行时间质谱法(GC-TOF-MS)具有检测速度快、全扫描采集灵敏度高、反褶积和识别效率高的优点,可以通过非靶向和靶向筛查获得大量的分析信息。在GC-MS色谱分离中,食品中的化学危害物或代谢物特征大多需要衍生化以提高其在色谱柱中的保留能力。电子离子化技术(EI)几乎可分离任何有机化合物,且具有稳定性和可重复性,是迄今为止最广泛使用的基于GC-MS的筛查方法。二维气相飞行时间质谱(GC×GC-TOF-MS)是目前检测复杂环境混合物中有机物的通用工具。与GC-MS相比,GC×GC-TOF-MS具有更高的峰容量、灵敏度和选择性,可以缩小或者识别感兴趣的分析物。然而,GC×GC-TOF-MS产生的分析数据量大是其主要瓶颈[32,33]。
高分辨率数据库是非靶向筛选的基础[34,35]。在非靶向农药检测中,Li等[36]建立了439种农药的GC-TOF-MS内部精确质量数据库和质谱光谱库。Zhang等[37]利用GC-TOF-MS建立了187种不同化学成分农药的数据库,以快速筛选蔬菜中的农药残留。该数据库包含了每种农药的MS和MS-MS光谱中离子的保留时间和有效质量。通过化学式匹配对可能的农药进行MS筛选,利用MS-MS光谱可以通过准确的质量测定对产物离子进行结构确认。
2.2 液相色谱-质谱法
由于高分辨率和高质量精度,HRMS是一种有效的非靶向筛查分析技术[38]。典型的HRMS技术利用飞行时间质谱(TOF)和轨道阱质谱技术。TOF/MS和代谢组学方法被用来筛查食品样品中的有害化合物并确证其可能存在的污染物[13,39]。基于精确质量测量的食品中植物毒素和农药残留筛选的轨道阱质谱新技术已见报道[40,41]。轨道阱质谱技术在分析食品中的生物活性物质和新型污染物,尤其是酚类化合物方面,具有巨大优势[42]。广义的非靶向筛查通常需要两次补充色谱运行,以达到最大的化合物覆盖率。串联相互作用液相色谱(HILIC LC)可增加不同类型复杂食品样品非靶向筛选的极性覆盖率[43]。
代谢组学方法已被证明是提供有价值的食品质量和安全应用的重要工具。在靶向筛查中,代谢组学数据被扫描以寻找通常在数据库中识别的特定化合物。但是,在非靶向筛查中,没有可以识别的代谢产物潜在化合物的光谱数据。因此非靶向筛查中需借用相应处理工具进行数据处理,目前较常用的免费软件工具有XCMS和MZmine2等[44]。
通过从HRMS数据中生成分子式来识别化合物需要庞大的数据库,现有数据库有两种类型:MS扫描数据库和MS-MS扫描数据库[45-47]。MS扫描数据库包含化合物的准确质量和含量,其优点是建立过程方便快捷,缺点是误报概率高。MS-MS扫描数据库是目前主流的数据库形式。通过比较未知化合物和纯标准化合物的MS-MS光谱,可以获得化合物的同一性,并通过使用预测的液相色谱-质谱梯度运行的保留时间进行进一步确认。Pang等[48]开发了485种农药的LC-TOF-MS精确质量数据库和光谱库。Wang等[49]使用Q-Orbitrap全MS和MS-MS扫描模式构建了11类兽药的化合物数据库和质谱库。
2.3 核磁共振
作为一种多用途的食品分析工具,核磁共振能够快速同时检测大量化合物,提供定性和可重复的定量信息,并避免过度的样品预处理。核磁共振与多变量统计分析技术相结合被认为是确定食品质量和溯源的有力工具[50,51]。尽管核磁共振技术的灵敏度很低,但具有分析时间短、结果可重复、无损分析和高通量特性等优点,尤其是当没有公开的数据库可以鉴定时,核磁共振可以提供分析物的结构信息。在非靶向筛查中,核磁共振可以通过独特的化学位移与数据库的比对进行化合物的鉴定;同时可以通过分子的立体化学来识别化合物的结构。
2.4 毛细管电泳-质谱
毛细管电泳为食品中混合物提供了一个高效的分离平台,尤其是样品量较小的情况下。毛细管电泳-质谱可提高单个分析中可同时评估的分析物数量[52]。CE-MS是代谢组学研究的理想工具,由于其无需过多的样品制备,具有高效率和分辨率、低样品消耗的优点。许多综述讨论了CE-MS技术在食品非靶向筛查中的应用[53,54],包括检测转基因生物[55]和食品中的核苷和核酸[56],以及新出现的食品安全问题和食品可追溯性方面的污染物分析。
2.5 基于光谱学的其他技术
拉曼光谱法、傅立叶变换红外光谱法(FT-IR)和近红外光谱法(FT-NIR)也被应用于食品真实性和故意掺假的非靶向筛查中[57,58]。与其他技术相比,FT-NIR光谱法具有样品处理简单、成本低、样品量大、分析方法快速、可靠等优点。表面增强拉曼光谱(SERS)是一种基于拉曼散射和表面增强机制的高灵敏度分析技术。SERS可以提供分析物的指纹信息,同时也被认为是一种超灵敏的无标签检测方法[59]。更重要的是,SERS的发射带较窄,在复杂样品中具有很大的优势。Wu等[60]采用溶剂驱动自组装金纳米粒子(AuNPs),快速、靈敏地检测具有SER的不同商业产品中的食品添加剂。目前,食品样品非靶向筛选的SER尚处于探索的初始阶段。最近在光学设计、热电制冷和化学计量学软件方面的突破可能会加速其在非靶向筛查中的应用。
3 結论和展望
本研究对食品安全非靶向筛查中的样品制备、样品分析和数据处理进行了梳理。非靶向筛查的最大优点是检测异常样本而不识别所有峰值。食品安全的非靶向筛查技术还需要进一步降低检出限、提高其灵敏度和特异性,尤其是便携式仪器的小型化以及样品制备步骤的简单化。使用昂贵仪器的高分辨质谱对于缩小未知化合物的可能识别列表至关重要。代谢组学方面,急需不需样品制备即可利用质谱界面获取特定分子空间分布信息的技术,基质辅助激光解吸电离成像质谱(MALDI-MS)可用来分析组织和单细胞水平的代谢物或蛋白质。MALDI-MS为非靶向筛查中污染物的早期检测提供可能。样品前处理技术和分析平台将提高食品质量和安全研究的相关性。数据分析和复合识别是食品基质非目标筛选分析的瓶颈,可以通过开发先进的数据处理工具和综合的MS或MS数据库加以改进。
参 考 文 献:
[1]Abbas O, Zadravec M, Baeten V, et al. Analytical methods used for the authentication of food of animal origin[J]. Food Chem., 2018, 246:6-17.
[2]Kunzelmann M, Winter M, Aberg M, et al. Non-targeted analysis of unexpected food contaminants using LC-HRMS[J]. Anal. Bioanal. Chem., 2018, 410:5593-5602.
[3]Ortiz X, Korenkova E, Jobst K J, et al. A high throughput targeted and nontargeted method for the analysis of microcystins and anatoxin-A using online solid phase extraction coupled to liquid chromatography-quadrupole time-of-flight high resolution mass spectrometry[J]. Anal. Bioanal. Chem., 2017, 409:4959-4969.
[4]Shepherd L V,Fraser P,Stewart D.Metabolomics:a second-generation platform for crop and food analysis[J].Bioanalysis, 2011,3:1143-1159.
[5]Hakme E, Lozano A, Gomez-Ramos M M,et al. Non-target evaluation of contaminants in honey bees and pollen samples by gas chromatography time-of-flight mass spectrometry[J]. Chemosphere, 2017, 184:1310-1319.
[6]Bueno M J M, Diaz-Galiano F J, Rajski L, et al. A non-targeted metabolomics approach to identify food markers to support discrimination between organic and conventional tomato crops[J]. J. Chromatogr. A, 2018, 1546: 66-76.
[7]Johanningsmeier S D, Harris G K, Klevorn C M. Metabolomic technologies for improving the quality of food: practice and promise[J]. Annu. Rev. Food Sci. Technol.,2016,7:413-438.
[8]García-Caas V, Simó C, Herrero M, et al. Present and future challenges in food analysis: foodomics[J]. Anal. Chem., 2012, 84: 10150-10159.
[9]Ibáez C, Simó C, García-Caas V, et al. The role of direct high-resolution mass spectrometry in foodomics[J]. Anal. Bioanal. Chem., 2015, 407: 6275-6287.
[10]Fu Y Q, Zhou Z H, Kong H W, et al. Nontargeted screening method for illegal additives based on ultrahigh-performance liquid chromatography-high-resolution mass spectrometry[J]. Anal. Chem., 2016, 88: 8870-8877.
[11]Knolhoff A M, Croley T R. Non-targeted screening approaches for contaminants and adulterants in food using liquid chromatography hyphenated to high resolution mass spectrometry[J]. J. Chromatogr. A, 2016, 1428:86-96.
[12]Rmisch-Margl W, Prehn C, Bogumil R, et al. Procedure for tissue sample preparation and metabolite extraction for high-throughput targeted metabolomics[J]. Metabolomics, 2011,8:133-142.
[13]Tengstrand E, Rosen J, Hellenas K E, et al. A concept study on non-targeted screening for chemical contaminants in food using liquid chromatography-mass spectrometry in combination with a metabolomics approach[J]. Anal. Bioanal. Chem., 2013, 405:1237-1243.
[14]Kalogiouri N P, Aalizadeh R, Thomaidis N S. Application of an advanced and wide scope non-target screening workflow with LC-ESI-QTOF-MS and chemometrics for the classifcation of the Greek olive oil varieties[J]. Food Chem., 2018, 256:53-61.
[15]Hu X R,Wang C H,Li J S,et al.Metal-organic framework-derived hollow carbon nanocubes for fast solid-phase microextraction of polycyclic aromatic hydrocarbons[J]. ACS Appl. Mater. Interfaces, 2018, 10: 15051-15057.
[16]Celeiro M, Facorro R, Dagnac T, et al. Simultaneous determination of trace levels of multiclass fungicides in natural waters by solid-phase microextraction-gas chromatography-tandem mass spectrometry[J]. Anal. Chim. Acta, 2018, 1020: 51-61.
[17]Baduel C, Mueller J F, Tsai H, et al. Development of sample extraction and clean-up strategies for target and non-target analysis of environmental contaminants in biological matrices[J]. J. Chromatogr.A,2015,1426(24):33-47.
[18]Lei H Y,Guo J B,Lv Z,et al. Simultaneous determination of nitroimidazoles and quinolones in honey by modifed QuEChERS and LC-MS/MS analysis[J]. Int. J. Anal. Chem., 2018: 4271385.
[19]Garcia R, Cabrita M J, Costa Freitas A M. Application of molecularly imprinted polymers for the analysis of pesticide residues in food—a highly selective and innovative approach[J]. Am. J. Anal. Chem,2011,2:16-25.
[20]Maier N M, Buttinger G, Welhartizki S, et al. Molecularly imprinted polymer-assisted sample clean-up of ochratoxin A from red wine: merits and limitations[J]. J. Chromatogr. B, 2004, 804:103-111.
[21]Shi X R, Chen X L, Hao Y L, et al. Magnetic metal-organic frameworks for fast and effcient solid-phase extraction of six Sudan dyes in tomato sauce[J]. J. Chromatogr. B, 2018, 1086: 146-152.
[22]Vikrant K, Tsang D C W, Raza N, et al. Potential utility of metal-organic framework-based platform for sensing pesticides[J]. ACS Appl. Mater. Interfaces, 2018, 10: 8797-8817.
[23]Lin S C, Gan N, Qiao L, et al, Magnetic metal-organic frameworks coated stir bar sorptive extraction coupled with GC-MS for determination of polychlorinated biphenyls in fish samples[J]. Talanta, 2015, 144:1139-1145.
[36]Li J X, Li X Y, Chang Q Y, et al. Screening of 439 pesticide residues in fruits and vegetables by gas chromatography–quadrupole-time-of-flight mass spectrometry based on TOF accurate mass database and Q-TOF spectrum library[J]. J. AOAC Int., 2018, 101: 1631-1638.
[37]Zhang F, Yu CT, Wang WW, et al. Rapid simultaneous screening and identifcation of multiple pesticide residues in vegetables[J]. Anal. Chim. Acta, 2012, 757: 39-47.
[38]Knolhoff A M, Zweigenbaum J A, Croley T R. Nontargeted screening of food matrices: development of a chemometric software strategy to identify unknowns in liquid chromatography-mass spectrometry data[J]. Anal. Chem., 2016, 88: 3617-3623.
[39]Inoue K, Tanada C, Hosoya T, et al. Principal component analysis of molecularly based signals from infant formula contaminations using LC-MS and NMR in foodomics[J]. J. Sci. Food Agric., 2016, 96: 3876-3881.
[40]Hayward D G, Wong J W, Zhang K, et al. Multiresidue pesticide analysis in ginseng and spinach by nontargeted and targeted screening procedures[J]. J. AOAC Int., 2011, 94: 1741-1751.
[41]Mol H G, Van Dam R C, Zomer P, et al. Screening of plant toxins in food, feed and botanicals using full-scan high-resolution (Orbitrap) mass spectrometry[J]. Food Addit. Contam. Part A, 2011, 28: 1405-1423.
[42]Senyuva H Z, Gokmen V, Sarikaya E A. Future perspectives in Orbitrap-high-resolution mass spectrometry in food analysis: a review[J]. Food Addit. Contam. Part A, 2015, 32: 1568-1606.
[43]Hemmler D,Heinzmann S S,Wohr K,et al.Tandem HILIC-RP liquid chromatography for increased polarity coverage in food analysis[J]. Electrophoresis, 2018, 39: 1645-1653.
[44]Myers O D, Sumner S J, Li S, et al. Detailed investigation and comparison of the XCMS and MZmine 2 chromatogram construction and chromatographic peak detection methods for preprocessing mass spectrometry metabolomics data[J]. Anal. Chem., 2017, 89: 8689-8695.
[45]Jia W, Chu X G, Chang J, et al. High-throughput untargeted screening of veterinary drug residues and metabolites in tilapia using high resolution Orbitrap mass spectrometry[J]. Anal. Chim. Acta, 2017, 957: 29-39.
[46]Wang Z F, Jablonski J E. Targeted and non-targeted detection of lemon juice adulteration by LC-MS and chemometrics[J]. Food Addit. Contam. Part A, 2016, 33: 560-573.
[47]Zendong Z, McCarron P, Herrenknecht C, et al. High resolution mass spectrometry for quantitative analysis and untargeted screening of algal toxins in mussels and passive samplers[J]. J. Chromatogr. A, 2015, 1416: 10-21.
[48]Pang G F, Fan C L, Chang Q Y, et al. Screening of 485 pesticide residues in fruits and vegetables by liquid chromatography-quadrupole-time-of-flight mass spectrometry based on TOF accurate mass database and QTOF spectrum library[J]. J. AOAC Int., 2018, 101: 1156-1182.
[49]Wang J, Leung D, Chow W, et al. Target screening of 105 veterinary drug residues in milk using UHPLC/ESI Q-Orbitrap multiplexing data independent acquisition[J]. Anal. Bioanal. Chem., 2018, 410: 5373-5389.
[50]Maulidiani M, Mediani A, Abas F, et al. 1H NMR and antioxidant profles of polar and non-polar extracts of persimmon (Diospyros kaki L.): metabolomics study based on cultivars and origins[J]. Talanta, 2018, 184: 277-286.
[51]Fan K, Zhang M. Recent developments in the food quality detected by non-invasive nuclear magnetic resonance technology[J]. Crit. Rev. Food Sci. Nutr., 2018, 16: 1-12.
[52]Acunha T, Ibáez C, Garcia-Caas V, et al. Recent advances in the application of capillary electromigration methods for food analysis and foodomics[J]. Electrophoresis, 2016, 37: 111-141.
[53]Ibáez C, Acunha T, Valdes A, et al. Capillary electrophoresis in food and foodomics[J]. Methods Mol. Biol., 2016, 1483: 471-507.
[54]Simó C, Cifuentes A, Kasicka V. Capillary electrophoresis-mass spectrometry for peptide analysis: target-based approaches and proteomics/peptidomics strategies[J]. Methods Mol. Biol., 2013, 984:139-151.
[55]García-Villalba R, León C, Dinelli G, et al. Comparative metabolomic study of transgenic versus conventional soybean using capillary electrophoresis-time-of-flight mass spectrometry[J]. J. Chromatogr. A, 2008, 1195: 164-173.
[56]Mateos-Vivas M, Domínguez-lvarez J, Rodríguez-Gonzalo E, et al. Capillary electrophoresis coupled to mass spectrometry employing hexafluoro-2-propanol for the determination of nucleosides and nucleotide mono-, di- and tri-phosphates in baby foods[J]. Food Chem., 2017, 233: 38-44.
[57]Karunathilaka S R, Kia A F, Srigley C, et al. Nontargeted, rapid screening of extra virgin olive oil products for authenticity using near-infrared spectroscopy in combination with conformity index and multivariate statistical analyses[J]. J. Food Sci., 2016, 81(10):C2390-C2397.
[58]Botros L L, Jablonski J, Chang C, et al. Exploring authentic skim and nonfat dry milk powder variance for the development of nontargeted adulterant detection methods using nearinfrared spectroscopy and chemometrics[J]. J. Agric. Food Chem., 2013, 61: 9810-9818.
[59]Liao W, Lu X N. Determination of chemical hazards in foods using surface-enhanced Raman spectroscopy coupled with advanced separation techniques[J]. Trends Food Sci. Technol., 2016, 54: 103-113.
[60]Wu Y P, Yu W F, Yang B H, et al. Self-assembled two-dimensional gold nanoparticle film for sensitive nontargeted analysis of food additives with surface-enhanced Raman spectroscopy[J]. Analyst, 2018, 143: 2363-2368.
收稿日期:2019-07-01;修回日期:2019-09-02
基金項目:山东省农业科学院农业科技创新工程项目“山东主要农产品质量安全风险评估与控制技术”(CXGC2016B17)
作者简介:王磊(1977—),男,助理研究员,主要从事农产品风险预警与控制技术研究。
通讯作者:赵善仓(1972—),男,研究员,博士,主要从事农产品质量安全及营养研究工作。E-mail:shancangzhao@126.com

