藤黄酸诱导结直肠癌Caco2细胞自噬和凋亡
戴 维,赵 燕,赵成进*
(1陕西省人民医院急诊外科,西安 710068;2西安市中心医院肾内科;*通讯作者,E-mail:958714744@qq.com)
结直肠癌是常见的消化系统恶性肿瘤,其严重威胁人类生命健康,寻找安全、有效的治疗方法,延长结直肠癌患者的生存时间是目前急需解决的问题[1]。藤黄酸是从中药藤黄中分离出来的一种单体,也是藤黄中的主要活性成分[2]。最近的研究报道显示,藤黄酸有抗结直肠癌功效,其可诱导结直肠癌细胞发生自噬和凋亡[3],但其具体作用机制尚未完全阐明。Wnt/β-catenin是经典的Wnt信号通路,研究发现,在结肠癌中抑制Wnt/β-catenin信号通路可抑制肿瘤细胞增殖,抑制其上皮间质转化和侵袭转移,并诱导肿瘤细胞凋亡[4-6];此外,有研究表明,藤黄酸通过调控肾癌细胞中Wnt/β-catenin信号通路影响肾癌进展[7]。但藤黄酸能否调控Wnt/β-catenin信号通路进而影响结直肠癌细胞的自噬和凋亡尚未可知。因此,本研究以结直肠癌Caco2细胞作为体外实验对象,观察藤黄酸对结直肠癌细胞凋亡和自噬的影响,初步探索其分子机制,以期为藤黄酸治疗结直肠癌的临床应用提供理论资料。
1 材料与方法
1.1 藤黄酸
藤黄酸CAS号为2752-65-0,纯度>95%,购自上海纯优生物科技有限公司。
1.2 主要试剂
结直肠癌Caco2细胞购自中国医学科学院肿瘤细胞库;C-caspase-9抗体、β-catenin抗体购自美国Santa Cruz公司;C-caspase-3抗体、LC3-Ⅰ/Ⅱ抗体、Beclin 1抗体、C-caspase-9抗体、GAPDH抗体购自美国Abcam;c-myc抗体购自上海赛信通生物试剂有限公司。
1.3 细胞培养
采用含有10%胎牛血清的RPMI1640培养基培养Caco2细胞。培养条件为37 ℃、CO2体积分数为5%的细胞培养箱。每隔1 d更换一次培养液,当细胞汇合度约为80%时用胰酶消化传代。
1.4 细胞凋亡检测
取对数生长期的Caco2细胞,在细胞培养液中加藤黄酸,使藤黄酸终浓度为0,1.5,3.0,6.0 mg/L,依次标记为0 mg/L组、1.5 mg/L组、3.0 mg/L组、6.0 mg/L组,培养48 h,用0.25%胰蛋白酶消化,收集细胞,检测细胞凋亡。检测步骤如下:用冰预冷的PBS溶液将细胞重悬洗涤2次,加结合缓冲液500 μl将细胞配制成单细胞悬浮液,加入PI以及Annexin Ⅴ-FITC染色液,混合均匀,室温避光条件下孵育15 min,流式细胞仪检测细胞凋亡水平。
1.5 β-catenin、c-myc、LC3-Ⅱ、LC3-Ⅰ、Beclin 1、C-caspase-3、C-caspase-9蛋白检测
取对数期的结直肠癌细胞,在细胞培养液中添加藤黄酸,使藤黄酸终浓度为0,1.5,3.0,6.0 mg/L,继续培养48 h,在细胞中添加0.25%的胰蛋白酶消化,收集细胞,在细胞中添加蛋白提取试剂,将混合液放在冰上充分裂解5 min,以细胞刮刀将各组细胞收集,以超声处理10次,每次1 s。4 ℃,10 000 r/min离心15 min,取上清分装。按照BCA方法测定蛋白浓度。蛋白在进行SDS-PAGE电泳前同等体积的上样缓冲液混合,沸水浴5 min使细胞蛋白充分变性。SDS-PAGE分离蛋白,转NC膜,5%牛血清白蛋白溶液中,室温反应2 h,加一抗,4 ℃过夜,加二抗,室温孵育2 h。用ECL发光试剂盒发光。内参为GAPDH,分析蛋白表达变化。β-catenin、c-myc、LC3-Ⅱ、LC3-Ⅰ、Beclin 1、C-caspase-3、C-caspase-9抗体分别用5%牛血清白蛋白封闭液稀释,稀释倍数依次为1∶600、1∶600、1∶800、1∶800、1∶1 000、1∶600、1∶600;二抗以5%牛血清白蛋白封闭液稀释,稀释倍数为1∶4 000。
1.6 激活Wnt/β-catenin信号通路对结直肠癌细胞凋亡和自噬的影响
结直肠癌细胞用含有3.0 mg/L的藤黄酸和10 μmol/L的Wnt/β-catenin激活剂LiCl细胞培养液培养细胞,记为藤黄酸+LiCl组,设置用含有3.0 mg/L的藤黄酸细胞培养液培养细胞为藤黄酸组,细胞培养48 h,流式细胞术检测凋亡,Western blot检测β-catenin、c-myc、LC3-Ⅱ、LC3-Ⅰ、Beclin 1、C-caspase-3、C-caspase-9蛋白表达,检测步骤参考1.5。
1.7 统计学分析
2 结果
2.1 藤黄酸对结直肠癌细胞凋亡影响
不同浓度的藤黄酸处理后的结直肠癌细胞凋亡率升高,细胞中C-caspase-3、C-caspase-9蛋白水平也升高,并且细胞凋亡率和C-caspase-3、C-caspase-9蛋白水平随着藤黄酸作用浓度的增加而升高(见图1,2表1)。提示藤黄酸诱导结直肠癌细胞凋亡。
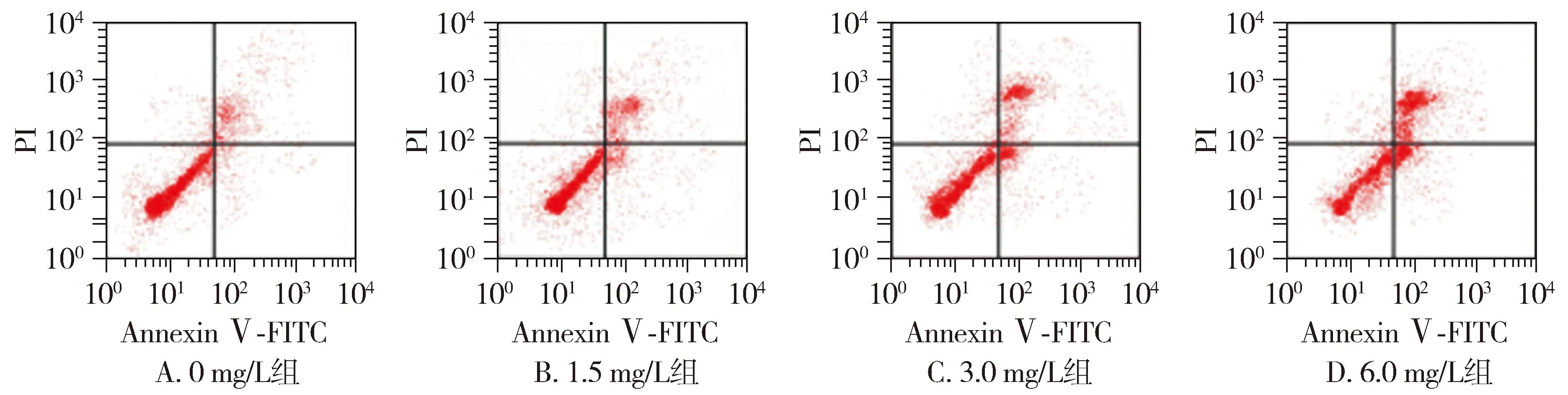
图1 流式细胞术检测藤黄酸处理后结直肠癌细胞凋亡的变化

图2 Western blot检测藤黄酸处理后结直肠癌细胞中C-caspase-3、C-caspase-9蛋白水平的变化
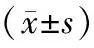

藤黄酸浓度(mg/L)凋亡率(%)C-caspase-3C-caspase-90 2.14±0.320.20±0.030.29±0.021.56.39±1.47∗0.28±0.02∗0.42±0.05∗3.010.68±1.21∗#0.41±0.04∗#0.67±0.08∗#6.019.54±1.84∗#&0.65±0.05∗#&0.86±0.06∗#&F93.29186.00060.341P0.0000.0000.000
与0 mg/L比较,*P<0.05;与1.5 mg/L比较,#P<0.05;与3.0 mg/L比较,&P<0.05
2.2 藤黄酸对结直肠癌细胞自噬蛋白LC3-Ⅱ、LC3-Ⅰ、Beclin 1表达影响
不同浓度的藤黄酸处理后的结直肠癌细胞中LC3-Ⅱ/LC3-Ⅰ、Beclin 1水平升高,并且细胞LC3-Ⅱ/LC3-Ⅰ、Beclin 1水平随着藤黄酸作用浓度的增加而升高(见图3和表2)。提示藤黄酸诱导结直肠癌细胞自噬。

图3 藤黄酸处理后结直肠癌细胞中LC3-Ⅱ、LC3-Ⅰ、Beclin 1蛋白表达



藤黄酸浓度(mg/L)Beclin 1 LC3-Ⅱ/LC3-Ⅰ0 0.30±0.04 0.86±0.091.50.47±0.05∗1.23±0.10∗3.00.76±0.07∗#1.67±0.11∗#6.00.96±0.09∗#&2.21±0.20∗#&F60.836 57.850P0.0000.000
与0 mg/L比较,*P<0.05;与1.5 mg/L比较,#P<0.05;与3.0 mg/L比较,&P<0.05
2.3 藤黄酸对结直肠癌细胞中Wnt/β-catenin信号蛋白β-catenin、c-myc表达影响
不同浓度的藤黄酸处理后的结直肠癌细胞中β-catenin、c-myc水平降低,并且细胞β-catenin、c-myc水平随着藤黄酸作用浓度的增加而降低(见图4和表3)。藤黄酸抑制结直肠癌细胞中Wnt/β-catenin信号激活。
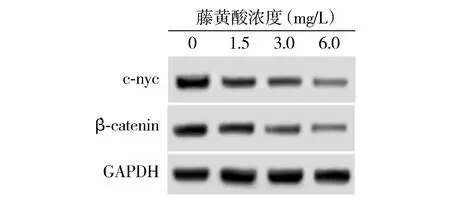
图4 Western blot检测结直肠癌细胞中β-catenin、c-myc蛋白表达


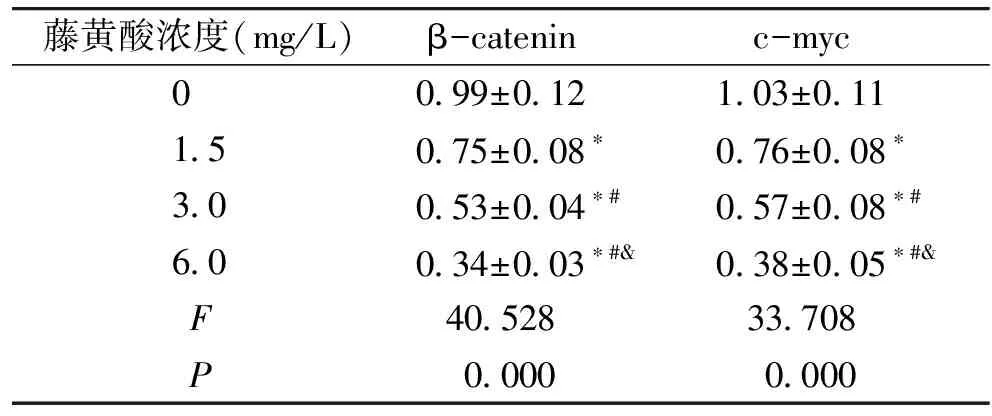
藤黄酸浓度(mg/L)β-catenin c-myc 0 0.99±0.12 1.03±0.11 1.50.75±0.08∗0.76±0.08∗3.00.53±0.04∗#0.57±0.08∗#6.00.34±0.03∗#&0.38±0.05∗#&F40.528 33.708 P0.0000.000
与0 mg/L比较,*P<0.05;与1.5 mg/L比较,#P<0.05;与3.0 mg/L比较,&P<0.05
2.4 激活Wnt/β-catenin信号通路对结直肠癌细胞凋亡和自噬的影响
Wnt/β-catenin激活剂LiCl可以降低藤黄酸条件下结直肠癌细胞凋亡率[(8.63±0.75)%vs(11.68±1.27)%]和C-caspase-3、C-caspase-9蛋白表达水平,降低LC3-Ⅱ/LC3-Ⅰ、Beclin 1水平,提高细胞中β-catenin、c-myc蛋白表达水平(见图5,6和表4)。

图5 流式细胞术测定激活Wnt/β-catenin信号通路对结直肠癌细胞凋亡的影响
Wnt/β-catenin激活剂LiCl可逆转藤黄酸调控结直肠癌细胞凋亡和自噬作用。
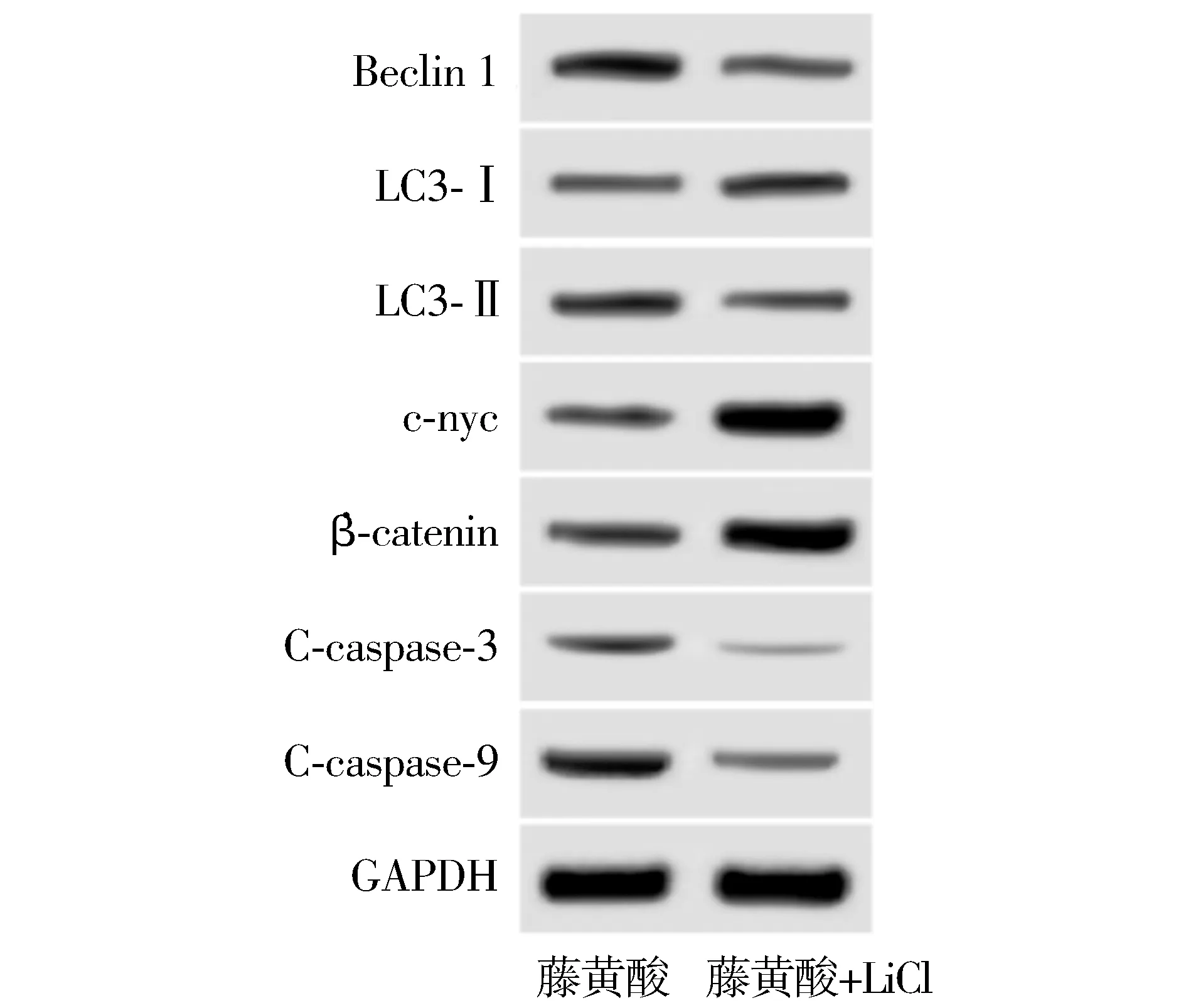
图6 Western blot检测激活Wnt/β-catenin信号通路对结直肠癌细胞自噬的影响


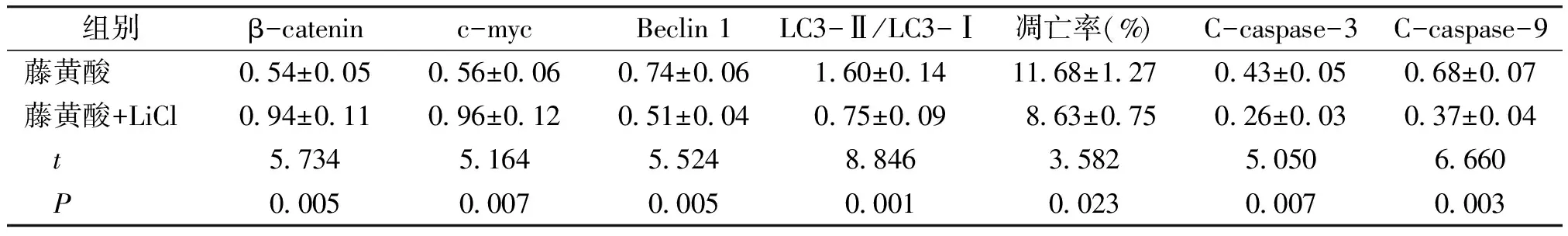
组别β-cateninc-mycBeclin 1LC3-Ⅱ/LC3-Ⅰ凋亡率(%)C-caspase-3C-caspase-9藤黄酸0.54±0.050.56±0.060.74±0.061.60±0.1411.68±1.270.43±0.050.68±0.07藤黄酸+LiCl0.94±0.110.96±0.120.51±0.040.75±0.098.63±0.750.26±0.030.37±0.04 t5.7345.1645.5248.8463.5825.0506.660 P0.0050.0070.0050.0010.0230.0070.003
3 讨论
藤黄是藤黄树分泌形成的干燥树脂,具有止血、解毒、杀虫等作用,藤黄酸是提取自藤黄中的有效活性成分,具有抗肿瘤作用[8]。研究表明,藤黄酸处理后的卵巢癌细胞生长明显受到抑制,凋亡增加,其抗肿瘤作用随后在乳腺癌、胃癌等多种肿瘤中得到证实[9-11]。之前的研究表明,藤黄酸可以降低结直肠癌细胞的增殖、侵袭能力。本实验结果显示,藤黄酸处理后的结直肠癌细胞凋亡率升高,结直肠癌细胞中C-caspase-3、C-caspase-9蛋白水平升高。C-caspase-3、C-caspase-9分别为caspase-3、caspase-9蛋白的活化形式,在caspase凋亡反应中分别位于上游和下游[12]。当受到凋亡信号刺激以后,caspase蛋白成员通过活化和自我活化的方式诱导凋亡级联反应,caspase-3活化是细胞凋亡发生的标志[13,14]。提示,藤黄酸通过caspase-3途径诱导结直肠癌细胞凋亡,这与张海元[3]藤黄酸引发结直肠癌细胞凋亡的结论相吻合。
细胞自噬是一个溶酶体依赖的降解途径,在真核细胞体内广泛存在。自噬能够清除病原微生物、降解衰老或受损的细胞器、调节免疫功能[15]。正常生理条件下,几乎所有的细胞自噬维持在一个较低的水平,这有助于细胞内环境稳态的维持[16]。研究显示,自噬在肿瘤进展中发挥双重作用,在肿瘤形成早期,细胞过度自噬可以抑制肿瘤形成,而在多数情况下,细胞自噬可以促进癌细胞适应代谢应激而促进肿瘤细胞的存活[17]。抗肿瘤药物能够诱导肿瘤细胞自噬[18]。Beclin 1是细胞自噬标志蛋白,其水平升高后标志细胞自噬水平的增加[19]。LC3-Ⅱ、LC3-Ⅰ是自噬蛋白LC3在细胞中存在的两种形式,LC3-Ⅱ被认为是形成自噬体的标志物[20]。本次实验表明,藤黄酸处理后的结直肠癌细胞中Beclin 1水平升高,LC3-Ⅱ/LC3-Ⅰ比值升高,提示藤黄酸可以诱导结直肠癌细胞自噬。
Wnt/β-catenin是经典的Wnt信号传导通路,目前认为,Wnt/β-catenin的异常激活是结肠癌形成的重要因素之一[21]。阻断Wnt/β-catenin信号通路转导可抑制结肠癌细胞增殖,促进细胞凋亡[22]。β-catenin是Wnt/β-catenin信号的关键标志蛋白,c-myc是Wnt/β-catenin信号的下游靶基因,二者水平升高是Wnt/β-catenin信号激活的标志。本次结果显示,藤黄酸处理后的结直肠癌细胞中β-catenin、c-myc蛋白水平下降,Wnt/β-catenin信号通路被抑制。进一步研究发现,激活Wnt/β-catenin信号通路可以逆转藤黄酸对结直肠癌细胞凋亡和自噬的诱导作用,提示藤黄酸通过抑制Wnt/β-catenin信号通路进而诱导结直肠癌细胞凋亡和自噬。
以上表明,藤黄酸可以体外诱导结直肠癌细胞自噬和凋亡,其作用机制与调控Wnt/β-catenin信号激活有关,这为研究藤黄酸抗肿瘤作用机制提供了参考,为藤黄酸治疗结直肠癌的临床应用提供了理论参考。

