T淋巴细胞检测对非结核分枝杆菌病的诊断价值
黄芳 王勃 赵国连 王海东 党丽云
非结核分枝杆菌(non-tuberculous mycobacteria,NTM)是指除结核分枝杆菌、牛分枝杆菌、非洲分枝杆菌和田鼠分枝杆菌等结核分枝杆菌复合群及麻风分枝杆菌以外的分枝杆菌总称。NTM属于机会致病菌,在自然界广泛存在于城市供水系统、饮用水系统、灰尘和土壤等,仅少部分NTM对人体致病,可侵犯肺脏、淋巴结、骨骼、关节、皮肤和软组织等组织器官,并可引起全身播散性疾病。因NTM肺部感染的症状常与肺结核相似,易被误诊为结核分枝杆菌感染而延误病情[1]。本研究对应用流式细胞学技术对临床常见的NTM肺病患者的T淋巴细胞变化情况进行研究,探讨T淋巴细胞计数在结核病患者与NTM肺病患者中的差异,以辅助诊断NTM病。
对象和方法
一、患者来源
收集2013年1月至2019年3月西安市胸科医院经临床综合诊断确诊的143例菌阳肺结核患者(肺结核组)、146例结核性胸膜炎患者(结核性胸膜炎组)、81例结核性脑膜炎患者(结核性脑膜炎组)、175例其他肺部疾病患者(对照组,包括细菌性肺炎101例、支原体肺炎58例、支气管扩张症11例、尘肺5例),以及162例各类NTM肺病患者[NTM组,包括鸟-胞内分枝杆菌(M.avium)病75例、龟-脓肿分枝杆菌(M.chelonea)病45例、戈登分枝杆菌(M.gordonae)病16例、堪萨斯分枝杆菌(M.kansasii)病17例、偶然分枝杆菌(M.fortuitum)病9例]。收集全部患者的T淋巴细胞流式细胞学分析结果,将NTM组与其他4组患者的T淋巴细胞变化情况进行比对分析,总结流式细胞学检测NTM肺病患者的T淋巴细胞特点。
二、诊断标准
1.结核病相关诊断:依据《WS 288—2017 肺结核诊断》[2],菌阳肺结核、结核性胸膜炎、结核性脑膜炎以病原学(包括分子生物学及细菌学)、病理学检查为确诊依据,结合流行病史、临床表现、胸部影像、相关辅助检查进行临床综合诊断。(1)菌阳肺结核患者:有典型的肺结核临床症状,胸部影像学提示结核病灶,病理学检查可见结核病变,细菌学诊断中分枝杆菌痰涂片和培养均阳性,由于原发性结核病患者较少,本研究排除原发性结核病患者;(2)结核性脑膜炎患者:有结核中毒症状及颅内高压症状,伴有脑膜刺激征及其他神经系统症状体征;脑脊液生化指标腺苷脱氨酶(ADA)升高,脑脊液胞内结核分枝杆菌涂阳或培阳,分子生物学检测阳性,结核感染T细胞斑点试验(T-SPOT.TB)检查阳性,实验室检查满足任意两项即可;抗结核药物治疗有效的患者;(3)结核性胸膜炎患者:有胸膜炎的临床体征,胸部影像学检查或B超提示胸腔积液,胸膜表面可见结核病变;胸腔积液生化指标ADA升高,结核分枝杆菌涂阳或培阳,分子生物学检查阳性,T-SPOT.TB检查阳性,实验室检查满足任两项即可;抗结核治疗有效的患者。
2.其他肺部疾病患者:(1)支气管扩张症患者:有肺炎或支气管肺炎病史,长期反复咳嗽甚至咯血,肺部有湿性啰音,影像学检查可见肺纹理增粗增多,CT检查可见扩张的支气管,支持支气管扩张症诊断,抗结核药物治疗无效,结核病相关实验室检查不支持结核病诊断的患者;(2)尘肺患者:依据2015年颁布的《GBZ 70—2015职业性尘肺病的诊断》[3]标准,选取有确定职业性粉尘接触史,对照尘肺诊断标准片,可见小阴影总体密度至少1级、分布范围至少达到2个肺区,结合临床表现及实验室检查排除其他肺部疾病的患者;(3)肺炎患者:有肺炎的临床表现,体检可有干湿性啰音,胸片有肺部浸润影,白细胞计数检查出现中性粒细胞增高或淋巴细胞增高,痰标本普通菌培养阳性,支持细菌性肺炎诊断,若外周血支原体检查阳性,则支持支原体肺炎诊断。
3.NTM肺病患者:依据《非结核分枝杆菌病诊断与治疗专家共识》[4],由临床高年资的医师、影像学专家和细菌学专家共同诊断。具有呼吸系统症状和(或)全身症状,经胸部影像学检查发现有空洞性阴影、多灶性支气管扩张及多发性小结节病变等,已排除其他疾病,并在确保标本无外源性污染的前提下,符合以下条件之一者可做出NTM肺病的诊断:(1)痰NTM培养2次均为同一致病菌;(2)肺泡灌洗液中NTM培养阳性1次,阳性级别为“++”以上;(3)肺泡灌洗液中NTM培养阳性1次,抗酸杆菌涂片阳性级别为“++”以上;(4)经支气管镜或其他途径的肺组织活检,发现分枝杆菌病的组织病理学特征性改变(肉芽肿性炎症或抗酸染色阳性),并且NTM培养阳性;(5)肺组织活检发现分枝杆菌病的组织病理学特征性改变(肉芽肿性炎症或抗酸染色阳性),并且痰标本和(或)肺泡灌洗液中NTM培养阳性≥1次。NTM肺病不同菌种采用DNA微阵列芯片法进行菌种鉴定以确诊。
三、研究方法
1.菌株涂片方法:采用萋-尼抗酸染色,按照《分枝杆菌分离培养标准化操作程序及质量保证手册》[5]中的标准化操作程序执行。一次性吸管吸取培养后菌液0.1 ml,于玻片中央涂抹成圆形菌液薄膜,自然干燥后进行萋-尼抗酸染色镜检。
2.菌株培养试验方法:采用BACTEC MGIT 960液体培养方法,按照《分枝杆菌分离培养标准化操作程序及质量保证手册》[5]中的标准化操作程序执行。试剂来源:分枝杆菌培养管及分枝杆菌培养添加剂、试剂盒购自美国BD公司。具体方法为取处理好的痰液标本0.5 ml加至MGIT液体培养管中,放入BACTEC MGITTM960液体培养系统中进行培养,报阳后取出。
3.菌种鉴定方法:采用DNA微阵列芯片法[6]检测分枝杆菌培养阳性菌株进行分枝杆菌菌种鉴定。DNA微阵列芯片法试剂盒由成都博奥晶芯生物科技有限公司生产。从培养阳性菌液中提取分枝杆菌DNA,按照分枝杆菌菌种鉴定试剂盒说明书进行PCR扩增,再将扩增后的产物加入芯片,放入杂交仪杂交孵育后放入芯片洗涤仪洗涤芯片,最后应用芯片扫描仪扫描判读即可。扫描仪根据不同位点的荧光强度进行判读,可同时快速检测 17 种分枝杆菌,包括结核分枝杆菌、胞内分枝杆菌、鸟分枝杆菌、戈登分枝杆菌、堪萨斯分枝杆菌、偶然分枝杆菌、瘰疬分枝杆菌、浅黄分枝杆菌、土分枝杆菌、龟-脓肿分枝杆菌、草分枝杆菌、不产色分枝杆菌、海-溃疡分枝杆菌、金色分枝杆菌、苏尔加分枝杆菌、蟾蜍分枝杆菌及耻垢分枝杆菌。
4.流式细胞学检查方法:流式细胞仪型号为BD FACSCanto ⅡTM,BD Trucount Tube绝对计数管及淋巴细胞亚群检测试剂盒为美国BD公司生产。具体方法:采集患者外周静脉血2 ml于乙二胺四乙酸(EDTA)抗凝管中,取一支BD Trucount Tube绝对计数管加入50 μl充分混匀的抗凝全血,再加入20 μl异硫氰酸荧光素(BD Tritest CD4 FITC)/藻红蛋白(CD8 PE)/多甲藻素叶绿素蛋白(CD3 PerCP)抗体试剂,轻轻涡旋振荡混匀,在室温下(20~25 ℃)避光孵育15 min,再向管中添加450 μl BD FACS溶血素,轻轻涡旋振荡混匀,在室温下(20~25 ℃)避光孵育15 min后放入流式细胞仪进行检测。最后使用BD Multiset软件确定绝对计数结果。
四、统计学处理
采用SPSS 23.0软件进行统计学方析。非正态分布的计量资料以中位数(四分位数)[M(Q1,Q3)]表示,采用非参数Kruskal-WaillsH检验比较5组患者,以及不同NTM肺病患者T淋巴细胞的流式细胞学检查结果的差异,以P<0.05为差异有统计学意义。
结 果
一、NTM组与其他4组流式细胞学检查T淋巴细胞结果
本研究对NTM组、涂阳肺结核组、结核性胸膜炎组、结核性脑膜炎组、对照组患者的T淋巴细胞计数检查结果进行对比分析,结果显示除NTM组与对照组患者CD4+CD8+T淋巴细胞计数差异无统计学意义外,5组患者间总T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞、CD4+CD8+T淋巴细胞计数的差异均有统计学意义(P值均<0.05)。见表1。
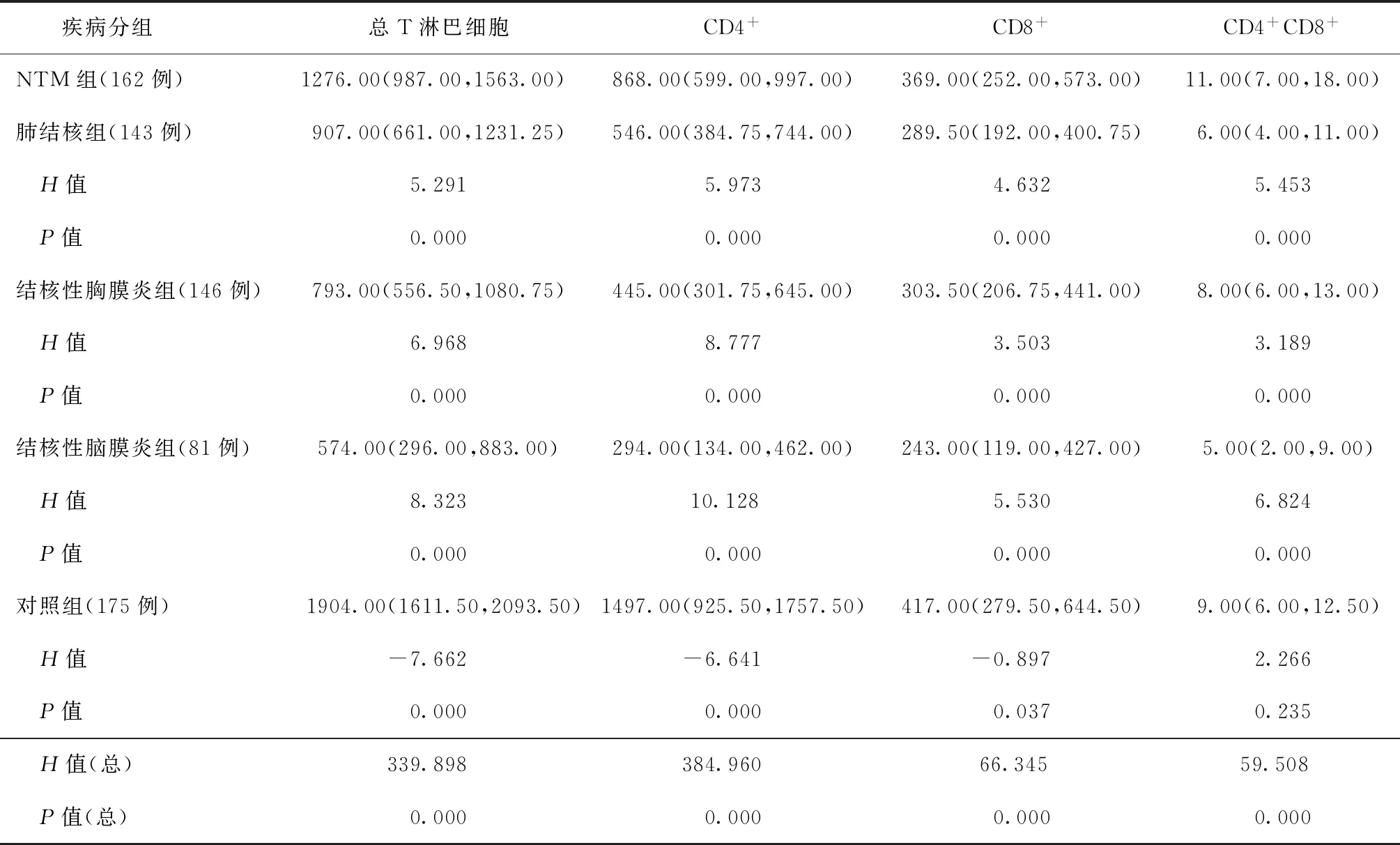
表1 各组研究对象T淋巴细胞计数的比较[个/μl,M(Q1,Q3)]
二、NTM 病的T淋巴细胞流式细胞检查结果
结果显示,5种不同NTM 病的T淋巴细胞计数间差异均无统计学意义(P值均>0.05)(表2)。
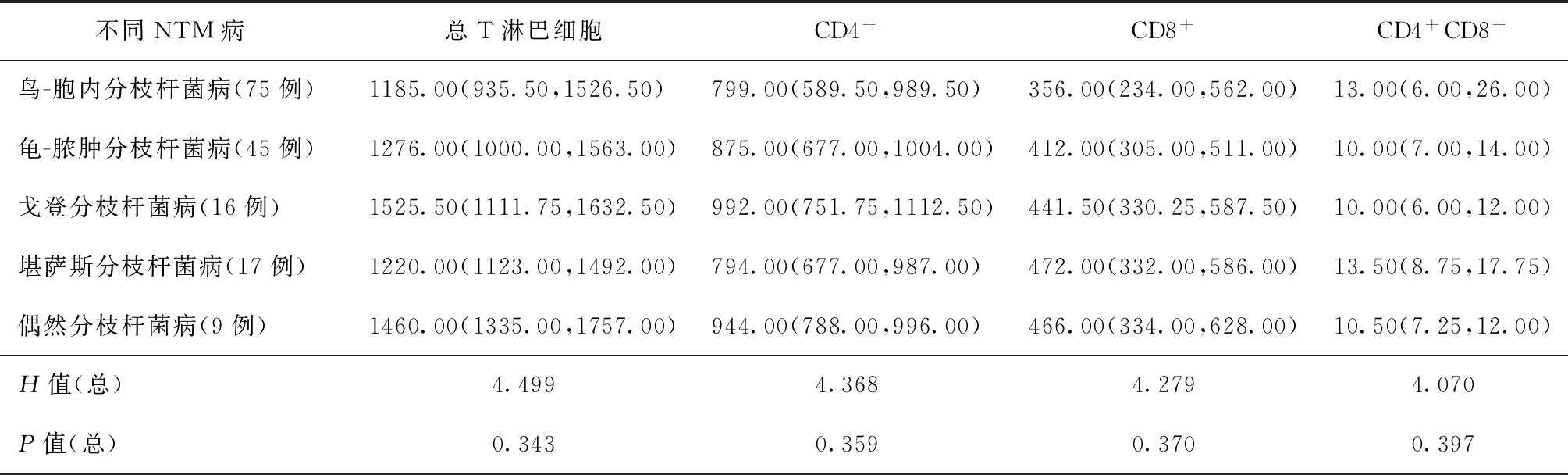
表2 不同NTM病T淋巴细胞计数结果比较[个/μl,M(Q1,Q3)]
讨 论
近年来NTM感染患者数呈增加趋势,在被确诊的结核病患者中的分离率为22.9%,且存在自南向北、自东向西逐渐降低的地域特点[7-8]。由于NTM的主要易感人群为免疫力低下或有肺部基础疾病的患者[1],且与肺结核的临床症状及影像学表现极为相似,但治疗方法完全不同,使得其与结核病的鉴别尤为重要。在抗结核免疫中,T淋巴细胞是机体免疫防御的关键,由T淋巴细胞介导的适应性免疫应答决定了结核分枝杆菌和宿主间的相互作用,进而影响疾病的发生发展和转归[9-10]。本研究应用回顾性研究方法,总结NTM肺病的T淋巴细胞计数特点,结果显示流式细胞学检测NTM肺病患者T淋巴细胞计数对临床诊断有辅助价值。
NTM病患者的T淋巴细胞主要通过CD4+T淋巴细胞等介导免疫反应和迟发型变态反应,主要分泌γ-干扰素(INF-γ)和白细胞介素-12(IL-12)等,激活中性粒细胞和巨噬细胞以杀灭NTM[11-12]。而在结核病患者中结核分枝杆菌感染可显著降低机体细胞免疫功能,表现在总T淋巴细胞计数下降,CD3+、CD4+、CD4+CD8+T淋巴细胞均降低,而CD8+T升高[13]。本研究显示,5组患者的T淋巴细胞计数差异有统计学意义,表现为对照组在总T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞计数中最高,其次为NTM组,3组结核病组较低;在CD4+CD8+T淋巴细胞中NTM组和对照组计数较高,结核病组计数较低,提示T淋巴细胞在结核病患者中明显降低,与文献[13]报道一致;NTM患者T淋巴细胞计数高于结核病患者,但同时低于对照组患者,说明T淋巴细胞在NTM患者及不同肺部疾病患者体内的免疫状态不同。这可能与机体对于急性感染与慢性感染的免疫水平差异有关。有报道指出,在急性病毒感染后,抗原特异性记忆CD8+T淋巴细胞具有生物学功能,是保护性免疫的重要组成;而在慢性感染中,CD8+T淋巴细胞常常出现不同程度的特异性功能受损,这种受损可能是宿主不能及时有效清除病原体使其持续存在的主要原因[14]。
本研究也显示,不同部位结核病患者中T淋巴细胞的降低幅度不一致,即结核性脑膜炎患者的各项T淋巴细胞计数最低,肺结核患者的总T淋巴细胞和CD4+T淋巴细胞计数均高于结核性胸膜炎患者,但CD8+和CD4+CD8+T淋巴细胞均低于结核性胸膜炎患者。可能与T淋巴细胞是通过分泌细胞因子的相互作用来联合调控形成结核感染的特殊感染灶微环境有关。在结核性胸膜炎患者中存在Th1/Th2免疫应答功能紊乱[15-16],当以Th1细胞免疫占主导时,Th1细胞产生IL-2、INF-γ细胞因子,由于INF-γ可刺激机体产生活性氮介质,进而激活巨噬细胞以清除胞内菌并分泌趋化因子吸引炎性细胞向感染部位聚集,促进局部肉芽肿形成,有利于疾病治愈;而当以Th2细胞免疫占主导时,由于Th2细胞主要通过分泌作用于B淋巴细胞的参与体液免疫的IL-4、IL-6和IL-10等细胞因子来抑制Th1细胞介导的免疫反应,并使巨噬细胞失活,不利于疾病治愈;另外,Th17细胞的重要执行细胞CD4+T淋巴细胞可分泌具有强大促炎作用的IL-17、IL-21、肿瘤坏死因子α和IL-22等促炎性因子,促使间质细胞产生一系列的细胞因子,趋化白细胞到病灶集中、成熟、活化,而活化的白细胞释放溶酶体酶等物质加重炎症反应[17]。在结核感染初期,CD4+T淋巴细胞因参与早期抗结核反应而升高;至疾病后期,CD4+T淋巴细胞下降,可能与机体反向调节及T淋巴细胞功能耗竭有关[18-20]。本研究中肺结核与结核性脑膜炎患者的T淋巴细胞计数均具有以上变化规律,但后者细胞降低更多,提示后者免疫水平受损更为严重。
综上所述,通过对5组患者T淋巴细胞计数情况的研究,可以初步判断T淋巴细胞计数在不同患者中的变化情况,总T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞计数以对照组最高,其次为NTM组,3组结核病患者最低,认为应用流式细胞仪进行T淋巴细胞计数的检测可辅助临床诊断NTM病。

