TNF-α、IL-1β预激活骨髓间充质干细胞条件培养基修复急性辐射小肠黏膜损伤
叶山亮,周伟杰,郭科航,卓泽伟,卢铨,张宸,骆昱均,陈浩,沙卫红
急性辐射小肠损伤(radiation-induced intestinal injury,RIII)是放射性治疗常见的并发症,尤其是盆腔、腹腔恶性肿瘤病人接受放射治疗后,发生率高达75%[1]。常见临床表表现为腹痛、腹泻、便血等,严重损伤患者出现血样腹泻、消化不良、脂肪泻、贫血、全身感染等,严重影响着患者的生活质量[2-3]。然而,目前的临床治疗疗效有限。因此,临床上需要更好的治疗方法。
骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)是一类能够自我更新并且有多向分化能力的干细胞。当前多项研究显示BM-MSCs移植对修复肠道黏膜损伤有良好的治疗作用[4],如炎症性肠病[5]、坏死性小肠结肠炎[6]和肠缺血再灌注损伤[7]均有明显的修复疗效。除此之外,间充质干细胞还具有抑制炎症和直接促进再生的作用[8]。然而,在BM-MSCs移植中,存在医源性肿瘤形成的可能、细胞排斥反应和输注毒性的风险,而且BM-MSCs静脉注射后,大部分细胞以微小的栓子形式滞留在肺脏、肝脏内,减少了它们在病灶中的含量以及作用[9-10]。以上的不足严重限制了BM-MSC移植的临床应用。
骨髓间充质干细胞条件培养基(conditioned medium derived from bone marrow-mesenchymal stem cells, MSC-CM)含有间充质干细胞的旁分泌因子以及营养因子,可以下调炎症,起到保护肠黏膜的作用,还可避免BM-MSCs移植的不足,被认为是BM-MSCs的理想替代。课题组前期发现TNF-α、IL-1β预刺激BM-MSCs后,可以增加其旁分泌的作用,但目前关于TNF-α、IL1β诱导的骨髓MSC-CM修复RIII的研究尚少。本研究旨在探讨炎症因子TNF-α、IL-1β预刺激骨髓MSC-CM与正常状态下MSC-CM修复受损肠黏膜的差异以及作用机制,为BM-MSCs来源的条件培养基治疗RIII提供实验依据以及理论基础。
1 材料与方法
1.1 实验动物、主要试剂
无特定病原体(specific pathogen free,SPF)雌Sprague-Dawley(SD)大鼠80只,平均体重约153.47 g,4~5周龄,用于构建RIII模型。雌性SD大鼠10只,3~4周龄,体重在60~100 g,用于获取BM-MSCs。SD大鼠均由北京维通利华实验动物技术有限公司提供,饲养于华南理工大学SPF级别动物中心。所有动物经检疫符合实验动物标准,实验方法符合医学伦理学要求。
骨髓间充质干细胞培养基(Cyagen公司),胎牛血清(美国Hycolne公司),抗大鼠CD29-FITC、CD34-FITC、CD44-FITC、CD45-FITC单克隆抗体(美国Biolegend公司),成骨分化培养基(Cyagen公司)、成脂分化培养基(Cyagen公司)。TNF-α细胞因子(Cyagen公司)、IL1β细胞因子(Cyagen公司)DMEM-F12培养基(美国Hycolne公司)、TrypLEExpress胰酶替代物(美国Invitrogen 公司)。ELISA试剂盒(美国R&D公司)
1.2 方法
1.2.1 骨髓间充质干细胞分离、培养与鉴定 SD大鼠颈椎脱臼法处死后,摘除双侧股骨和胫骨,DMEM-F12培养基冲出骨髓,于离心机1 000 r/min,离心5 min,分离红细胞及细胞碎片,再用体积分数为10%胎牛血清的BM-MSCs专用培养基重悬浮细胞,细胞悬液培养于T25瓶,置于37 ℃、体积分数为5% CO2、湿度90%的细胞培养箱内培养,每隔3 d换液。通过换液、传代纯化细胞,细胞培养至P3-P5,用作后续实验。流式细胞仪对MSC细胞表型CD29、CD34、CD44、CD45进行鉴定。行成骨、成脂分化进行分化鉴定。
1.2.2 骨髓间充质干细胞条件培养基配置 条件培养基参照课题组方法配置。BM-MSCs融合度达到70%~80%时,放置低氧条件下培养,氧体积分数为0.5%,6h后加入外源TNF-α(6 ng/mL, Cyagen公司)与IL-1β(3 ng/mL,Cyagen公司)联合培养,模拟炎症刺激环境, 24 h后弃去原有培养基,PBS洗涤2次,更换新鲜无血清DMEM-F12培养基继续培养48 h后,收集该细胞培养液,此为TNF-α、IL-1β炎症预激骨髓充质干细胞条件培养基(MSC-CMTNF-α+IL1β)。采用相似的方法,无血清DMEM-F12培养基培养BM-MSCs 48 h后收集培养液体,此为正常状态的无间充质干细胞条件培养基(MSC-CMNOR),储存于-20 ℃冰箱备用。
1.2.3 RIII大鼠模型构建及实验分组 SD大鼠进行吸入性麻醉,麻醉成功后,用铅砖遮蔽除腹部以外的身体部位,利用PRIMUS® H直线加速器(X射线)以300 cGy/min的速率一次性照射,总剂量14.0 Gy进行腹部局部照射。造模成功后,SD大鼠出现腹胀、便血等表现,把SD大鼠按照以下分组:①无干预,正常对照组(n=20只);②RIII+200 μL DMEM-F12(n=20只);③RIII+200 μL MSC-CMNOR(n=20只);④RIII+200 μL MSC-CMTNF-α+IL-1β(n=20只)。每组SD大鼠在接下来的4 h内,尾静脉分别一次性注射200 μL的DMEM-F12培养基、MSC-CMNOR和MSC-CMTNF-α+IL-1β。连续注射3 d,2 mL浓缩条件培养基装于胶囊内,植入腹腔后以10 μL/h的速率匀速释放。
1.2.4 肠道标本H&E染色 在放射损伤后第1、3、5、7天,每组在各个时间点随机取5只大鼠,行颈椎脱臼法处死,距回盲部10~15 cm取出回肠约2 cm,纵行切开肠组织,冰磷酸盐缓冲液(PBS)反复洗涤,10%中性福尔马林中固定,石蜡包埋,切片厚度为 4 μm,苏木素-伊红(HE)染色,进行组织病理分析。取肠道黏膜50 mg,用于后续ELISA炎症因子检测。
1.2.5 小肠组织中促炎因子和抗炎因子水平检测 取上述肠组织,用冰PBS漂洗肠组织,取10 mg肠组织加入1 mL PBS研磨,制备成组织匀浆,4 ℃ 12 000 rpm/min 离心30 min,取上清液,参照说明书,利用ELISA试剂盒检测TNF-α、IL-6、IL-10细胞因子水平。
1.2.6 血清中促炎因子和抗炎因子水平检测 每个节点处死大鼠后,心脏采血1.5 mL,3 000 rpm/min离心10 min,上清为血清血浆,利用ELISA试剂盒检测血清血浆TNF-α、IL-6、IL-33、IL-10细胞因子水平。
1.3 统计学计算

2 结果
2.1 各组大鼠一般情况
对照组SD大鼠呼吸、活动度良好,进食可;RIII组在放射后第4、5、7天分别出现3、3、4只大鼠死亡;MSC-CMNOR处理组在第4、5、6天分别出2、3、3只大鼠死亡;MSC-CMTNF-α+IL1β处理组未见死亡。RIII组和RIII+MSC-CMNOR组大鼠出现明显的活动度减少、腹胀、血便等,症状逐渐加重;而与上述两组比较,MSC-CMTNF-α+IL1β组大鼠则未见明显的的活动度减少、腹胀,偶有血便。四组大鼠辐射前体重分布满足正态分布,各组之间无统计学差异(表1)。辐射后第3天,MSC-CMTNF-α+IL1β组大鼠的体重,比单纯RIII及RIII+MSC-CMNOR组大鼠体重明显更重,见表2。
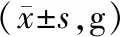
表1各组大鼠的初始体重比较
注:RIII:放射性肠损伤;MSC-CMNOR:正常状态下的骨髓间充质干细胞条件培养基;MSC-CMTNF-α+IL1β:TNF-α、IL1β预激活骨髓间充质干细胞条件培养基
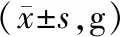
表2各组大鼠在放射后第3天体重
注:RIII:放射性肠损伤;MSC-CMNOR:正常状态下的骨髓间充质干细胞条件培养基;MSC-CMTNF-α+IL1β:TNF-α、IL1β预激活骨髓间充质干细胞条件培养基。*与MSC-CMTNF-α+IL1β干预组比较,P<0.05
2.2 各组大鼠小肠病理改变
放射损伤后第3天,各组病理改变明显。RIII组及RIII+MSC-CMNOR组大鼠肠上皮细胞出现不同程度变性、坏死,绒毛缩短、脱落明显,腺管排列紊乱,隐窝变浅或消失,炎症细胞浸润至黏膜下层。而MSC-CMTNF-α+IL1β治疗组大鼠未见显著的小肠上皮细胞坏死及绒毛缩短,隐窝结构未见明显的病理改变(图1)。
2.3 各组大鼠小肠炎症因子水平
放射后第3天,损伤组及治疗组的炎症因子平衡改变,出现明显的差异。MSC-CMTNF-α+IL1β干预组与RIII组、MSC-CMNOR干预组比较,在小肠黏膜处促炎因子TNF-α、IL-6显著降低(P<0.05),抗炎因子IL-10显著升高(P<0.05);MSC-CMNOR干预组与RIII组比较,TNF-α的升高有统计学差异,而IL-6及IL-10的改变无明显统计学差异,见表3。
2.4 各组大鼠血清中炎症因子水平
在放射后第3天,炎症因子出现显著差异。与RIII组、MSC-CMNOR干预组比较,MSC-CMTNF-α+IL1β干预组幼鼠血清中TNF-α、IL-6、IL-33明显降低(P<0.05),抗炎因子IL-10显著升高(P<0.05);MSC-CMNOR干预组与RIII组比较,促炎因子及抗炎因子未见明显改变,见表4。

图1图为放射后第3天小肠组织学改变(苏木素-伊红染色,10×10)
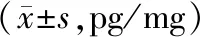
表3各组大鼠肠组织中促炎因子和抗炎因子的水平
注:a与正常组比较,P<0.05;b与RIII组比较,P<0.05;c与MSC-CMNOR处理组比较,P<0.05

表4各组大鼠血清中促炎因子和抗炎因子的水平
注:a与正常组比较,P<0.05;b与RIII组比较,P<0.05;c与MSC-CMNOR处理组比较,P<0.05
3 讨论
RIII是放射性疗法常见的并发症,特别是接受了放射性治疗的腹腔、盆腔恶性肿瘤患者,临床表现多样,轻者表现为腹痛、腹胀、腹泻、血便,病情严重者会出现剧烈的腹痛、血样腹泻、贫血、全身感染等。虽然目前临床治疗有较多的方法,但疗效欠佳,严重地影响着患者的生活质量甚至有生命威胁[11]。随着放射疗法在肿瘤治疗上的应用增多,患病人数也随之增加[12-13],急需更为有效的治疗方法。
RIII的发病机制尚未完全明确,但主要认为是分裂活跃的肠上皮,尤其是肠隐窝干细胞暴露在放射性细胞毒性下的结果[14]。在动物模型与患者的流行病学研究发现,疾病与放射线的剂量、放射性区域内小肠的体积、患者的营养状况有关等因素有关[15-16]。本实验通过对SD大鼠进行准确的射线损伤干预后,成功构建了RIII大鼠模型。大鼠腹胀、便血、活动量减少、体重不增等临床表现明显;病理学检测示小肠绒毛缩短脱落、隐窝消失或变浅、炎症细胞大量浸润等,符合RIII的病理改变。该模型的构建模拟了RIII主要的致病因素,临床表现及病理表现符合RIII,使后续的治疗更有信服力。
随着对疾病的了解,炎症反应被认为在RIII发病机制中起着主要的作用[17-18]。我们利用TNF-α、IL-1β促炎因子,模拟肠道炎症环境,刺激MSCs旁分泌。与RIII损伤组、MSC-CMNOR干预组比较,MSC-CMTNF-α+IL1β干预组能明显地减轻肠道黏膜受损程度,肠组织中观察到促炎因子TNF-α、IL 6显著降低、抗炎因子IL 10明显升高;同时,在血清中也观察到TNF-α、IL 6、IL 10有着相同的改变。MSC-CMTNF-α+IL1β干预组大鼠腹胀、便血等表现均有改善; 而MSC-CMNOR干预后,RIII模型的临床表现及炎症因子无明显改变。本研究表明炎症预刺激MSCs条件培养基能够抑制炎症,修复肠上皮细胞。根据目前国内外的研究,我们推测MSC-CMTNF-α+IL1β抑制炎症反应主要是通过培养基内的外泌体。外泌体是细胞分泌的囊泡样结构,直径在30~100 nm之间,其携带着各种蛋白质及RNA,参与细胞的增殖、分化、炎症调节等多种生命活动[19]。研究表明,在多种疾病模型中,外泌体均表现出抑制炎症的作用。在肠缺血再灌注引起的肺损伤疾病模型中,MSCs来源外泌体可以调节TLR4/NF-κB信号通路,改变促炎因子与抗炎因子的平衡,减轻炎症损伤[20];在结肠炎中,MSCs来源的外泌体通过免疫抑制来减轻炎症,缓解肠黏膜损伤[21];在多发性硬化中,MSCs来源的外泌体通过调节小胶质细胞的极化,缓解中枢神经系统的炎症与脱髓鞘程度[22]。对于RIII,目前研究发现TLR4通路在疾病的修复当中有着重要的作用,TLR4通路的激活可以上调多种细胞因子,如前列腺素E2、粒细胞-巨噬细胞集落刺激因子,修复肠上皮细胞[23-24],从而调节细胞活动,修复损伤。所以,MSCs来源的外泌体可能是调节TLR4信号通路,减少细胞凋亡,促进细胞增殖,平衡促炎因子与抗炎因子水平,减轻炎症程度,从而修复肠黏膜上皮细胞。但目前尚未有证据证明这一假设,需要进一步探讨证实。另外,肠道微菌群的平衡在RIII发病中也起着一定的作用,研究发现,放射性肠损伤的肠道菌群失衡,肠内菌群免疫环境遭破坏,致使肠上皮细胞凋亡[25]。因此,MSCs来源的外泌体也可能通过调节肠道微生物种群的比例及肠道免疫,修复肠道受损黏膜。
总的来说,炎症因子TNF-α、IL1β模拟炎症环境,预激活骨髓间充质干细胞后,可以促进骨髓间充质干细胞的旁分泌,产生更多细胞因子及营养因子。炎症预刺激骨髓间充质干细胞条件培养基通过调节促炎因子与抗炎因子的平衡,抑制炎症,修复辐射性肠损伤受损肠道。这项研究显示炎症预刺激骨髓间充质干细胞条件培养基作为新的治疗方式展示了美好的前景,为日后临床应用打下了实验及理论基础。

