强心合剂对糖尿病心肌病大鼠心肌结构及胶原蛋白表达的影响
宋春晖 龚志刚 李林 付建平 唐娜娜 刘中勇
[摘要]目的 構建糖尿病心肌病(DCM)大鼠模型,探讨强心合剂对DCM大鼠心肌组织胶原蛋白表达的影响。方法 以高糖高脂饲料对大鼠进行喂养,辅助注射链脲佐菌素(STZ)予以造模,随机将SD大鼠划分成6个组:空白组、强心合剂高、中、低剂量组、DCM模型组以及卡托普利组,每组各30只。通过葡萄糖氧化酶法对空腹血糖进行测定;以放免法来检测胰岛素;HE染色测定大鼠心肌病变情况;运用免疫组化法对大鼠体内的心肌组织基质金属蛋白酶-9(MMP-9)、Ⅲ型胶原蛋白(Collagen Ⅲ)以及Ⅰ型胶原蛋白(Collagen Ⅰ)的表达进行测定。结果 强心合剂高、中、低剂量组、卡托普利组的空腹血糖水平均低于DCM模型组,胰岛素水平均高于DCM模型组,差异有统计学意义(P<0.05);强心合剂高、中、低剂量组、卡托普利组大鼠的MMP-9、Collagen Ⅲ、Collagen Ⅰ IOD值均低于DCM模型组,差异有统计学意义(P<0.05);强心合剂中、低剂量组和卡托普利组大鼠的MMP-9、Collagen Ⅲ、Collagen Ⅰ IOD值均高于强心合剂高剂量组,差异有统计学意义(P<0.05)。结论 强心合剂有助于缓解大鼠心肌损伤、降低血糖、升高胰岛素,下调大鼠心肌组织MMP-9、Collagen Ⅲ以及Collagen Ⅰ胶原蛋白的表达,为DCM大鼠心肌提供保护,且高剂量的作用更加明显。
[关键词]糖尿病心肌病;强心合剂;胶原蛋白;基质金属蛋白酶
[中图分类号] R541.61 [文献标识码] A [文章编号] 1674-4721(2019)10(a)-0007-05
[Abstract] Objective To establish the rat model of diabetic cardiomyopathy and explore the effect of Qiangxin Mixture on collagen expression in myocardial tissue in diabetic cardiomyopathy rats. Methods The rats were fed with high-fat and high-sugar diet and induced by Streptozotocin (STZ) for modeling. The SD rats were randomly divided into blank group, DCM model group, Qiangxin Mixture high, Qiangxin Mixture medium and Qiangxin Mixture low dose group, and Captopril group, with 30 rats in each group. The fasting blood glucose was determine with glucose oxidase method, the insulin was measure by radio-immuno-assay. The histopathological changes of rat myocardium were detected by HE staining, and the myocardial tissue in rats of matrix metalloproteinase-9 (MMP-9), Collagen Ⅲ, Collagen Ⅰ expression were detected with immunohistochemical detection. Results The fasting blood glucose level of Qiangxin Mixture in the high, medium, low dose groups and Captopril group were lower than those of the DCM model group, and the insulin level were higher than those of the DCM model group, the differences were statistically significant (P<0.05). The MMP-9, Collagen Ⅲ, Collagen Ⅰ IOD values of Qiangxin Mixture high, medium, low dose group and Captopril group were lower than those of DCM model group, the differences were statistically significant (P<0.05). The MMP-9, Collagen Ⅲ, Collagen Ⅰ IOD values of Qiangxin Mixture medium, low dose groups and Captopril group were higher than those of Qiangxin Mixture high dose group, the differences were statistically significant (P<0.05). Conclusion Qiangxin Mixture can alleviate rat myocardial damage, reduce blood sugar and increase insulin in rats and inhibit MMP-9, Collagen Ⅰ, Collagen Ⅲ protein expression in rats myocardial tissue. Qiangxin Mixture has protective effect on myocardium of DCM rats, and the effect of high dose is more obvious.
[Key words] Diabetic cardiomyopathy; Qiangxin mixture; Collagen; Matrix metalloproteinase
社会在稳步发展,居民的生活水平有了显著提升,糖尿病的患病率也随之快速增长。截至2045年,世界糖尿病人口数量将达到6.93亿[1],糖尿病将成为对人类健康有极大威胁的流行性疾病[2]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是典型的特异性心肌病,是由糖尿病引起而不伴有其他基础冠心病、高血压等心脏疾病[3]。病理变化为心肌细胞肥大、细胞外基质大量沉积或是间质纤维化[4]。如今,DCM的发病机理尚未明确。本研究拟用温阳活血利水法组方之强心合剂干预DCM大鼠,观察胶原蛋白在大鼠心肌组织中的表达情况,旨在探讨强心合剂对DCM大鼠心肌组织的保护作用,为深入阐明DCM的形成机制和对DCM的防治提供新思路。
1材料与方法
1.1实验动物
健康SPF级SD大鼠,数量180只,源自湖南斯莱克景达实验公司(动物许可证号:SCXK湘2016-002),体重(160±20)g,雌雄各半。适应性饲养7 d后进行分组:空白组30只,给予标准大鼠饲料喂养;其余150只给予高脂高糖高热量饲料(其饲料营养配备比例为猪油10%,蔗糖20%,胆固醇2.5%,胆酸盐1%,常规饲料66.5%)进行喂养。实验过程中,全部大鼠均可自由饮水、进食。
1.2实验药物
强心合剂(组成:制附片、桂枝、红花、桃红、泽兰、五加皮、葶苈子各10 g,炙黄芪、丹参、茯苓、北山楂、白芍各20 g,益母草15 g,生姜3片,大枣6枚),江西省中医院药剂室煎制,药物经水煎、过滤、浓缩至终浓度分别为1.5、3.0、6.0 g/ml的强心合剂低、中、高剂量组各150 ml,装瓶封盖、灭菌后放入-4℃冰箱保存备用。卡托普利(华中药业股份有限公司,批号:20140910,规格:25 mg/片)换算为大鼠等效剂量,用纯净水溶解,现用现溶。
1.3試剂及仪器
兔抗鼠基质金属蛋白酶-9(MMP-9)、Ⅲ型胶原蛋白(Collagen Ⅲ)以及Ⅰ型胶原蛋白(Collagen Ⅰ)多克隆抗体(一抗,美国Abcam公司,ab38898、ab34710、ab7778);DAB显色和HE染色试剂盒(上海博谷生物科技);病理切片机(德国RM公司,型号:LEICA RM2135);组织包埋机(SAKURA,型号:5235,日本);光学显微镜(Olympus-BH2日本,购自Olympus公司)。
1.4实验分组及处理
大鼠高糖高脂饲料喂养8周,禁食12 h,实验组大鼠经腹腔注射链尿佐菌素(Streptozotocin,STZ)35 mg/kg,(STZ融合到灭菌0.1 mmol/L pH 4.2的柠檬酸缓冲液,其浓度为2%)。空白组大鼠注射给予剂量同等的柠檬酸缓冲液。注射STZ 72 h后,测定每只大鼠的血糖浓度。若血糖浓度≥11.1 mmol/L,提示糖尿病大鼠模型复制成功,将DCM模型复制成功的大鼠采用随机数字表法分为DCM模型组、温阳活血利水法组方强心合剂高剂量组、强心合剂中剂量组、强心合剂低剂量组及卡托普利组,每组各30只。
空白组、DCM模型组大鼠灌服剂量相同的蒸馏水。强心合剂高、中、低剂量组灌服剂量分别为3、2、1 g/(kg·d)。卡托普利组大鼠给予卡托普利片,4 mg/(kg·d)。连续灌服12周。
实验过程中,空白组、DCM模型组、强心合剂高、中、低剂量组以及卡托普利组大鼠死亡的数量分别为0、6、4、5、5、5只。
1.5观察指标及检测方法
1.5.1血糖及胰岛素的测定 实验结束,大鼠禁食12 h,眼眶取血,EDTA抗凝,分离血清,通过葡萄糖氧化酶法来对空腹血糖进行测定,运用放免法检测血清胰岛素水平。
1.5.2 HE染色光镜检测心肌组织的结构变化 收集各组大鼠的左心室心肌组织,将其置入10%中性甲醛液中进行浸泡固定、脱水,然后用石蜡进行包埋,切成4 μm切片,行HE染色,显微镜下观察大鼠心肌组织的结构改变。
1.5.3心肌组织MMP-9、Collagen Ⅰ、Collagen Ⅲ型胶原蛋白表达水平的检测 将心肌组织4 μm石蜡切片脱蜡至水,蒸馏水冲洗并进行抗原修复,PBS洗涤后加入山羊血清封闭,MMP-9、Collagen Ⅰ和Collagen Ⅲ型胶原蛋白的表达均选择免疫组织化学染色法进行测定。高倍镜下观察并计算其平均IOD值。
1.6统计学方法
采用SPSS 16.0统计学软件对数据进行分析,计量资料以均数±标准差(x±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,以P<0.05为差异有统计学意义。
2结果
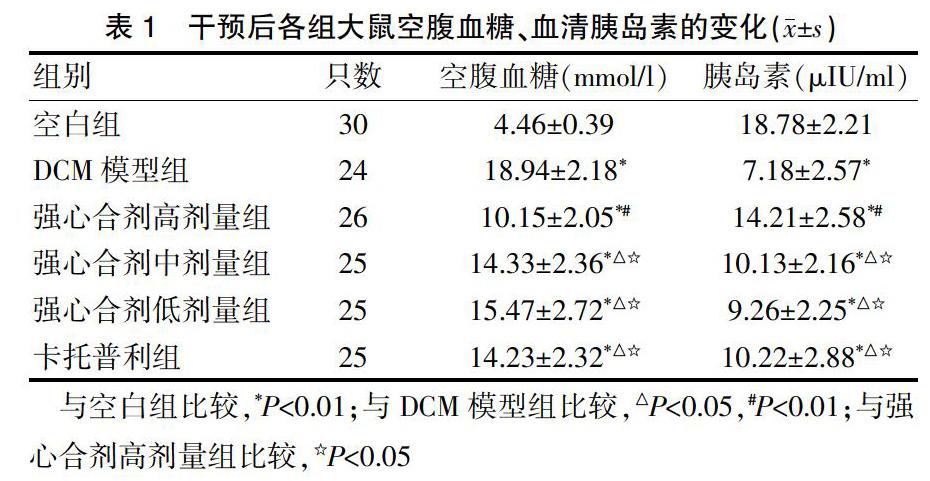
2.1强心合剂干预后各组大鼠空腹血糖、血清胰岛素的变化
强心合剂干预后,实验组各组大鼠的空腹血糖水平均高于空白组,胰岛素水平均低于空白组,差异有统计学意义(P<0.01);强心合剂高、中、低剂量组、卡托普利组大鼠的空腹血糖水平均低于DCM模型组,胰岛素水平均高于DCM模型组,差异有统计学意义(P<0.05);强心合剂中、低剂量组和卡托普利组大鼠的空腹血糖均高于强心合剂高剂量组,胰岛素水平低于强心合剂高剂量组,差异有统计学意义(P<0.05);强心合剂中、低剂量组和卡托普利组的空腹血糖、胰岛素水平比较,差异无统计学意义(P>0.05)(表1)。
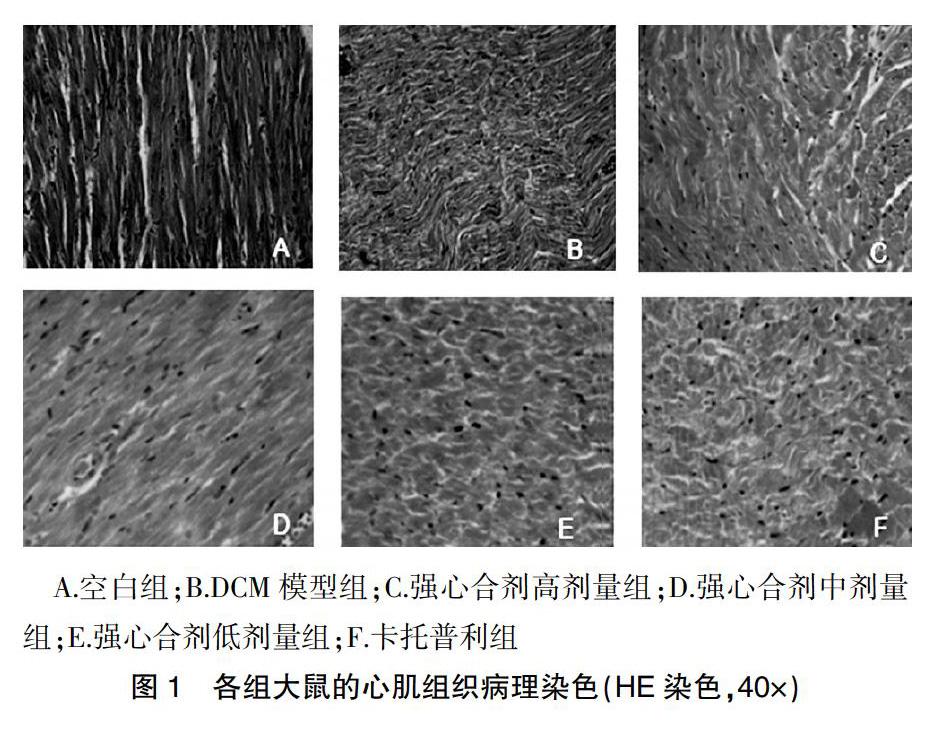
2.2强心合剂干预后各组大鼠心肌细胞形态学的变化
HE染色结果显示:空白组大鼠体内的心肌结构未见异常,心肌细胞胞浆着色相对均匀,其胞核处在细胞中央,形圆或椭圆,大小一致,肌纤维均衡地排列;DCM模型组有少数心肌纤维断裂,不规则;强心合剂高剂量组、中剂量组大鼠的心肌结构有显著好转,肌纤维排列较紧密整齐;卡托普利组与强心合剂低剂量组大鼠心肌纤维排列不规整,部分肌纤维断裂(图1)。
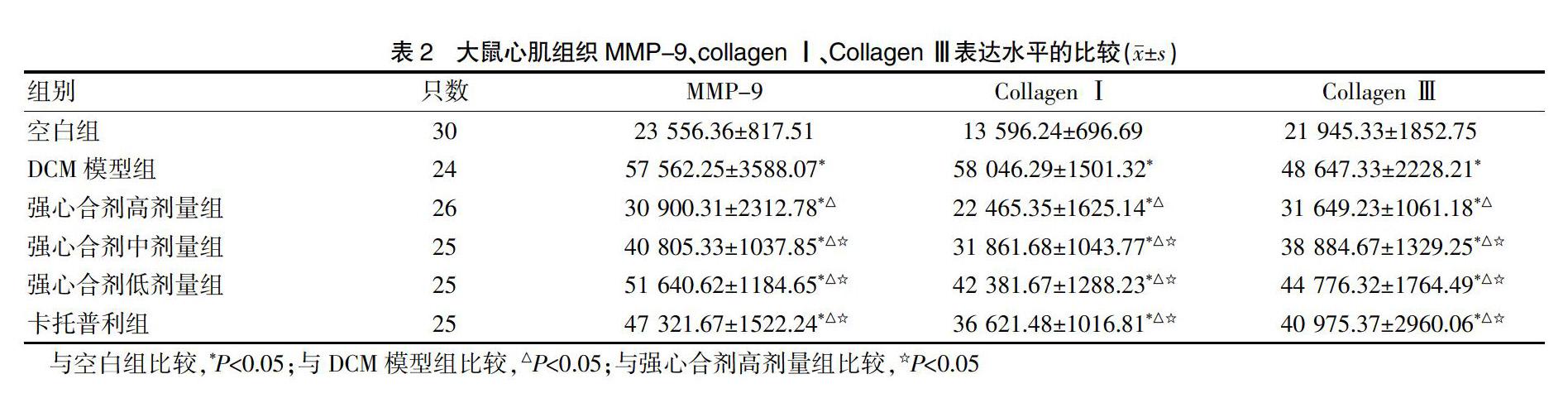
2.3各组大鼠心肌组织MMP-9、Collagen Ⅰ、Collagen Ⅲ表达水平的比较
各组大鼠心肌组织MMP-9、Collagen Ⅰ以及Collagen Ⅲ均有不同强度地表达,与空白组比较,各组大鼠MMP-9、Collagen Ⅰ、Collagen Ⅲ的 IOD值均高于空白组,差异有统计学意义(P<0.05);强心合剂高、中、低剂量组、卡托普利组大鼠MMP-9、Collagen Ⅰ、Collagen Ⅲ 的IOD值均低于DCM模型组,差异有统计学意义(P<0.05);强心合剂中、低剂量组和卡托普利组大鼠的MMP-9、Collagen Ⅰ、Collagen Ⅲ的 IOD值均高于强心合剂高剂量组,差异有统计学意义(P<0.05);强心合剂中、低剂量组与卡托普利组大鼠MMP-9、Collagen Ⅰ、Collagen Ⅲ的 IOD值比较,差异无统计学意义(P>0.05)(表2、图2)。
3讨论
中医古籍上虽无DCM的名称记载,但可纳入“消渴病”并发“心悸”或是“胸痛”等诸病范畴。笔者恩师刘中勇教授认为DCM的病机实质是心痛阳虚水停,阴乘阳位,二者相互搏结,气血运行不畅,瘀血阻滞而成,治疗上,强调温阳活血利水法,并且以此法立方-强心合剂,在临床上治疗心肌病及心力衰竭患者中取得了满意的效果[5-6]。全方振阳以附子为主,补气血以炙黄芪为主,二者联用视作君药;桂枝性温,能够助阳化气;桃仁、丹参以及红花三药合用,能够达到活血祛瘀之目的,加速生血;泽兰和益母草均有活血、利水之双重功效;茯苓、葶苈子及五加皮能够达到利水去湿之效;山楂能够祛瘀消食,调补胃气;佐以白芍、桂枝及制附子等药热毒之效;大枣、生姜能够对脾胃进行调和。诸药配伍,内合五苓散、真武汤、葶苈大枣泻肺汤等方之意,可达到益气升阳、活血利水之功。
近年来,研究证实,DCM是一种主要表现为心律失常和心功能不全的特异性心脏病[7]。DCM的发病机制复雜,与炎症、氧化应激、葡萄糖代谢障碍、心肌间质纤维化等因素密切相关[8]。在心脏发育过程中,成纤维细胞通过产生胶原蛋白分布到组织间隙中从而为心肌细胞提供支撑结构和维持心肌正常的收缩和舒张功能[9]。心脏组织内部的外基质成分中,80%以上都是Collagen Ⅰ[10],表达上升可加大心肌僵硬度,而Collagen Ⅲ的表达则决定心肌的顺应性[11]。在病理状态下,心脏成纤维细胞分泌过多胶原,分布在心肌组织间隙当中,诱发心肌纤维化[12]。本研究构建DCM大鼠动物模型,采用高糖高脂饲料联合注射链脲佐菌素方法[13],旨在先诱发胰岛素抵抗再破坏胰腺β细胞的部分功能,该方法处理的大鼠心肌组织出现了Collagen Ⅰ、Collagen Ⅲ的表达增多,与相关研究一致[14-15],反应心肌组织间隙大量胶原沉积是引起DCM的重要因素。强心合剂可减少DCM大鼠心肌组织中Collagen Ⅰ和Collagen Ⅲ的蛋白表达,提示强心合剂能够帮助糖尿病大鼠减轻心肌纤维化。
正常情况下,心肌间质胶原处于持续不断更新的动态平衡状态。胶原合成和降解同时进行,使细胞外基质成分保持稳定。在细胞外基质重构参与的DCM发病研究中发现,DCM患者血清中MMP-2与MMP-9蛋白的表达水平明显升高,而基质金属蛋白酶抑制因子-1(TIMP-1)和TIMP-2蛋白的表达明显降低,提示细胞外基质的成功降解与重构均可介入DCM的病发过程[16]。基质金属蛋白酶(MMPs)的活性变化,在心肌间质纤维化中担任极其重要的角色[17]。心肌MMPs作为基质降解必备的调节因子,其活性增强见于DCM中[18]。MMP-9是心肌组织Collagen Ⅰ、Collagen Ⅲ胶原完全降解的限速酶[19],对Collagen Ⅰ及Collagen Ⅲ胶原实际的降解速度起决定性的作用[20-21]。相关报道显示,DCM大鼠的心肌胶原纤维显著性增多,MMP-9和TIMP-1的表达上升,两者组合而来的MMP-9/TIMP-1复合物能够减少和抑制MMP-9降解胶原[22]。
本研究中,各组实验大鼠的心肌MMP-9表达情况提示MMP-9参与了DCM的发生发展过程,DCM组大鼠心肌组织中表达增加的MMP-9降低了Collagen Ⅰ、Collagen Ⅲ胶原降解速度,组织间隙中胶原表达增多,加快了心肌纤维化进程。强心合剂能够明显下调大鼠心肌组织中Collagen Ⅰ、Collagen Ⅲ胶原和MMP-9的表达,缓解细胞纤维化程度,从而提示强心合剂对DCM大鼠的心肌结构及功能,具有保护作用,且高剂量的作用更加明显,为中药温阳活血利水法防治DCM提供了客观依据。
[参考文献]
[1]Cho NH,Shaw JE,Karuranga S,et al.IDF diabetes atlas:Global esti-mates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Res Clin Pract,2018,138:271-281.
[2]Bauters C,Lamblin N,Mc Fadden EP,et al.Influence of diabetes mellitus on heart failure risk and outcom[J].Cardiovasc Diabetol,2003,2(1):1.
[3]Schilling JD,Mann DL.Diabetic cardiomyopathy:bench to be dside[J].Heart failure clinics,2012,8(4):619-631
[4]徐娜,白淑芝.糖尿病心肌病发病机制的研究进展[J].医学综述,2019,25(3):520-524.
[5]李林,方家,刘中勇,等.温阳活血利水法对充血性心力衰竭患者甲状腺激素的影响[J].实用中西医结合杂志,2012, 12(3):3-5.
[6]李林,方家,刘中勇,等.温阳活血利水法治疗充血性心力衰竭30例[J].江西中医药,2012,43(2):14-16.
[7]金智生,王东旭,和彩玲,等.红芪多糖对db/db小鼠糖尿病心肌病心肌组织TGF-β与Ⅰ型胶原1蛋白表达的影响[J].中药药理与临床,2017,33(2):74-77.
[8]Zhao XY,Hu SJ,Li J,et al.Decreased cardiac sarcoplasmic reticulum Ca2+-ATPase activity contributes to cardiac dysfunction instreptozotocin-induced diabetic rats[J].J Physiol Biochem,2006,62(1):1-8.
[9]Kakkar R,Lee RT. Intramyocardial fibroblast myocyte communication[J].Circ Res,2010,106(1):47-57.
[10]Vadla GP,Vellaichamy E.Anti-fibrotic cardio protective efficacy of aminoguanidine against streptozotocin induced cardiac fibrosis and high glucose induced collagen up regulation in cardiacfibroblasts[J].Chem Biol Interact,2012,197(2-3):119-128.
[11]武利军.心肌纖维化Ⅰ、Ⅲ型胶原病理形态及相关血清标志物改变的研究[D].重庆:第三军医大学,2002.
[12]Lijnen P,Petrov V.Induction of cardiac fibrosis by aldosterone[J].J Mol Cell Cardiol,2000,32(6):865-879.
[13]Zhang T,Hu Q,Shi L,et al.Equol attenuates atherosclerosis in apolipoprotein E-Deficient mice by inhibiting endoplasmic reticulum stress via activation of Nrf2 inendothelial cells[J].PLoS One,2016,11(12):e167020.
[14]高俊杰,潘晓黎,吴伟,等.转化生长因子β1和胶原蛋白与糖尿病心肌纤维化的实验研究[J].中国老年学杂志,2006,26(4):505-507.
[15]Zheng WC,Li D,Gao X,et al.Carvedilol alleviates diabetic cardiomyopathy in diabetic rats[J].Exp Ther Med,2019,17(1):479-487
[16]苏胜.细胞外基质重构参与的糖尿病心肌病发病研究.海南医学院学报,2015,21(12):1630-1632.
[17]Kim HE,Dalal SS,Young E,et al.Disruption of the myocardial extracellular matrix leads to cardiac dysfunction[J].J Clin Invest,2010,16(1):857-866.
[18]Tyagi SC,Rodriguez W,Patel AM,et al.Hyperhomocysteinemic diabetic cardiomyopathy:oxidative stress,remodeling,andendothelial-myocyte uncoupling[J].J Cardiovasc Pharmacol Ther,2005,10(1):1-10.
[19]谷玉红,李景,王军,等.MMPs和TIMPs与糖尿病心肌病心室重构的关系及糖心宁的干预作用[J].世界中医药,2017,12(1):25-29.
[20]张建,华绮.代谢综合征[M].北京:人民卫生出版社,2003:23-28,92-98.
[21]Peterson JT,Li H,Bryant JW.Evolution of matrix metalloprotease and tissue inhibitor expression during heart failure progression in theinfracted rat[J].Cardiovase Res,2000, 46(2):307-315.
[22]Vanlinthout,Seeland U,Riad A,et al.Reduced MMP-2 activity contributes to cardiac fibrosis in experimental diabetic cardiomyopathy[J].Basic Res Cardiol,2008,103(4):319-327.
(收稿日期:2019-05-10 本文编辑:闫 佩)

