干旱胁迫下紫花苜蓿幼苗非结构性碳水化合物代谢对NO的响应
马文静,魏小红,宿梅飞,骆巧娟,赵 颖
甘肃农业大学生命科学技术学院, 兰州 730070
紫花苜蓿(Medicagosativa)是一种重要的牧草品种,营养品质高,产量高[1]。全世界的苜蓿种植面积约3.22×107hm2,我国苜蓿种植面积约3.77×106hm2,居各类人工草地之首,而紫花苜蓿是全世界栽培利用最为广泛的牧草[2]。紫花苜蓿发达的根系可有效防止水土流失[3];此外,作为一种豆科植物,紫花苜蓿通过根系与根瘤菌建立共生关系,能够将氮固定在根瘤中的硝酸盐上,使其成为可持续农业的理想作物[4]。但是长期以来,干旱一直是限制紫花苜蓿产业发展的重要因素,因干旱胁迫导致紫花苜蓿产量和质量下降的同时,限制了畜牧业规模化和产业化发展。尤其是苗期较敏感,对水分的需求量较大,干旱胁迫会严重影响紫花苜蓿幼苗的生长发育。因此,深入紫花苜蓿幼苗的抗旱性研究,是提高西北干旱半干旱地区紫花苜蓿人工草地产量、节约灌溉的根本途径之一,对紫花苜蓿产业的可持续发展具有重要意义。
非结构性碳水化合物(non-structure carbohydrate, NSC)是植物光合作用的产物,也是呼吸作用的底物,主要由淀粉、果糖、葡萄糖和蔗糖等水溶性糖组成[5]。其含量的大小是植物体内表征碳收支状况的能源指标,也反映了可供植物存活和生长的物质水平[6-7]。非碳水化合物是植物生长发育过程中的重要能量提供者,同时在植物抗逆过程中发挥着重要的调节作用,其储存和转移对植物响应环境胁迫过程起关键作用[8-9]。研究表明植物可以通过调控不同器官的碳分配来应对水分条件的变化,决定其存活与生长[10]。王凯等对干旱致死过程中沙地樟子松(Pinussylvestrisvar.mongolica)幼苗非结构性碳水化合物的变化的研究有力的证明该观点[11]。雷虹等在小叶锦鸡儿(Caraganamicrophylla)幼苗非结构性碳水化合物积累及分配对干旱胁迫的响应的研究中进一步证明非碳水化合物的积累量也是植物应对干旱胁迫的重要因素[12]。研究发现,白羊草(Bothriochloaischaemum(L.) Keng.)可以提高其淀粉和可溶性糖的含量来应对不同程度的干旱胁迫[13]。郭瑞盼等发现溶性总糖、果糖、淀粉和果聚糖的水解对提高小麦(TriticumaestivumL.)抗旱性有重要作用[14]。总之,非结构性碳水化合物代谢在植物抗旱中的作用不容忽视,研究其含量及分配的变化对研究植物的抗旱机制具有重要的意义。目前逆境下紫花苜蓿的研究主要集中在蛋白质方面,孰不知糖是蛋白质合成的碳源,其分解得到的能量也被用于蛋白质的合成,紫花苜蓿非结构性碳水化合物的合成与分解对蛋白质的代谢至关重要。
NO(nitric oxide, NO)是一种广泛存在于生物体内,并可以在细胞内和细胞间传递信息的信使分子[15]。植物体内NO的合成主要依赖于一氧化氮合酶(NOS)和硝酸还原酶(NR)途径[16]。NO参与诱导植物抗逆,如植物的抗盐、抗热、抗寒、抗病和应对重金属胁迫等。研究发现NO在植物的抗旱性中发挥着不可替代的作用,NO可以调节植物的气孔关闭、离子吸收速率、渗透调节物质的含量、抗氧化酶活性等来增强其抗旱性[17-19]。因此,NO通过影响植物在逆境条件下的耐受阈值来增强植物的抗逆性。carboxy-PTIO(cPTIO),是一种常用的一氧化氮清除剂,可以用于抑制一氧化氮信号通路。carboxy-PTIO与NO反应生成carboxy-PTIO衍生物,同时产生亚硝酸盐或硝酸盐,从而起到清除NO的作用。NO抑制剂cPTIO则能够显著降低植物叶片的NO含量,已经被广泛应用于揭示NO在植物抗逆中的功能[20-21]。
尽管NO在植物抗旱方面的研究已经非常广泛,但是NO对紫花苜蓿非结构碳水化合物代谢的调控尚不清楚。因此本试验以紫花苜蓿幼苗为材料,通过分析干旱胁迫下NO对紫花苜蓿叶片、根系中非结构碳水化合物含量及其相关代谢酶活性的动态变化,进一步明确NO提高紫花苜蓿抗旱性的作用机制,为紫花苜蓿在西北干旱半干旱地区的推广种植提供理论指导和技术支撑。
1 材料与方法
1.1 植物材料及处理
试验于2017年9月—2018年6月在生命科学技术学院生理实验室进行,供试紫花苜蓿品种‘三得利’(Medicagosativa‘Sandili’)购于甘肃农业科学院种子公司。
选取颗粒饱满、无病虫害的紫花苜蓿种子进行消毒处理,然后用蒸馏水清洗,浸种催芽后选取露白一致的种子,均匀点播于装有高压灭菌营养土的的花盆(φ=12 cm)中,每盆70粒,再覆盖上0.5 cm厚的蛭石,轻轻压实,蛭石表面喷洒20 mL蒸馏水,在(25±1)℃下, 12 h光照/12 h黑暗,光强6000 lx进行培养,每隔2天使用称重法补充水分,培养45 d后每盆保留30株生长一致且健康的紫花苜蓿植株,此时的植株处于营养生长阶段。分别量取5 mL蒸馏水、0.1 mmol/L SNP(NO释放剂)、200 μmol/L cPTIO处理液喷施于不同组合的叶面(SNP及cPTIO处理液中加入附着剂tween20),每天进行喷施。同时在干旱处理组土壤中浇50 mL 10% PEG-6000进行渗透胁迫处理,每2天浇一次,连续处理8 d,正常浇水处理组加等量蒸馏水。处理设置:蒸馏水(CK);0.1 mmol/L SNP;10%PEG; 10%PEG+ 0.1 mmol/L SNP;200 μmol/L cPTIO;10%PEG+200 μmol/L cPTIO,每组处理重复3次。分别于1、3、5、7 d采集叶片和根系,分为两份,一份烘干保存用于非结构性碳水化合物的测定,另一份立即放置于液氮中快速冷冻,并在-20℃保存用于非结构性碳水化合物相关酶活性的测定。
1.2 测试项目及方法
淀粉含量采用蒽酮比色法[22]测定。蔗糖和果糖含量采用间苯二酚比色法[23-24]测定。葡萄糖含量参考姜慧新等的方法并略作修改[25-26]。蔗糖合成酶(Sucrose synthetase,SS)和蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)的提取与测定参照田红梅和董彦红的方法[27-28],并略加修改。酸性转化酶(Acid invertase,AI)、中性转化酶(Neatral invertase,NI)的测定采用3,5-二硝基水杨酸法,通过测定还原糖的生成量表示其活性。
1.3 数据分析
试验数据采用Microsoft Excel 2013进行处理及作图,用SPSS 21.0软件Duncan法进行统计学分析,图中字母不同表示差异有统计学意义。
2 结果与分析
2.1 NO对干旱胁迫下对紫花苜蓿幼苗非结构性碳水化合物含量的影响
2.1.1NO对干旱胁迫下对紫花苜蓿叶片、根系中淀粉含量的影响
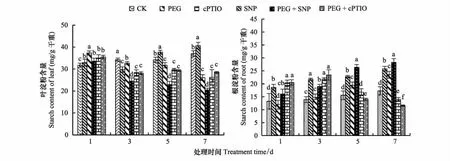
图1 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系淀粉含量变化的影响Fig.1 Effects of nitric oxide on starch content of alfalfa seedings leaf and root under drought stress 相同处理天数不同字母表示差异显著(P<0.05);CK: (对照,control check) SNP :(硝普钠,Sodium nitroprusside);PEG:(聚乙二醇,Polyethylene glycol)PEG+ SNP:(聚乙二醇+硝普钠,Polyethylene glycol+ Sodium nitroprusside);cPTIO:(NO清除剂,carboxy-PTIO)PEG+ cPTIO:(聚乙二醇+NO清除剂,Polyethylene glycol+ carboxy-PTIO)
如图1所示,随干旱胁迫时间的延长,紫花苜蓿叶片中淀粉含量呈逐渐下降的趋势。第3天,与CK相比,PEG、cPTIO处理淀粉含量分别降低6.34%、13.27%,PEG+SNP、PEG+cPTIO处理比PEG分别降低了24.91、13.97%。第7天,与CK相比,PEG、 PEG+SNP处理淀粉含量降低了29.45%、44.76%。在整个处理过程中,SNP处理下紫花苜蓿叶片中淀粉含量升高,cPTIO、PEG+cPTIO处理后期没有显著变化。
由图1可知,随干旱胁迫时间的延长,紫花苜蓿根中淀粉含量逐渐增加。在第7天时各处理差异显著(P<0.05),PEG、SNP和PEG+SNP处理下根中淀粉含量达到最大值, SNP、PEG处理淀粉含量分别比CK提高了49.25%、 36.51%, PEG+SNP处理比PEG提高了20.01%。不论水分条件如何,cPTIO处理下淀粉含量先升高后下降,在第3天达到最大值,cPTIO、PEG+cPTIO处理淀粉含量分别比CK提高了56.4%、68.63%,在第7天,分别降低了19.27%、33.10%。
2.1.2NO对干旱胁迫下对紫花苜蓿叶片、根系中蔗糖含量的影响
如图2所示,随着干旱胁迫时间的延长,紫花苜蓿叶片蔗糖含量呈现先增高后降低的变化趋势。第3天,PEG、cPTIO处理分别比CK提高了73.79%、78.50%,PEG+cPTIO处理比PEG提高了17.58%。第5天,SNP、PEG和PEG+SNP处理达到最大值, SNP、PEG分别比CK提高了22.61%、69.05%,PEG+SNP处理比PEG提高了21.43%。第7天, PEG、PEG+SNP和PEG+cPTIO处理下蔗糖含量分别比对照提高了42.04%、90.25%和27.84%,而cPTIO处理则比CK显著下降了12.35%。
如图2所示,随着干旱胁迫时间的延长,紫花苜蓿根系中蔗糖含量呈先升高后下降的变化趋势,第5天达到最大值。第5天,SNP、PEG处理蔗糖含量分别比CK显著提高了66.98%、39.90%(P<0.05),PEG+SNP处理比PEG处理提高了30.42%。不论水分条件如何,cPTIO处理下蔗糖含量呈先升高后下降的变化趋势,在第3天达到最大值,cPTIO、PEG+cPTIO处理蔗糖含量分别比CK提高了51.96%、23.32%,在第7天,显著降低了37.70%、43.79%。

图2 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系蔗糖含量变化的影响Fig.2 Effects of nitric oxide on sucrose content of alfalfa seeding leaf and root under drought stress
2.1.3NO对干旱胁迫下对紫花苜蓿叶片、根系中果糖含量的影响
由图3可知,随干旱胁迫时间的延长,紫花苜蓿叶片中果糖含量呈现先升高后下降的变化趋势,并在第5天达到最大值,PEG+SNP处理比PEG提高了10.47%。在第7天,PEG+cPTIO处理与PEG相比显著降低了43.92%(P<0.05)。在正常浇水下,喷施SNP使叶片中果糖含量逐渐上升,并在第7天达最大值;在第7天时,cPTIO处理使果糖含量比CK降低了44.29%。
由图3可知,干旱胁迫使紫花苜蓿根系中果糖含量呈现先升高后下降的趋势,在第3天达最大值。第5天,PEG+SNP比单独胁迫处理提高了55.83%。第7天,PEG+cPTIO处理果糖含量比PEG下降了30.62%。在正常浇水下,第7天时,与CK相比,SNP处理下果糖含量提高了57.85%,cPTIO处理下降了27.06%。

图3 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系果糖含量变化的影响Fig.3 Effects of nitric oxide on fructose content of alfalfa seeding leaf and root under drought stress
2.1.4NO对干旱胁迫下对紫花苜蓿叶片、根系中葡萄糖含量的影响
如图4所示,随干旱胁迫时间的延长,紫花苜蓿叶片中葡萄糖含量呈现先升高后下降的变化趋势,并在第5天达到最大值。第1天,cPTIO处理比CK降低了31.33%。第5天时,SNP、PEG、PEG+SNP和PEG+cPTIO处理下葡萄糖的含量分别比CK显著提高了34.56%、87.56%、91.7%和78.8%(P<0.05)。第7天,SNP处理葡萄糖含量比CK提高了35.83%,PEG+SNP处理比PEG 提高了46.15%,PEG+cPTIO处理比PEG降低了11.42%,cPTIO处理比CK下降了35.83%。
如图4所示,随干旱胁迫时间的延长,紫花苜蓿根系中葡萄糖含量的变化趋势与叶片中相同,第3天达到最大值,SNP、PEG、PEG+SNP和PEG+cPTIO处理葡萄糖的含量分别比CK提高了52.30%、39.63%、58.29%和15.44%,cPTIO处理下没有显著变化(P<0.05)。第7天,干旱胁迫下的各处理葡萄糖含量显著下降(P<0.05),在处理前期过程中,cPTIO处理下的葡萄糖含量变化不明显,第5、7天时,分别比CK下降了16.70%、34.34%。

图4 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系葡萄糖含量变化的影响Fig.4 Effects of nitric oxide on glucose content of alfalfa seeding leaf and root under drought stress
2.2 NO对干旱胁迫下紫花苜蓿幼苗SS和SPS活性的影响
2.2.1NO对干旱胁迫下紫花苜蓿叶片、根系中SS活性的影响
由图5可知,随处理时间的延长,对照中紫花苜蓿叶片中SS活性呈现缓慢升高的变化趋势,而干旱胁迫会使SS活性先升高后降低,第3天达到最大值,SNP、PEG处理SS活性分别比CK提高了43.45%、26.62%,PEG+SNP处理比PEG提高了15.34%。cPTIO处理在前期作用效果不显著,在第7天,与CK相比SS活性降低了25.81%,PEG+cPTIO处理比 PEG显著降低了32.84%。
由图5可知,根系对照中SS活性随时间延长变化不明显,且其活性低于叶片。干旱胁迫使紫花苜蓿根系中SS活性呈先升高后下降,在第3天达到最大值。在第5、7天时,与PEG相比,PEG+SNP处理SS活性分别提高了85.41%、86.07%。在整个处理过程中,PEG+cPTIO的作用效果不显著(P<0.05),cPTIO处理对根系中SS活性的作用效果比叶中显著,第7天,cPTIO处理SS活性比CK下降了39.45%。

图5 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系SS活性变化的影响Fig.5 Effects of nitric oxide on SS activity of alfalfa seeding leaf and root under drought stress
2.2.2NO对干旱胁迫下紫花苜叶片、根系中SPS活性的影响
如图7所示,随干旱胁迫时间的延长,紫花苜蓿叶片中SPS活性呈现逐渐降低的趋势。第3天时,与CK相比, PEG 、cPTIO处理SPS活性降低了18.46%、16.97%,PEG+SNP、PEG+cPTIO处理比PEG降低了6.82%、11.27%。第5天,SNP处理SPS活性比CK提高了17.54%。第7天时,cPTIO处理SPS活性比CK降低了41.41%,PEG+SNP、PEG+cPTIO处理比PEG降低了15.32%、39.53%。
与叶相比,根系中SPS活性低于叶片。随干旱胁迫时间的延长,根系中SPS活性呈先升高后下降的趋势。第1天时,除PEG+SNP处理SS活性有显著变化,其他处理均不显著(P<0.05)。第3天,与CK相比,SNP、PEG+SNP处理SS活性分别提高了29.94%、51.34%。第5天,PEG+SNP处理比PEG处理提高了38.06%。不论水分条件如何,cPTIO均能降低根系中SPS活性,第7天,与CK相比,cPTIO处理SS活性降低了40.96%,PEG+cPTIO处理较PEG处理降低了52.82%。

图6 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系SPS活性变化的影响Fig.6 Effects of nitric oxide on SPS activity of alfalfa seeding leaf and root under drought stress
2.3 NO对干旱胁迫下紫花苜蓿幼苗转化酶活性的影响
2.3.1NO对干旱胁迫下紫花苜叶片、根系中AI活性的影响
如图7所示,随干旱胁迫时间的延长,紫花苜蓿叶片中AI活性呈逐渐下降的变化趋势,在第1天,与CK相比,PEG处理AI活性提高了2.16倍。在第3天时,各处理之间差异显著(P<0.05),PEG+SNP处理下AI活性比PEG处理提高了12.61%。不论水分条件如何, cPTIO处理下AI活性逐渐下降,第7天时,cPTIO处理比CK降低了30.62%,PEG+cPTIO处理较PEG处理下降了41.07%。
如图7所示,随干旱胁迫时间的延长,紫花苜蓿根系中AI活性呈逐渐下降的变化趋势。在第1天,与CK相比,PEG处理AI活性提高了1.97倍。PEG+SNP处理下AI活性先升高后下降,在第3天达最大值,比PEG处理提高了28.89%。不论水分条件如何,cPTIO处理下AI活性逐渐下降,第3天时,与PEG处理相比,PEG+cPTIO处理降低了13.31%。在第7天,cPTIO处理AI活性比CK降低了54.51%,PEG+cPTIO与PEG处理相比无显著性差异(P<0.05)。

图7 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系AI活性变化的影响Fig.7 Effects of nitric oxide on acid invertase of alfalfa seeding leaf and root under drought stress
2.3.2NO对干旱胁迫下紫花苜叶片、根系中NI活性的影响
如图8所示,随干旱胁迫时间的延长,紫花苜蓿叶片NI活性呈现逐渐下降的变化趋势。不论水分条件如何,SNP处理在前期作用不显著,在第7天,SNP处理比CK提高了10.52%,PEG+SNP比PEG处理提高了33.05%。不管水分条件如何,cPTIO处理下NI活性呈现先升高后下降,在第3天达到最大值;在第7天,cPTIO、PEG+cPTIO处理NI活性分别比CK降低了28.63%、39.88%。
如图8所示,根系中NI活性要低于叶片,随干旱胁迫时间的延长,紫花苜蓿根系NI活性先升高后下降,在第3天达到最大值,PEG处理NI活性比CK提高了67.74%,PEG+SNP比PEG提高了13.89%,PEG+cPTIO处理NI活性比PEG降低了15.41%。第7天时,与CK相比,cPTIO处理NI活性显著降低了77.74%(P<0.05),PEG+cPTIO处理不显著。
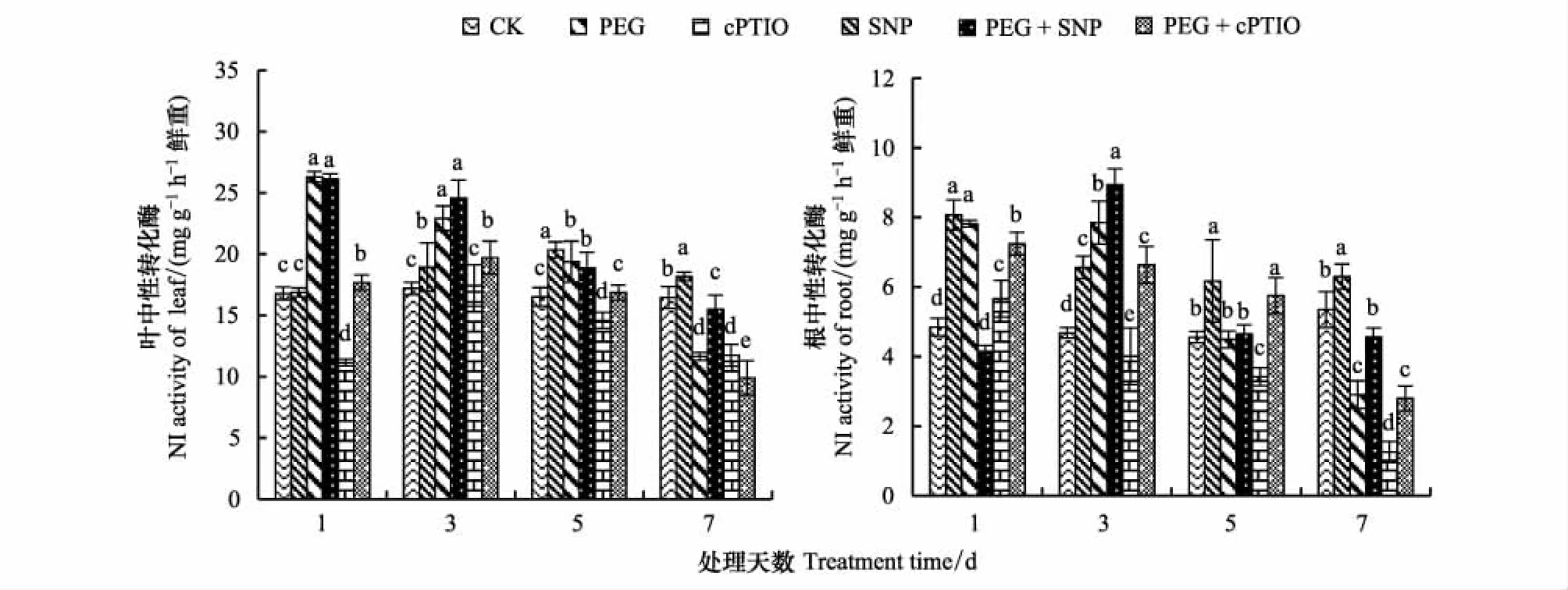
图8 NO对干旱胁迫下紫花苜蓿幼苗叶片、根系NI活性变化的影响Fig.8 Effects of nitric oxide on neutral invertase of alfalfa seeding leaf and root under drought stress
3 讨论
3.1 紫花苜蓿淀粉含量变化与NO和干旱胁迫的关系
NSC在植物体中含量的变化不仅能反映植物的生理活动状况,还能反映植物对环境变化的响应[29]。NSC 在不同器官中的分配格局是植物对环境适应能力的综合体现[30]。在逆境条件下,植物表现为淀粉含量下降,糖含量增加,而外源物质的添加会增强这种特性,从而提高植物的抗逆适应性[31]。研究表明NO可以提高逆境条件下植物中可溶性糖的含量[32-33]。可溶性糖作为一种渗透调节物质,其直接参与植物体应对干旱胁迫,淀粉是植物体中的重要储能物质,两者之间的互相转化程度反映植物对环境变化的响应[34]。本研究发现在干旱胁迫下,紫花苜蓿叶片中淀粉含量降低,干旱胁迫促进了淀粉的水解以调节细胞的渗透势,防止细胞的大量失水。与叶片相反,在根系中淀粉含量呈增加的趋势,一方面干旱胁迫使地上部分中的淀粉运往地下部分储存,以提高紫花苜蓿的抗旱性,这与杨丽芝研究结果相似[35],另一方面可能是因为可溶性糖的大量增加会造成淀粉的积累[36]。与单纯干旱胁迫相比,外源 NO作用下紫花苜蓿叶片中淀粉含量降低,根系中淀粉增加,说明外源NO可以调节淀粉在植物叶片、根系中的分配及其合成分解,使根系利用淀粉合成防御性化合物,对干旱胁迫起缓冲作用,增强紫花苜蓿的抗旱性。不论水分条件如何,NO清除剂cPTIO处理下叶片中淀粉含量逐渐下降,根系中淀粉含量先升高后下降,后期淀粉含量极低,说明cPTIO影响了淀粉的合成与分解及其分配,这将不利于植物形成稳定的渗透势,说明内源NO的含量与淀粉的代谢密不可分。
3.2 紫花苜蓿可溶性糖含量变化与NO和干旱胁迫的关系
蔗糖在植物体内是碳水化合物运输的主要形式[37],干旱胁迫会影响蔗糖库的大小,尽管干旱胁迫下碳素同化总量下降,但可溶性碳水化合物的含量增加,这样可以提高细胞的渗透势[38]。本研究结果表明,干旱胁迫下紫花苜蓿蔗糖含量先升高后下降,且叶片中蔗糖的含量要高于根系,说明干旱胁迫使叶片中的蔗糖合成分解更为活跃,在应对干旱胁迫中发挥了更为主要的作用,之后蔗糖会进一步水解为果糖和葡萄糖,这也正符合了果糖与蔗糖的含量变化趋势,两者在处理后期积累量最大。与蔗糖含量变化相反的是,根系中葡萄糖及果糖含量比叶片中要高,说明干旱胁迫下,叶片中分解得到的果糖和葡糖糖会优先往紫花苜蓿根系中分配,这可能是可溶性糖供应地下部分利用并修复受损组织[39]。外源NO处理不同程度地提高了干旱胁迫下紫花苜蓿幼苗中蔗糖、葡萄糖和果糖的含量,与单纯干旱胁迫下相比,外源NO处理下根系中葡萄糖和果糖含量增加幅度较大。这可能是由于NO能够维持较高水平的光合作用和向下运输碳水化合物的能力。不论水分条件如何,cPTIO处理表现出对紫花苜蓿中可溶性糖代谢的抑制作用,但是在处理过程中,cPTIO处理下紫花苜蓿中可溶性糖含量大多数呈现先升高后下降的趋势,可能的原因是NO的减少在短时间内刺激了一氧化氮合酶(SNPS)和硝酸还原酶(NR)途径产生更多NO,从而使其继续发挥作用,随时间延长代谢恢复正常水平,内源NO减少,抑制可溶性糖的代谢。内源NO在调控可溶性糖的代谢过程中发挥着重要的作用。
3.3 干旱胁迫下紫花苜蓿SS和SPS活性对NO的响应
植物体内蔗糖代谢是一个复杂的过程,是蔗糖代谢相关酶类综合互作用的结果[40]。SS,SPS是蔗糖代谢的重要酶类[41],在高等植物中,SS既能催化蔗糖合成又能催化其分解,是一种可逆酶,但通常认为主要起分解蔗糖作用,SPS则被认为是催化蔗糖合成的主要酶,相关酶活性的变化直接影响蔗糖库的大小[42]。干旱胁迫降低了谷子幼苗SS和SPS的活性,同时外源物质亚精胺则会提高其酶活性,促进蔗糖等碳水化合物的积累[43]。本研究结果表明,正常生长下紫花苜蓿叶片中SS和SPS活性均比根系中要高。干旱胁迫下,叶片中SS活性先升高后下降,SPS活性逐渐降低,这与董彦红和刘文夫的研究相似[28,44]。根系中SS和SPS活性先升高后下降,叶片中SS和SPS的活性仍然比根系中要高,叶片中蔗糖的合成与分解要比根中活跃。外源NO可以不同程度的提高紫花苜蓿叶片中SS活性及根系中SS和SPS活性,抑制叶片中SPS的活性,促进叶片中蔗糖的分解,抑制蔗糖的合成,降低细胞的渗透势,促进细胞吸水从而减轻对植株的伤害;而叶片分解的果糖和蔗糖更多的运往根系,根系中SS和SPS处于高水平的动态平衡中,促进蔗糖的合成与分解,维持正常的细胞渗透势,缓解干旱胁迫对根系造成的损伤。而cPTIO 则会不同程度的钝化SS和SPS的活性,说明内源NO的减少可以通过抑制SS和SPS的活性,进而影响到可溶性糖的代谢,不利于植物在逆境中生存。
3.4 干旱胁迫下紫花苜蓿AI和NI活性对NO的响应
转化酶是蔗糖代谢的关键酶,能不可逆地催化蔗糖分解为葡萄糖和果糖, 根据其最适 pH,将其分为酸性转化酶、中性转化酶和碱性转化酶[45-46],在植物生长发育及应对环境胁迫中起重要作用[47]。转化酶在植物正常生长中的作用远远大于蔗糖合成酶[48],与本研究结果相似,本研究中叶片中转化酶的活性显著高于蔗糖合成酶。研究表明,低温胁迫能提高木薯中的 NI活性并且表现为短期提高[49]。程智慧等研究表明番茄中转化酶在水分胁迫前期活性升高,后期降低,转化酶的表达水平与盐胁迫强度和时间有密切关系[50]。外源物质的使用可以有效调节胁迫下植物转化酶的活性,从而增强植物的抗逆性[51-52]。本试验研究结果表明紫花苜蓿叶片中AI和NI的活性均比根系要高。干旱胁迫下,叶片及根系中AI和NI活性均呈先逐渐下降的变化趋势,且对干旱胁迫十分敏感,在胁迫后期活性迅速下降。干旱胁迫下,叶中转化酶的活性仍然比根中要高,然而根系中果糖和葡萄糖和含量要高于叶片,这更加证明了叶片中分解得到的果糖和葡萄糖会优先向根中分配,减轻根部的损伤。外源NO可以不同程度的提高干旱胁迫下紫花苜蓿中AI和NI的活性,促进蔗糖的分解为更多的果糖和葡萄糖,参与细胞的渗透调节。同时,转化酶也是合成其他有机溶质的碳架和能量来源,可提高植物抗逆性,使植株维持正常代谢水平。而cPTIO则会降低AI和NI的活性,说明内源NO的减少会影响转化酶的正常表达,可能的原因是内源NO在调控转化酶代谢中发挥重要的作用,其含量的减少会严重影响转化酶的正常代谢。在处理后期,PEG+cPTIO处理下根系中转化酶活性与单独胁迫处理差异不显著,可能是随胁迫时间的延长,原生质体和细胞壁脱水引起细胞塌陷,进而造成机械损伤及代谢紊乱。``
4 结论
不同处理下紫花苜蓿叶片和根系NSC浓度及其代谢关键酶活性的动态变化表明,干旱胁迫会对紫花苜蓿NSC浓度及代谢酶活性产生影响,使NSC发生重新的转化与分配,而外源喷施NO可以通过增强干旱胁迫下紫花苜蓿叶片和根系中SS、SPS、AI及NI的活性,促进NSC的转化与分配往有利植物生长的方向进行,降低了渗透势,促进细胞吸水,缓解干旱造成的损伤。而NO清除剂的使用揭示了紫花苜蓿中内源NO可以通过调控NSC浓度及其相关酶的代谢响应干旱胁迫,并表现出抑制作用。此研究可为外源NO在植物抗逆中的应用与内源NO的功能研究提供重要依据。因此建议在干旱地区种植和培育紫花苜蓿的过程中,可以考虑通过外源喷施0.1 mmol/L NO增强紫花苜蓿的适应能力,减轻干旱胁迫对紫花苜蓿产量和质量影响。

