银屑病患者外周血MicroR-423-5p的表达
韩赛楠 刘 远 张雨辰 齐 君 李星辰 徐凌宇
银屑病是一种常见的慢性炎症性皮肤病,其具体的发病机制尚不明确[1],对于银屑病发病原因、机制以及治疗方案的探索一直是研究的热点。而miRNA的发现为银屑病的研究提供了新的思路。miRNA是一类内源性非编码小分子RNA,参与多种生物学反应,其表达失衡涉及到多种肿瘤、炎症等疾病[2-4]。有研究发现miR-423-5p在银屑病患者体内表达减少[5],但具体作用及机制尚不明确。为深入研究miR-423-5p在银屑病中的表达及意义,本研究采用qRT-PCR检测银屑病患者外周血中miR-423-5p表达,分析其与银屑病患者严重程度指数(PASI)评分、白蛋白(ALB)、总蛋白(TP)含量、C反应蛋白(CRP)、红细胞沉降率(ESR)之间的关系,评价其在银屑病中的诊断价值,并研究miR-423-5p及其潜在靶基因STAT3对银屑病外周血单细胞增殖及炎症水平的影响。
1 资料和方法
1.1 一般资料 所有病例均为沧州市中心医院皮肤科寻常型银屑病患者,样本量为60例。病例组剔除条件:①既往有心脑血管疾病、自身免疫性疾病等严重的系统性疾病、怀孕、哺乳期等;②入院前2个月内使用维A酸类药物、甲氨蝶呤、环孢素、糖皮质激素类药物等全身治疗药物和依那西普等生物制剂;③入院前1个月内使用紫外线照射等物理疗法。患者病情评分参照银屑病面积和严重程度指数(psoriasis area and severity index,PASI)标准,包括皮损面积评分和皮损严重程度评分。PASI总分=0.1×头部面积分×头部严重度评分+0.3×躯干面积分×躯干严重度评分+0.2×上肢面积分×上肢严重度评分+0.4×下肢面积分×下肢严重度评分。
选择沧州市中心医院体检中心的健康体检者40名为健康对照组,排除自身免疫疾病、心脑血管疾病、癌症、免疫缺陷病等严重的系统性疾病、怀孕等。对银屑病患者和健康对照的基线资料进行分析,结果见表1。
1.2 标本的采集与处理 所有银屑病患者入院第一天和健康对照在清晨时抽取静脉血,采用Trizol法提取血浆总RNA,行RT反应。按试剂盒(superscript II reverse transcriptase, Invitr-ogen公司)说明,采用Oligo(dT)逆转录合成cDNA。荧光定量PCR反应,检测各样本中的miR-423-5p的相对表达水平。
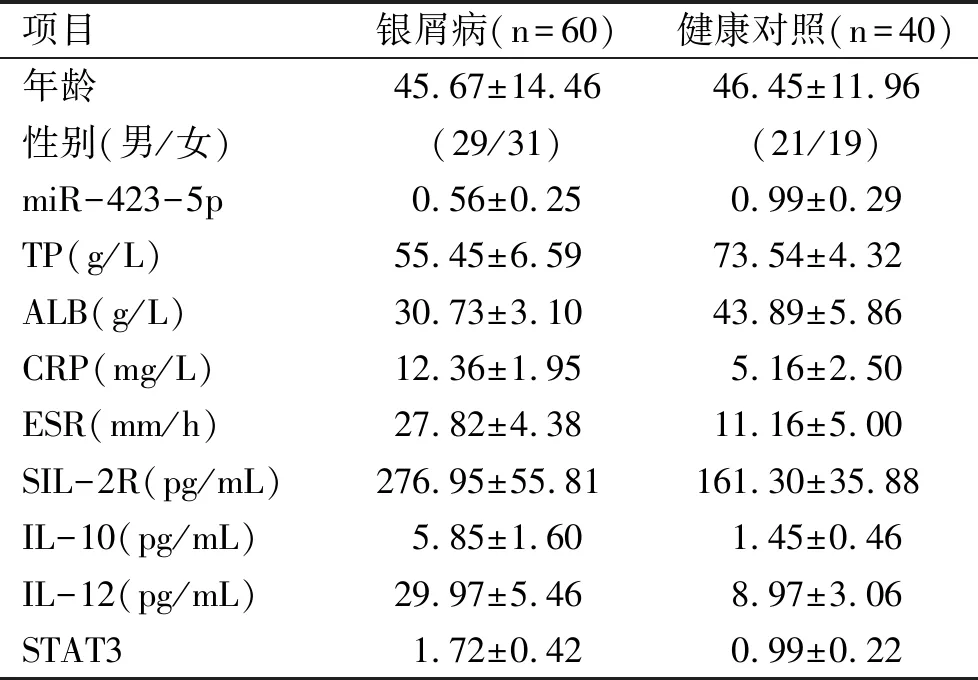
表1 银屑病患者和健康对照基本临床资料
1.3 细胞分离培养 抽取健康对照和银屑病患者外周血10 mL于EDTA抗凝管中,通过Ficoll-Paque密度梯度离心(GE Healthcare Biosciences)从全血样品中分离单个核细胞(PBMC)。细胞均用含10%FBS(Hyclone公司)的RPMI1640培养基(Hyclone公司),在37℃,5% CO2的恒温培养箱(MCO-15AC,日本SANYO)中进行常规的培养。
免疫学及生化指标检测 采用Image 800型全自动免疫分析仪(美国贝克曼公司生产)及其原装试剂,检验CRP,应用Greiner bioone型全自动血沉仪,检验ESR。采用全自动血生化分析仪检测ALB、TP含量。
1.4 血清炎症因子检测 IL-10,IL-12、SIL-2R水平测定参照ELSIA试剂盒(ADI,Texas,USA)说明书进行,用酶标仪(spectraMAX 340, Molecular Devices, Sunnyvale, CA, USA)在450 nm波长处测定各孔的吸光度,根据标准曲线定量。
1.5 MTT法测细胞增殖 取各组PBMC细胞接种于96孔板,每孔5×103个细胞。在37℃、5% CO2培养箱中培养细胞。培养24 h、48 h、72 h和96 h后,取出培养板,加入MTT溶液(5 mg/mL,Sigma-Aldrich),培养4 h。去除MTT溶液后,将150μL DMSO(Sigma-Aldrich)添加到每个孔中。摇动10 min后,使用酶标仪测量570 nm波长下的光密度(OD570)。实验进行了三次。
1.6 细胞转染 STAT siRNA(siRNA1、siRNA2)和阴性对照(si-NC),miR-423-5p mimics和阴性对照(mimics NC),miR-423-5p inhibitor和阴性对照(inhibitor NC)购自GenePharma(中国上海)。细胞转染严格按照说明书操作,使用转染试剂Lipofectamine 3000(L3000015,Thermo Fisher Scientific)进行细胞转染。转染48 h后收集细胞。
1.7 qRT-PCR检测 取待测细胞,使用TRIZOL试剂(Invitrogen公司)提取各样品中的总RNA。PCR扩增仪进行逆转录反应合成cDNA模版,应用ABI7500定量PCR仪进行Real-time quantitative RT-PCR实验,逆转录引物来自TaKaRa公司的逆转录试剂盒,反应条件为95℃预变性3 min,95℃变性15 s,60℃ 退火30 s,72℃延伸20 s,40个循环。采取手动方式将阈值选定在各对数扩增曲线平行上升的最低点,得到各反应管的Ct值(Threshold cycle),数据采用2-ΔΔCt法进行分析,2-ΔΔCt表示实验组与对照组目的基因表达的倍比关系,公式如下:ΔΔCt=[Ct(目的基因)-Ct(内参基因)]实验组-[Ct(目的基因)-Ct(内参基因)]对照组。Ct为反应的实时荧光强度达到设定的阈值时所经过的扩增循环数,此时扩增是呈对数期增长。U6为miR-423-5p的内参,β-actin为STAT3内参,实验重复3次。各基因及其引物的扩增引物序列由上海生工生物工程股份有限公司合成,见表2。

表2 引物序列
1.8 Western blot检测 取各组细胞,用预冷的PBS缓冲液洗涤3次,按照10 μL沉淀加入100 μL蛋白抽提裂解液,剧烈涡旋震荡混匀5 s,将细胞沉淀重悬并使其均匀分散,冰上放置15 min。4℃,12000 rpm,离心10 min,吸取上清分装于0.5 mL离心管中并置于-80℃保存。将裂解的蛋白样品,采用BCA试剂盒(ThermoFisher Scientific)进行蛋白浓度的测定。取适量提取的蛋白样品加入5×Loading buffer,水中煮沸10 min,进行SDS-PAGE蛋白电泳,电泳时先调节电压为60 V,待蛋白进入分离胶(约20 min)后,改用120 V,电泳1~2 h,4℃冷室中进行。电泳结束后,用湿转电转移法将蛋白质转移到PVDF膜上,小心排净气泡,转膜2 h,4℃冷室中进行,取下PVDF膜,5% 脱脂牛奶-TBST封闭,室温摇床振荡2 h。封闭结束后,以洗膜液漂洗PVDF膜,加入兔抗人GAPDH(1∶1000,ab9485,Abcam)、STAT3(1∶2000,4695,CST),4℃过夜摇床振荡孵育,TBST洗3次,每次10 min,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶10000,Sigma 公司),室温振荡孵育1 h,TBST洗3次,每次10 min。进行化学发光显色,曝光、显影、定影,数据分析。内参为GAPDH。
1.9 荧光素酶报告基因实验 通过在线预测软件Target Scan确定STAT3和miR-423-5p结合的靶位点,根据预测结果,分别设计STAT3和miR-423-5p结合位点的突变序列和野生序列。将突变序列和野生序列片段克隆并与Promega载体结合,使用突变序列结合miR-423-5p mimics或miR-499a-5p阴性对照物分别共转染SH-SY5Y细胞,并分别命名为MT+miR-423-5p mimics组,MT+NC组。此外,野生序列结合miR-423-5p mimics或miR-423-5p阴性对照物分别共转染PBMC细胞,并分别设置为WT+miR-423-5p mimics组,WT+NC组。转染48小时后,使用荧光素酶试剂盒(购自北京原平皓生物技术有限公司)检测各组细胞的荧光活性强度。
1.10 RNA Pull-down测定 miR-423-5p,miR-423-5p突变体(miR-423-5p MUT)及其阴性对照购自GenePharma(中国上海)。使用Biotin RNA Labeling Mix(Roche,Basel,Switzerland)和T7/SP6 RNA聚合酶(Roche)对miRNA进行生物素标记。将全细胞裂解物混合并与生物素化的RNA一起温育。然后将复合物与链霉抗生物素蛋白琼脂糖珠(Invitrogen)在37℃温育1 h。洗涤珠子并通过qRT-PCR分析RNA。
1.11 统计学方法 SPSS 22.0和GraphPad.Prism.v7.01统计软件分析数据,所有数据以(均数±标准差)来表示,两组间的比较采用t检验,多组间采用One-Way ANOVA单因素方差分析,AVOVA分析后的两两比较采用Tukey’s multiple comparisons test。P<0.05为差异有统计学意义。采用ROC曲线评价miR-423-5p在血浆中的表达对银屑病的诊断价值。通过正态性检验确定PASI得分的偏正态分布。
2 结果
2.1 miR-423-5p在银屑病中低表达 qRT-PCR检测健康志愿者和银屑病患者血浆中miR-423-5p,结果发现,与健康组相比,银屑病组血浆中miR-423-5p表达水平显著降低(p<0.001)(图1a),为了进一步研究miR-423-5p是否可能成为评估银屑病患者的潜在标志物,我们对miR-423-5p与临床病理数据进行了相关性分析,结果显示(图1b~1f),银屑病患者miR-423-5p表达水平与PASI评分、CRP、ESR呈负相关(P<0.0001),与TP、ALB呈正相关(P<0.0001)。在此基础上,我们进一步采用ROC曲线来评价miR-423-5p在银屑病中的诊断价值,结果显示(图1g),ROC曲线下的面积为0.8675,这些结果表明,miR-423-5p在银屑病中表达下调并且可以作为评价银屑病的一种生物标志物。
1a:qRT-PCR检测健康组和银屑病组血浆中miR-423-5p表达水平,***表示P<0.001;1b~1f:miR-423-3p表达水平与PASI评分、TP、ALB、CRP、ESR的相关性分析;1g:ROC曲线
图1miR-423-5p在银屑病患者血浆中的表达水平及临床意义
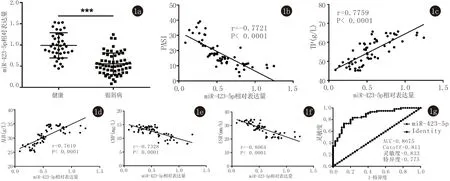
2.2 银屑病患者炎症因子水平升高 ELSIA实验结果表明银屑病患者血浆中SIL-2R、IL-10及IL-12表达较健康者均显著升高(P<0.001,图2a)。对银屑病患者血浆中miR-423-5p表达水平和SIL-2R、IL-10及IL-12表达水平进行相关性分析,结果表明银屑病患者血浆中miR-423-5p表达水平与SIL-2R、IL-10及IL-12表达水平均呈负相关(图2b)。
2a:ELISA检测健康受试者和银屑病患者血浆中SIL-2R、IL-10及IL-12表达水平,***表示P<0.001;2b:银屑病患者血浆中miR-423-5p表达水平和SIL-2R、IL-10及IL-12表达水平相关性分析
图2银屑病患者血浆炎性因子的表达水平
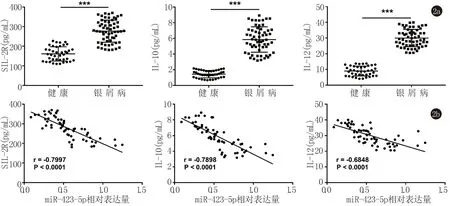
2.3 miR-423-5p抑制PBMC细胞增殖,降低细胞炎症水平 我们在银屑病患者血浆中检测到miR-423-5p水平降低,为了研究miR-423-5p在银屑病中的作用,用miR-423-5p mimics和miR-423-5p inhibitor转染PBMC细胞(图3a),检测PBMC细胞的增殖及炎症水平。MTT检测结果(图3b)显示,miR-423-5p mimics能够明显降低PBMC细胞的增殖能力,而miR-423-5p inhibitor则显著促进PBMC细胞增殖。ELISA检测炎症水平(图3c),结果表明miR-423-5p mimics显著抑制了炎症因子的表达,miR-423-5p inhibitor组炎症水平则明显升高。
3a:PBMC细胞中miR-423-5p表达水平;3b:MTT检测PBMC细胞增殖;3c:ELISA检测PBMC细胞中SIL-2R、IL-10及IL-12表达水平。与Mock组相比,**表示P<0.01,***表示P<0.001
图3miR-423-5p抑制银屑病PBMC细胞增殖和炎症表达
2.4 STAT3是miR-423-5p的靶基因 银屑病患者血浆中STAT3高表达,miR-423-5p与STAT3表达水平呈负相关(图4a、4b),我们进一步通过Targetscan在线预测miR-423-5p与STAT3的靶向关系,结果显示,STAT3与miR-423-5p的结合位点为3’-UTR区(图4c);双荧光素酶报告基因检测显示(图4d),在银屑病PBMC细胞中,miR-423-5p mimics与STAT3野生型重组载体转染组荧光素酶活性显著降低(P<0.001);RNA Pull-down实验进一步证实miR-423-5p可以直接与STAT3结合(图4e)。
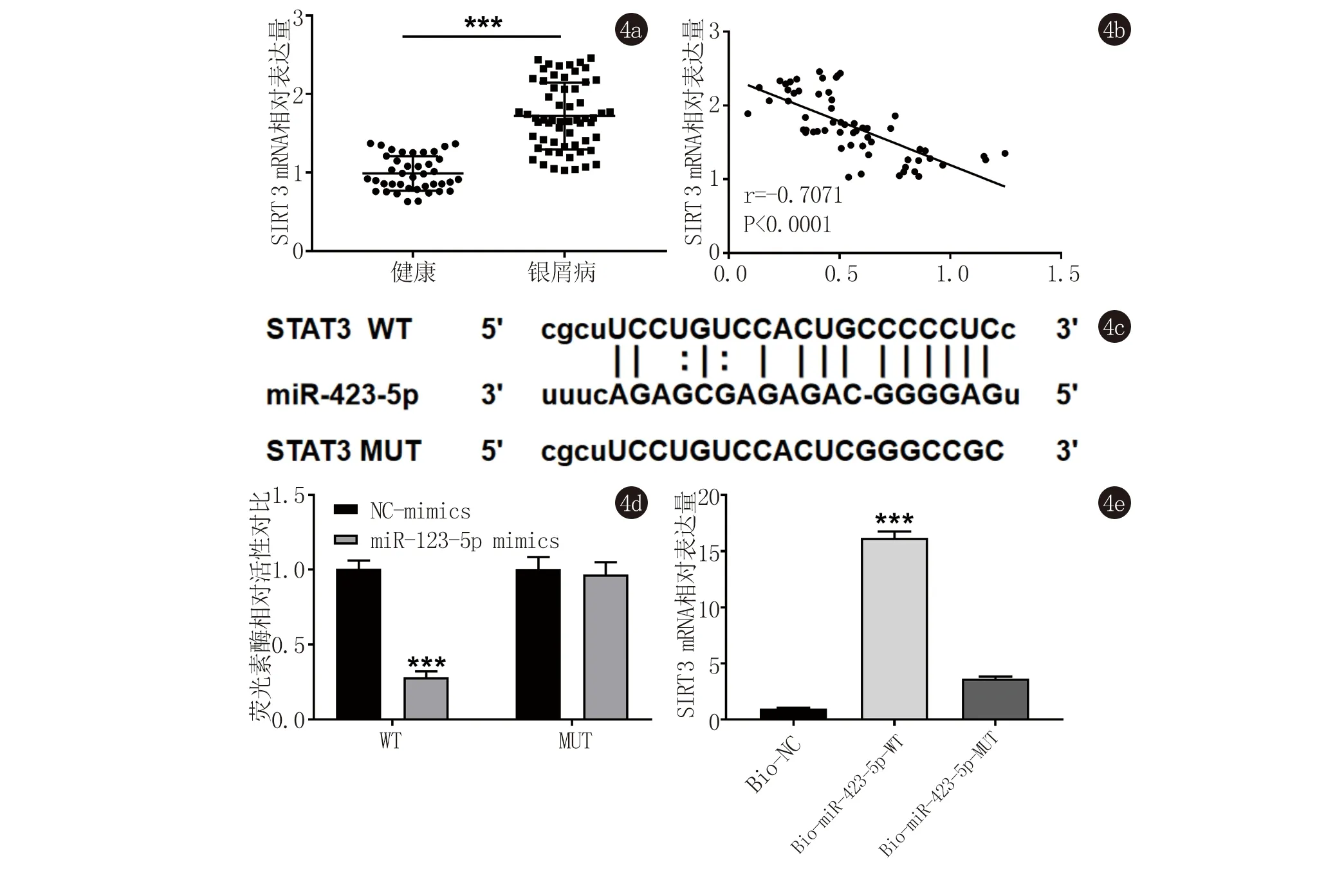
4a:qRT-PCR检测银屑病患者和健康对照组STAT3 mRNA表达水平,***表示P<0.001;4b:银屑病患者PBMC细胞中miR-423-5p表达水平和STAT3 mRNA表达水平的相关性分析;4c:Targetscan预测STAT3和miR-423-5p结合的靶位点;4d:双荧光素酶报告基因活性检测,***表示与NC-mimics组相比较,P<0.001;4e:RNA Pull-down分析,***表示与Bio-NC组相比,P<0.001
图4STAT3是miR-423-5p的靶基因
2.5 STAT3可以消除miR-423-5p在银屑病PBMC细胞中的作用 为了验证STAT3是否参与miR-423-5p在银屑病PBMC细胞增殖及炎症因子SIL-2R、IL-10、IL-12的表达,我们敲除了银屑病PBMC中的STAT3,分别采用qRT-PCR、Western blot检测干扰效率,siRNA1和siRNA2组STAT3 mRNA和蛋白水平均显著低于Mock组或si-NC组(均P<0.001)(图5a)。将miR-423-5p inhibitor与si-RNA2共转染PBMC细胞,检测银屑病PBMC细胞的增殖和炎症水平。结果表明,STAT3的沉默可显著抑制PBMC细胞的增殖(图5b),降低SIL-2R、IL-10、IL-12的表达(图5c);与siRNA2组相比,siRNA2+miR-423-5p inhibitor组细胞增殖显著增多,炎症水平提高。由上述结果可知STAT3能够消除miR-423-5p对银屑病PBMC细胞增殖及炎症表达的影响。
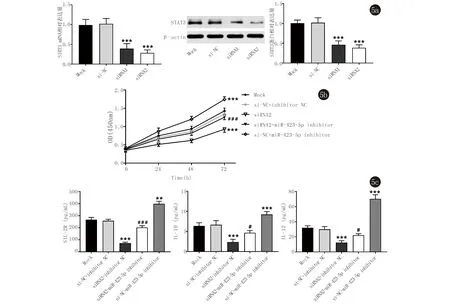
5a:qRT-PCR和Western blot检测siRNA对STAT3 mRNA和蛋白水平的敲除效果,***表示Mock组相比,P<0.001;5b:MTT检测共转染后PBMC细胞增殖,***表示Mock组相比,P<0.001;###表示与siRNA2组相比,P<0.001;5c:共转染对炎症因子的表达的影响,与Mock组相比,**表示P<0.01,***表示P<0.001;与siRNA2组相比,#表示P<0.05,###表示P<0.001
图5STAT3可以消除miR-423-5p在银屑病PBMC细胞中的作用
3 讨论
银屑病是一种由环境因素刺激、多基因遗传控制、免疫机制介导的皮肤病,其发病机制还不十分明确,目前为止,尚未有任何一种药物能够完全治愈银屑病或控制复发[1]。临床上银屑病分为4个类型,寻常型最为常见,其他类型多由寻常型转化而成。通过对银屑病家系分析,证实银屑病是多基因复杂遗传疾病,多个基因相互作用,或者与环境相互作用,导致发病,其中包括非编码小RNA(如miRNA)[2-4]。miRNAs占人类基因组的1%~5%,调控约30%的蛋白表达,是人体内种类最多的调节基因,研究表明miRNA在银屑病的发展中起着重要调节作用[5]。Zibert等[6]研究发现miR-136高表达于人表皮角质形成细胞,作用于靶基因PPP2R2A,调节TGF-β1引起的角质形成细胞的增殖,参与银屑病的发病;Fu等[7]在对银屑病患者的PBMCs的研究中发现在银屑病患者的CD4 T细胞中miR-138的表达降低,且随着miR-138表达的降低使得Th1/Th2的比例发生变化,参与银屑病的发病;Ralfkiaer等[8]通过基因芯片及qRT-PCR在慢性炎症性疾病如银屑病与皮T细胞淋巴瘤的对比中发现miR-155、miR-203、miR-205的表达可以鉴别炎症性疾病与皮肤T细胞淋巴瘤,并且具有较高的特异性和敏感性。
银屑病作为慢性炎症性皮肤病,其发展与炎性因子水平及血液学指标联系密切。邓志文[9]研究银屑病患者血液学指标的变化特点发现,银屑病患者CRP、ESR明显高于健康人群,张良芬等[10]研究发现银屑病患者SIL-2R及IL-12均高于健康人群。本研究检测了银屑病患者CRP、ESR及SIL-2R及IL-10、Il-12水平,发现CRP、ESR及IL-10、Il-12水平显著高于健康对照,与前人研究成果一致。
近些年,有研究发现miR-423-5p在骨骼肌[11]、滋养细胞[12]、心肌细胞[13]、卵巢癌[14]、胶质母细胞瘤[15]、前列腺癌[16]等多种疾病中均发挥着作用。任新新[5]、Huang等[17]发现在银屑病中miR-423-5p表达量明显减少,我们通过qRT-PCR检测,证实了miR-423-5p在银屑病患者外周血中的表达相对于健康者显著下调。通过在线预测软件Targetscan(http://www.targetscan.org/)发现STAT3是miR-423-5p的靶基因。有研究[18]发现STAT3参与银屑病的发病及发展,我们在研究中也发现银屑病患者外周血中STAT3表达量显著升高,越来越多的研究也证明STAT3在银屑病的发生发展中起着关键作用[19,20]。此外我们研究了miR-423-5p对银屑病外周血单细胞增殖及炎症水平的影响,发现miR-423-5p上调后PBMC细胞OD值明显降低,SIL-2R、IL-10和IL-12水平明显下降,miR-423-5p下调后PBMC细胞OD值显著上升,SIL-2R、IL-10和IL-12水平明显升高。而更加具体的调节机制需要进一步深入研究。

