水稻类病斑早衰突变体lmps1的表型鉴定与基因定位
夏赛赛 崔 玉 李凤菲 谭 佳 谢园华 桑贤春 凌英华
水稻类病斑早衰突变体的表型鉴定与基因定位
夏赛赛 崔 玉 李凤菲 谭 佳 谢园华 桑贤春 凌英华*
西南大学水稻研究所 / 转基因植物与安全控制重庆市重点实验室, 重庆 400715
经甲基磺酸乙酯(EMS)诱变优良籼型水稻恢复系缙恢10号, 获得一个稳定遗传的水稻类病斑早衰突变体()。该突变体苗期表型正常, 分蘖早期出现褐色类病斑, 且斑点数目随植株生长而增多, 孕穗期叶片开始萎黄衰老。与野生型相比, 突变体的每穗总粒数下降8% (<0.05), 株高、穗长、有效穗数、每穗实粒数、结实率以及千粒重分别下降14.3%、24.3%、27.2%、50%、45.7%与14.5%, 差异均达极显著水平(<0.01)。遮光处理表明, 突变体的类病斑性状受光照诱导。孕穗期叶片光合色素含量下降且光合效率降低, H2O2含量增加, 抗氧化酶SOD和CAT的活性显著降低。透射电镜观察结果显示, 突变体叶肉细胞中叶绿体数目减少, 叶绿体的类囊体片层结构损伤降解。qRT-PCR结果显示, 突变体中防卫反应相关基因除表达量降低外,、、、、、表达量均极显著高于野生型。遗传分析表明突变体的类病斑早衰性状受1对隐性核基因控制, 利用西农1A与突变体杂交所得F2群体中的突变株, 将目标基因定位于第7染色体长臂端粒附近约167.3 kb的物理区段内。
水稻(L); 类病斑早衰突变体); 表型鉴定; 基因定位
植物类病斑突变体(lesion mimic mutant,)是指在没有病原菌侵染或明显逆境的情况下, 植物体自发形成类似于病原菌侵染产生坏死斑的一类突变体[1]。此类突变体首先在玉米中发现[1-2], 随后在大麦[3]、拟南芥[4]、水稻[5-6]、花生[7]等植物中相继被报道。植物类病斑突变体的坏死斑表型类似于过敏反应, 且大多数与过敏反应以及细胞程序性死亡有关, 一些类病斑突变体能提高植物抗病性并引发相关蛋白的表达。
国内外研究工作者通过各种物理化学诱变方法已鉴定到大量水稻类病斑突变体, 其多数性状受隐性基因调控, 只有少部分由显性或半显性基因控制[8]。在这些类病斑突变体中, 已被克隆的目标基因相对较少[9]。从报道看, 水稻的类病斑主要是由抗病相关基因突变、某些代谢途径中的相关基因突变、胞内运输异常以及转录因子所致。其中一类是导致的抗病相关基因, 包括[6]、[10]、[11]、[12][13]等。另一类基因, 包括、等, 与叶绿素或其他细胞色素合成有关[14-16],参与脂氧物代谢过程[17],可能与糖类代谢有关[18]。此外, 细胞程序性死亡、热击蛋白、ROS相关基因的突变, 同样会导致水稻植株出现表型。如[19]、[20]、[21]、[22]、[23]、[24]、[25]、[26]等。
众多水稻类病斑突变体中, 仅有少数伴随早衰现象。水稻类病斑早衰突变体既能自发形成坏死病斑, 又伴有叶早衰现象, 故研究该类突变体对了解叶片衰老过程中的各种生理变化及其影响因素、解析植物抗病机制、研究细胞程序性死亡及植物防御反应相关历程具有十分重要的意义。本研究在籼型恢复系缙恢10号的EMS诱变体库中, 鉴定到一个类病斑早衰突变体()。其前期表型正常, 从分蘖早期叶片开始出现褐色小斑点, 并随植株生长而数目增多直至布满叶片。至孕穗期植株叶片开始萎黄, 表现出早衰特征。本研究对该突变体进行表型鉴定、光合特性、超微结构、生理学特性、遗传特性、基因定位等研究, 为目标基因的克隆及后续的分子机制解析等奠定良好基础。
1 材料与方法
1.1 研究材料及其表型鉴定
类病斑早衰突变体经多代自交, 其表型稳定遗传。将缙恢10号作为该突变体的野生型(WT)参照, 自然条件下, 将WT与种植田间, 比较其全生育期植株表型。成熟期分别随机选取WT和植株各10株, 分别考察其株高、穗长、有效穗数、每穗总粒数、每穗实粒数、结实率、千粒重。
1.2 遮光处理及光合色素含量与光合效率参数分析
在分蘖期, 用锡箔纸包裹田间尚未发生病斑的突变体叶片, 连续遮光1周后恢复光照, 期间持续观察叶片病斑的发生情况。在孕穗期用Beckman22S型分光光度计测定光合色素含量, 参照Wellburn[27]描述的方法, 于田间利用便携式光合测定仪Li-6400测定净光合速率(n, μmol m–2s–1)、气孔导度(s, mmol m–2s–1)、胞间CO2浓度(i, μmol mol–1)与蒸腾速率(r, mmol m–2s–1)等光合参数。
1.3 透射电镜观察及生理指标测定
参照Fang等[28]的方法, 用透射电子显微镜观察WT与叶肉细胞和叶绿体的结构。用相关试剂盒(南京建成科技有限公司)测定孕穗期倒一、倒二、倒三叶的过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)的活性和过氧化氢(H2O2)的含量, 每个样本重复3次, 用DPS软件进行数据分析。
1.4 lmps1目标基因的精细定位
分别将西农1A、及西农1A×获得的F2群体种植于西南大学水稻研究所歇马试验基地。在分蘖早期选取该群体中叶片上有褐色斑点的突变单株, 采用改良的CTAB法[29]提取亲本和F2群体中突变表型植株与10个正常表型植株的DNA备用。参照刘宝玉等[9]的方法定位的基因, 所用引物由上海英骏生物技术公司合成。
1.5 RNA提取及qRT-PCR
在分蘖期, 用RNA提取试剂盒(北京天根生化科技有限公司)提取野生型和突变体植株叶片总RNA, 以之为模板通过反转录得到相应cDNA (TaKaRa公司生产的PrimeScript 1st Strand cDNA Synthesis Kit)。用作为内参基因, 进行相关基因cDNA扩增, 以2–ΔΔCT计算各基因的相对表达量, 对每个样品至少做3个重复。qRT-PCR主要用于定位区间内部分基因和一些防卫反应相关标记基因的表达分析。
2 结果与分析
2.1 突变体lmps1的表型特性
与WT相比, 突变体苗期表型正常, 分蘖早期叶片开始出现褐色小斑点, 随着植株生长, 斑点数目持续增加(图1-A, B)。孕穗期开始出现早衰表型; 至成熟期, 斑点布满所有叶片, 衰老加速, 叶片严重黄化, 整个植株呈黄褐色(图1-C, D)。突变体的类病斑与早衰表型, 最早出现的时期不同, 但均由叶尖发展到叶片中部和基部, 并随叶龄增长而程度加深(图1-A, B, C, D)。成熟期突变体的株高、穗长、有效穗数、每穗总粒数、每穗实粒数、结实率和千粒重较野生型均显著或极显著降低(表1)。
2.2 突变体lmps1对光的响应
分蘖期对突变体即将出现但尚未有类病斑表型的叶片进行遮光处理表明, 未遮光部位逐渐产生大量褐色小斑点, 而锡箔纸遮光部位没有斑点或仅产生少量斑点, 且叶片呈绿色, 与野生型基本一致(图2-A, C)。移去锡箔纸恢复光照后, 该部位又开始逐渐变黄, 并出现褐色小斑点(图2-D)。说明突变体表型受光诱导。

图1 野生型(WT)与突变体lmps1的表型
A: 分蘖期WT与植株; B: 分蘖期WT与的叶片; C: 成熟期WT与植株; D: 成熟期WT与的叶片; 1: 倒一叶; 2: 倒二叶; 3: 倒三叶; 标尺=5 cm。
A: plants of the wild type and themutant at tillering stage; B: leaves of the wild type and themutant at tillering stage; C: plants of the wild type and themutant at mature period; D: leaves of the wild type and themutant at mature period; 1: the flag leaves; 2: the second leaves; 3: the third leaves; bar = 5 cm.

表1 野生型与突变体lmps1之间的表型差异
表中各性状的表现以“平均值±标准差” 格式呈现。**表示在0.01水平上差异显著;*表示在0.05水平上差异显著。
Phenotypic performance of each trait was expressed as means ± standard deviation.**means significant difference at< 0.01 by-test;*means significant difference at< 0.05 by-test.

图2 遮光对野生型(WT)和突变体lmps1叶片的影响
A: WT叶片; B:叶片; C:遮光1周后; D:遮光处理后复光1周后; 标尺=6 cm。
A: leaf of the wild type; B: leaf ofthemutant; C: leaf of themutantafter one week shading; D: leaf of themutant illuminated for one week after shading; bar = 6 cm.
2.3 光合色素含量分析
孕穗期突变体光合色素含量均低于WT, 差异达到极显著水平(<0.01)(图3-A, B, C, D), 并且突变体的倒三、倒四叶光合色素含量明显低于倒一叶、倒二叶, 其中倒四叶最低(图3-E, F)。表明在孕穗期突变体叶片已在生理水平上进入衰老阶段, 且衰老是从倒四叶向倒一叶发展。
2.4 光合效率变化
孕穗期, 突变体除倒一叶的气孔导度(s)外, 其他光合效率参数与WT差异均极显著:的净光合速率(n)较WT极显著降低(<0.01); 胞间CO2浓度(i)均极显著升高; 气孔导度(s)倒二叶、倒三叶极显著升高;的蒸腾速率(r)倒一叶、倒二叶均极显著降低, 而倒三叶则极显著升高(图4-A, B, C, D)。光合效率显著降低表明突变体光合能力受到严重影响。

图3 野生型(WT)与突变体lmps1孕穗期光合色素含量
A~D: 孕穗期WT与的倒一叶(A)、倒二叶(B)、倒三叶(C)和倒四叶(D)光合色素含量; E: WT光合色素含量; F:光合色素含量。条柱表示平均值, 误差线表示标准差; **表示在0.01水平上差异显著; E, F图中标的不同字母的柱值在0.05水平上差异显著。
A-D: photosynthetic pigments contents of the flag leaves, the second leaves, the third leaves and the fourth leaves respectively in the wild type and themutant at booting stage; E: photosynthetic pigments contents of the wild type; F: photosynthetic pigments contents of themutant. The column shows the mean value and the error line shows the standard deviation; ** means significant difference at< 0.01 by-test; in Figs. E and F, bars superscripted by different letter are significantly different at< 0.05.
2.5 细胞超微结构分析
利用透射电镜观察孕穗期WT和突变体倒四叶叶尖和叶中部的细胞超微结构表明, 突变体的叶绿体结构较WT出现明显变化: 细胞内叶绿体数目明显减少(图5-D, J), 嗜锇小体的数量和体积增加(图5-E, F, K, L)。叶尖部分存在结构完好的叶绿体, 但部分叶绿体严重受损, 类囊体片层结构损伤解体(图5-E, F); 叶片中部叶绿体基本完好, 基质片层结构相对叶尖部分而言较为完整, 但结构松散(图5-K, L)。表明突变体叶绿体结构损伤, 叶绿体开始降解, 致使其叶绿素含量和净光合速率n显著降低; 其叶绿体的完整程度与衰老进程一致。

图4 孕穗期野生型(WT)与突变体lmps1功能叶的光合特性
A: WT和的净光合速率; B: WT和的气孔导度; C: WT和的细胞间CO2浓度; D: WT和的蒸腾速率。条柱表示平均值, 误差线表示标准差; **表示在0.01水平上差异显著, *表示在0.05水平上差异显著。
A: net photosynthetic rate of the wild type and themutant; B: stomatal conductance of the wild type and themutant; C: intercellular CO2concentration of the wild type and themutant; D: transpiration rate of the wild type and themutant. The column shows the mean value and the error line shows the standard deviation; ** means significant difference at< 0.01 by-test, * means significant difference at< 0.05 by-test.
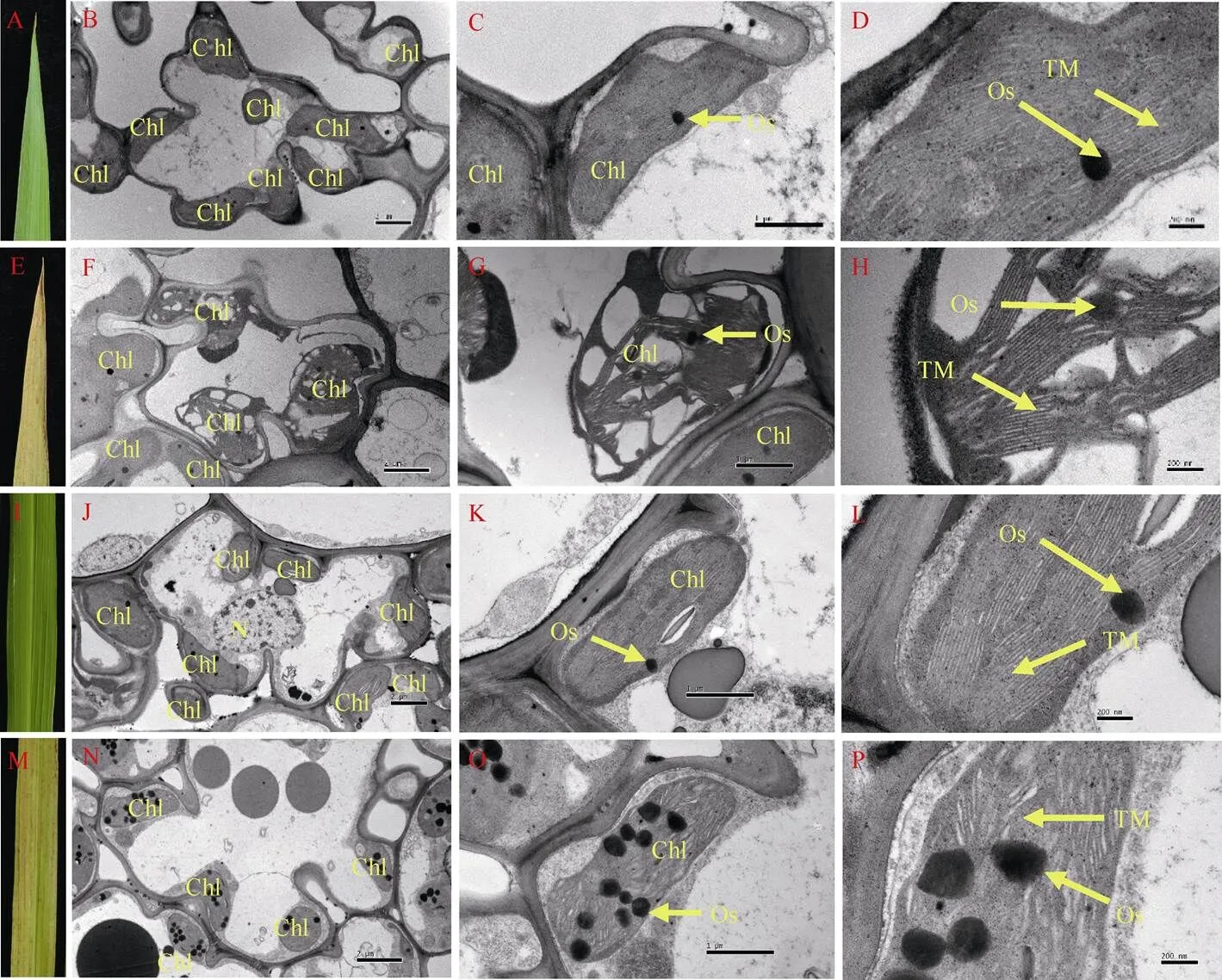
图5 孕穗期野生型(WT)和突变体lmps1的叶肉细胞超微结构
A: WT倒四叶尖; B、C、D: WT叶尖细胞超微结构; E:倒四叶尖; F、G、H:叶尖细胞超微结构; I: WT倒四叶中部; J、K、L: WT叶中部细胞超微结构; M:倒四叶中部; N、O、P:叶中部细胞超微结构; Chl: 叶绿体; Os: 嗜锇小体; TM: 类囊体膜; N: 细胞核。标尺: 2 μm (A, D), 1 μm (B, E), 200 nm (C, F)。
A: tip of the fourth leaves of the wild type; B, C, D: ultrastructure of the blade tip of the wild type; E: tip of the fourth leaves of themutant; F, G, H: ultrastructure of the blade tip ofthemutant; I: middle part of the fourth leaves of the wild type; J, K, L: ultrastructure of the middle part of blade of the wild type; M: middle part of the fourth leaves of themutant; N, O, P: ultrastructure of the middle part of blade ofthemutant. Chl: chloroplast; Os: osmiophilic granule; TM: thylakoid membranes; N: ribosome. Bars: 2 μm (A, D), 1 μm (B, E), 200 nm (C, F).
2.6 抗氧化酶活性及H2O2含量分析
在孕穗期, 除倒一叶外,倒二、倒三叶的CAT、SOD活性较WT均显著或极显著降低(图6-A, C)。的POD活性除倒三叶较WT显著降低外, 其倒一、倒二叶差异不显著(图6-B)。而的H2O2含量较WT均显著或极显著增加(图6-D)。抗氧化酶活性降低和活性氧H2O2的增加表明叶片发生衰老。

图6 孕穗期野生型(WT)和突变体lmps1的抗氧化酶活性及H2O2含量
A~C: WT和的过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性; D: WT和各功能叶过氧化氢(H2O2)含量。条柱表示平均值, 误差线表示标准差; **表示在0.01水平上差异显著, *表示在0.05水平上差异显著。
A-C: the enzyme activity of catalase (CAT), peroxidase (POD), and superoxide dismutase (SOD) in functional leaves of the wild type and themutant; D: H2O2content of different functional leaves of the wild type and themutant. The column shows the mean value and the error line shows the standard deviation; ** means significant difference at< 0.01 by-test, * means significant difference at< 0.05 by-test.
2.7 遗传分析与目标基因的定位
用籼稻西农1A与突变体构建的F1单株表型均与WT一致, F2代发生性状分离。共收获正常单株1214株、类病斑早衰突变单株420株, 其比例为2.89∶1。经卡平方测验, 符合3∶1的理论分离比例(χ2= 0.3949,= 0.5211), 表明突变体的类病斑早衰性状受1对隐性核基因控制。
选取西南大学水稻研究所现存均匀分布于水稻12条染色体上的400个SSR和InDel标记, 在西农1A和突变体之间进行多态性筛选。用筛选到的106对多态性引物扩增正常叶片和类病斑早衰叶片基因池,发现位于水稻第7染色体的InDel标记ZTQ66在两组基因池之间表现出差异, 利用F2群体中正常单株10株和类病斑早衰单株21 株进行单株验证, 初步确定ZTQ66与目标基因连锁。进一步在该标记上下游开发新的多态性标记, 初步将目标基因定位于第7染色体CY7-6和CY7-5之间(图7-A)。利用CY7-6和CY7-5之间的多态性标记, 最终将基因定位在标记CY7-8和CY7-60之间, 遗传距离分别为0.83 cM和0.71 cM, 物理距离约为167.3 kb (图7-B)。
2.8 定位区间内基因及防卫反应相关基因表达量分析
根据Rice Genome Annotation Project网站上的信息预测, 定位区间内共25个注释基因。根据遗传距离挑选部分基因并利用网站提供序列信息设计qRT-PCR引物, 对部分基因进行表达分析发现, 与野生型相比,、、表达量没有明显变化,上调接近1.5倍,上调2倍, 其他、、分别下调37.3%、76.6%和44.4%,下调近20倍(图8-A)。

图7 LMPS1基因在第7染色体的分子定位
A:基于F2群体的初定位; B:的精细定位。
A: QTL mapping of; B: fine mapping of.

图8 野生型(WT)和突变体lmps1相关基因的表达量
A:精细定位物理区间内部分基因的表达量; B: 抗病相关基因相对表达量。条柱表示平均值, 误差线表示标准差; *表示0.05水平上差异显著; **表示在0.01水平上差异显著。
A: relative expression level of annotated genes within the physical fine mapping region of; B: relative expression level of genes related to disease resistance. The column shows the mean value and the error line shows the standard deviation; * refers to the significant difference at< 0.05; ** denotes significant difference at< 0.01.
类病斑突变体中常伴随防卫反应相关基因表达的变化, 这可能是类病斑突变体对病原菌抗性增强的原因之一。图8-B表明,除相对WT下调9倍外,、、、、、均为上调。和分别上调28.2%和9.8%,上调约1.4倍、上调15.8倍、上调27倍、上调接近1倍。说明的突变可能激活部分病程相关因子, 引起水稻防卫反应。
3 讨论
目前, 通过图位克隆或其他手段, 已有多个控制水稻类病斑形成的基因被定位或克隆。已报道的类病斑突变体中, 仅有少数伴随叶片早衰现象, 包括已克隆的[19]、[18]、[30]基因对应的突变体, 它们分别被定位在第1、第8和第2染色体。未克隆的[31]、[32]、[33]等被定位在第7、第10和第11染色体。编码一个网格蛋白相关衔接蛋白复合物1, 其突变体苗期表型正常, 分蘖初期开始出现红褐色小斑点, 抽穗期斑点面积达到最大, 开花早期叶片开始黄化, 开花后期叶片枯萎, 成熟期植株死亡, 该突变体的籽粒干瘪, 产量严重下降[19];编码UDP-N-乙酰葡萄糖胺焦磷酸化酶, 在种子萌发后23 d左右开始出现黑褐色类病斑, 30 d左右开始出现叶片早衰现象, 主要农艺性状指标均严重低于野生型[18];编码一个羧基末端磷酸酶结构域及2个双链的RNA结合区, 相应突变体在播种30~40 d左右出现红棕色类坏死斑点, 开花后叶片早衰, 籽粒形态与野生型类似[30]。和尚未被克隆, 前者分蘖早期出现褐色类病斑, 后者五叶期自发出现坏死斑, 都在孕穗期出现叶片黄化衰老[31-32]。本研究中的突变体, 从分蘖早期出现褐色类病斑, 之后类病斑数量逐渐增加, 直至整个植株叶片被斑点覆盖。至孕穗期开始衰老直至整个植株呈黄褐色, 此时野生型植株呈绿色。对进行相应的生理指标测定, 与野生型相比,的光合色素含量极显著降低, 光合效率显著降低, 抗氧化酶活性降低, 活性氧H2O2显著增加。此外, 突变体较野生型, 成熟期每穗总粒数显著降低而株高、穗长、有效穗数、每穗实粒数、结实率与千粒重极显著降低。
类病斑突变体中常伴随防御反应相关基因表达的变化, 这可能是类病斑突变体对病原菌抗性增强原因之一。本研究中, 除下调9倍外, 其余、、、、、表达量均高于野生型。为PR9家族基因编码过氧化物酶, 与H2O2代谢相关, 突变体的表达量的下降符合叶片H2O2含量的变化[26];编码过氧化物酶[36];编码的蛋白属类甜蛋白质, 类甜蛋白质具有抗真菌活性[26];编码的苯丙氨酸解氨酶, 是植物防卫反应的一个关键蛋白, 涉及SA信号途径[36];为PR10家族基因, 编码一种噻菌灵诱导蛋白;编码的蛋白属于类丝氨酸羧肽酶, 常被看作水稻抗病反应的标记基因[37];为系统获得抗性中SA信号途径的标记[10]。结果表明,的突变可能激活部分病程相关因子, 引起水稻防卫反应。
目前在第7染色体已报道的类病斑突变体有、。基因已被克隆, 定位在第7染色体的短臂, 与定位区域相距较远, 且表型不同, 即基因与不是同一基因[20];目标基因定位区间包含了已报道类病斑早衰突变体的定位区间, 两者表型极为相似, 细微区别之处在于单株有效穗数以及每穗总粒数没有差异或差异不明显, 而表现出极显著的差异[31], 鉴于与的目的基因均尚不确定, 两者是否由同一基因突变有待进一步研究。
4 结论
是EMS诱变得到的类病斑早衰突变体, 早期表型正常, 分蘖早期出现病斑, 孕穗期开始衰老, 斑点数目随植株生长而增多。植株变矮, 结实率降低, 千粒重下降。叶片中光合色素含量降低, 细胞内叶绿体数目减少, 叶绿体的类囊体片层结构损伤降解。光合色素的减少和叶绿体的降解引起光合效率降低, 进而引起突变体植株表型的相应变化。突变体类病斑的产生受光照诱导, 并受ROS胁迫, 其突变能激活部分病程相关因子。该性状受1对隐性核基因控制, 被定位于第7染色体长臂端粒附近的CY7-8和CY7-60两个分子标记之间, 物理距离约为167.3 kb。
[1] Johal G S, Hulbert S H, Briggs S P. Disease lesion mimics of maize:a model for cell death in plants., 1995, 17: 685–692.
[2] Walbot V. Maize mutants for the 21st century., 1991, 3: 851–856.
[3] Persson M, Falk A, Dixelius C. Studies on the mechanism of resistance toin the barley lesion mimic mutant., 2009, 10: 587–598.
[4] Brodersen P, Petersen M, Pike H M, Olszak B, Skov S, Odum N, Jørgensen L B, Brown R E, Mundy J. Knockout of Arabidopsis ACCELERATED-CELL-DEATH11 encoding a sphingosine transfer protein causes activation of programmed cell death and defense., 2002, 16: 490–502.
[5] Shang J, Tao Y, Chen X, Chen X W, Zou Y, Lei C L, Wang J, Li X B, Zhao X F, Zhang Z K, Xu J C, Cheng Z K, Wan J M, Zhu J M. Identification of a new rice blast resistance gene,, by genomewide comparison of paired nucleotide-binding site- leucine-rich repeat genes and their pseudogene alleles between the two sequenced rice genomes., 2009, 182: 1303–1311.
[6] Mori M, Tomita C, Sugimoto K, Hasegawa M, Hayashi N, Dubouzet J G, Ochiai H, Sekimoto H, Hirochika H, Kikuchi S. Isolation and molecular characterization of amutant by modified activation-tagging in rice., 2007, 63: 847–860.
[7] Badigannavar A M, Kale D M, Eapen S, Murty G S. Inheritance of disease lesion mimic leaf trait in groundnut., 2002, 93: 50–52.
[8] Huang Q N, Yang Y, Shi Y F, Chen J, Wu J L. Spotted-leaf mutants of rice ()., 2010, 17: 247–256.
[9] 刘宝玉, 刘军化, 杜丹, 闫萌, 郑丽媛, 吴雪, 桑贤春, 张长伟. 水稻类病斑突变体的鉴定与基因精细定位. 作物学报, 2018, 44: 332–342. Liu B Y, Liu J H, Du D, Yan M, Zheng L Y, Wu X, Sang X C, Zhang C W. Identification and gene mapping of a lesion mimic mutantin rice (L.)., 2018, 44: 332–342 (in Chinese with English abstract).
[10] Chern M, Fitzgerald H A, Canlas P E, Navarre D A, Ronald P C. Overexpression of a rice NPR1 homolog leads to constitutive activation of defense response and hypersensitivity to light., 2005, 18: 511–520.
[11] Tang J, Zhu X, Wang Y, Liu L, Xu B, Li F, Fang J, Chu C. Semi-dominant mutations in the CC-NB-LRR-type R gene,, lead to constitutive activation of defense responses in rice., 2011, 66: 996–1007.
[12] Takahashi, Agrawal G K, Yamazaki M, Onosato K, Miyao, Kawasaki T, Shimamoto K, Hirochika H. Rice Pti1a negatively regulates-dependent defense responses., 2007, 19: 2940–2951.
[13] Liao Y X, Bai Q, Xu P Z, Wu T K, Guo D M, Peng Y B, Zhang H Y, Deng X S, Chen X Q, Luo M, Ali A, Wang W M, Wu X J. Mutation in riceresults in cell death, Enhanced disease-resistance, altered seed dormancy and development., 2018, 9: https://doi.org/10.3389/fpls.2018.00405.
[14] Sakuraba Y, Rahman M L, Cho S H, Kim Y S, Koh, H J, Yoo S C, Paek N C. The ricelocus encodes protochlorophyllide oxidoreductase B and is essential for chlorophyll synthesis under high light conditions., 2013, 74: 122–133.
[15] Fujiwara T, Maisonneuve S, Isshiki M, Mizutani M, Chen L, Wong H L, Kawasaki T, Shimamoto K. Sekiguchi lesion gene encodes a cytochrome P450 monooxygenase that catalyzes conversion of tryptamine to serotonin in rice., 2010, 285: 11308–11313.
[16] Sun C, Liu L, Tang J, Lin A, Zhang F, Fang J, Zhang G, Chu C., encoding a putative coproporphyrinogen III oxidase, is involved in lesion initiation in rice., 2011, 38: 29–37.
[17] Liu X Q, Li F, Tang J Y, Wang W H, Zhang F X, Wang G D, Chu J F, Yan C Y, Wang T Q, Chu C C, Li C Y. Activation of the Jasmonic acid pathway by depletion of the hydroperoxide lyase OsHPL3 reveals crosstalk between the HPL and AOS branches of the oxylipin pathway in rice., 2012, 7: e50089.
[18] Wang Z H, Wang Y, Hong X, Hu D H, Liu C X, Yang J, Li Y, Huang Y Q, Feng Y Q, Gong H Y, Li Y, Fang G, Tang H R, Li Y S. Functional inactivation of UDP-N-acetylglucosamine pyrophosphorylase 1 (UAP1) induces early leaf senescence and defence responses in rice., 2015, 66: 973–987.
[19] Qiao Y, Jiang W, Lee J, Park B, Choi M S, Piao R, Woo M O, Roh J H, Han L, Paek N C, Seo H S, Koh H J.encodes a clathrin-associated adaptor protein complex 1, medium subunit micro 1 (AP1M1) and is responsible for spotted leaf and early senescence in rice ()., 2010, 185: 258–274
[20] Jin B, Zhou X, Jiang B, Gu Z, Zhang P, Qian Q, Chen X, Ma B.Transcriptome profiling of themutant reveals thathas a negative role in the biosynthesis of serotonin for rice disease resistance.(N Y), 2015, 8: 18.
[21] Wang L, Pei Z, Tian Y, He C. OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation., 2005, 18: 375–384.
[22] Lin A, Wang Y, Tang J, Xue P, Li C, Liu L, Hu B, Yang F, Loake G J, Chu C. Nitric oxide and protein S-nitrosylation are integral to hydrogen peroxide-induced leaf cell death in rice., 2012, 158: 451–464.
[23] Yamanouchi U, Yano M, Lin H, Ashikari M, Yamada K. A rice spotted leaf gene,, encodes a heat stress transcription factor protein., 2002, 99: 7530–7535.
[24] Zeng L R, Qu S H, Bordeos A, Yang C W, Baraoidan M, Yan H Y, Xie Q, Nahm B H, Leung H, Wang G L., a negative regulator of plant cell death and defense, encodes a U-box/armadillo repeat protein endowed with E3 ubiquitin ligase activity., 2004, 16: 2795–2808.
[25] Fekih R, Tamiru M, Kanzaki H, Abe A, Yoshida K, Kanzaki E, Saitoh H, Takagi H, Natsume S, Undan J R, Undan J, Terauchi R. The rice (L.), which encodes an AAA-type ATPase, is implicated in defense response., 2015, 290: 611–622.
[26] Kim J A, Cho K, Singh R, Jung Y H, Jeong S H, Kim S H, Lee J E, Cho Y S, Agrawal G K, Rakwal R, Tamogami S, Kersten B, Jeon J S, An G, Jwa N S. Rice(accelerated cell death and resistance 1) is a potential positive regulator of fungal disease resistance., 2009, 28: 431–439.
[27] Wellburn A R. The spectral determination of chlorophyll-and chlorophhyll-, as well as total carotenoids, using various solvents with spectrophotometers of different resolution., 1994, 144: 307–313.
[28] Fang L K, Li Y F, Gong X P, Sang X C, Ling Y H, Wang X W, Cong Y F, He G H. Genetic analysis and gene mapping of a dominant presenescing leaf genein rice (L.)., 2010, 55: 2517–2521.
[29] Panaud O, Chen X, McCouch S R. Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (L.).1996, 252: 597–607.
[30] Undan J R, Tamiru M, Abe A, Yoshida K, Kosugi S, Takagi H, Kanzaki H, Saitoh H, Fekih R, Sharma S, Undan J, Yano M, Terauchi R. Mutation in, a gene encoding a protein with two double-stranded RNA binding motifs, causes lesion mimic phenotype and early senescence in rice (L.)., 2012, 87: 169–179.
[31] Li Z, Zhang Y, Liu L, Liu Q, Bi Z, Yu N, Cheng S, Cao L.Fine mapping of the lesion mimic and early senescence 1 () in rice ()., 2014, 80: 300–307.
[32] Xing Y D, Du D, Xiao Y H, Zhang T Q, Chen X L, Feng P, Sang X C, Wang N, He G H. Fine mapping of a new lesion mimic and early senescence 2 () mutant in rice., 2016, 56: 1550–1560.
[33] 林艳, 陈在杰, 田大刚, 杨广阔, 杨绍华, 刘华清, 陈松彪, 王锋. 水稻类病斑及早衰突变体的鉴定及基因初步定位. 福建农业学报, 2014, 29(1): 29–34. Lin Y, Chen Z J, Tian D G, Yang G K, Yang S H, Liu H Q, Chen S B, Wang F. Identification and gene mapping of a lesion mimic and senescence mutantin rice., 2014, 29(1): 29–34 (in Chinese with English abstract).
[34] Jwa N S, Agrawal G K, Tamogami S, Yonekura M, Han O, Iwahashi H, Rakwal R. Role of defense/stress-related marker genes, proteins and secondary metabolites in defining rice self-defense mechanisms., 2006, 44: 261–273.
[35] Datta K, Velazhahan R, Oliva N, Ona I, Mew T, Khush G S, Muthukrishnan S, Datta S K. Over-expression of the cloned rice thaumatin-like protein (PR-5) gene in transgenic rice plants enhances environmental friendly resistance tocausing sheath blight disease., 1999, 98: 1138–1145.
[36] Blilou I, Ocampo J A, Garcia-Garrido J M. Induction of(lipid transfer protein) and(phenylalanine ammonia-lyase) gene expression in rice roots colonized by the arbuscular mycorrhizal fungus Glomus mosseae., 2000, 51: 1969–1977.
[37] Ryals J A, Neuenschwander U H, Willits M G, Molina A, Steiner H Y, Hunt M D. Systemic acquired resistance., 1996, 8: 1809–1819.
Phenotypic characterizing and gene mapping of aand() mutant in rice (L.)
XIA Sai-Sai, CUI Yu, LI Feng-Fei, TAN Jia, XIE Yuan-Hua, SANG Xian-Chun, and LING Ying-Hua*
Rice Research Institute of Southwest University / Chongqing Key Laboratory of Application and Safety Control of Genetically Modified Crops, Chongqing 400715, China
An elite ricerestorer line, Jinhui 10 was chemically mutated with ethyl methane sulfonate (EMS). A novel and stable mutant,() was identified from the descendant library. The growth and development ofplant was normal at seedling stage, but its leaves began to exhibit brown spots at the beginning of tillering stage, and the number of the spots increased as the plant growing up. When mutant plant entered booting stage, leaves started to wilt and became yellowish, then exhibited premature senescence. Compared with wild type, grains per panicle ofdecreased by 8%, significantly lower than that of wild type (< 0.05). Besides, plant height, panicle length, effective panicle number, filled grain number per panicle, seed setting rate, and 1000-grain weight ofcorrespondingly decreasedly 14.3%, 24.3%, 27.2%, 50.0%, 45.7%, and 14.5%, statistically lower than those of wild type (< 0.01). The shading treatment suggested that the mutant performance ofwas light induced. Within the cells of, both of photosynthetic pigment content and photosynthetic efficiency decreased. At the same time, H2O2content increased, and activities of protective enzymes, SOD and CAT, reduced in. The observation by transmission electronic microscope (TEM) demonstrated that chloroplast number reduced in, and the chloroplast thylakoid lamellar structure seriously damaged and degraded. As a result of qRT-PCR, the expression levels of,,,,, andwere higher inthan in wild type, while that ofwas lower than that of wild type. The genetic analysis indicated that the lesion mimic and premature senescence ofwas under the control of a recessive nuclear gene. Mapping result via F2population derived from the cross between Xinong 1A andshowed that, the target gene was located in a 167.3 kb physical interval near the telomere of the long arm of chromosome 7 in rice (L.).
rice (L.);(); phenotyping; genemapping
通信作者(Corresponding author): 凌英华, E-mail: lingyh003@126.com
2018-04-25;
2018-08-20;
2018-09-18.
10.3724/SP.J.1006.2019.82022
本研究由重庆市社会事业与民生保障科技创新专项项目(cstc2016shms-ztcx80012)和中央高校基本科研业务费专项资金(XDJK2016A013)资助。
This study was supported by the project of Chongqing Science and Technology Commission Grants (cstc2016shms-ztcx80012) and Fundamental Research Funds for the Central Universities (XDJK2016A013).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180915.1120.006.html
——早衰

