五没食子酰基葡萄糖对H2O2诱导的肾小球系膜细胞氧化损伤及凋亡的影响
林爱琴,卜文婕,窦德宇2,宫磊
(1. 皖南医学院医学生物学教研室,安徽 芜湖 241002; 2. 活性生物大分子研究安徽省重点实验室,安徽 芜湖 241002)
五没食子酰基葡萄糖(英文全称Penta-O-galloyal-D-glucose,简称PGG)广泛存在于自然界的植物中,其中五倍子中的含量最高,其次为牡丹皮、白芍、赤芍、黄芩等[1]。由于PGG分子中含有多个酚羟基[2],从而它具有了独特的理化性质和生理活性,表明 PGG 将可能成为一种天然抗氧化剂而具有潜在的广泛应用前景。正常情况下,机体不断产生活性氧(ROS)、超氧阴离子等,同时机体中的超氧化物歧化酶(SOD)、维生素E、谷胱甘肽还原酶等进行抗氧化清除,而剩余的ROS参与维持血管紧张和一系列信号传导过程,当机体在外部刺激下,ROS增多,氧化程度超过了抗氧化清除能力,机体出现了氧化应激(OS)[3]。本研究通过一定浓度的过氧化氢(H2O2)刺激大鼠肾小球系膜细胞(GMCs)产生氧化应激,了解不同浓度的PGG对GMCs细胞抗氧化能力的影响。
1 材料与方法
1.1 实验材料
1.1.1 细胞株 GMCs细胞株来源于皖南医学院弋矶山医院中心实验室。
1.1.2 实验试剂 PGG,上海源叶生物科技有限公司;30%H2O2,国药集团化学试剂有限公司;低糖DMEM培养基,美国Hyclone公司;胎牛血清,澳洲CLARK Bioscience公司;CCK8试剂盒,碧云天生物技术有限公司;活性氧检测试剂盒,碧云天生物技术有限公司;细胞凋亡试剂盒,碧云天生物技术有限公司;总SOD活性检测试剂盒,碧云天生物技术有限公司;总谷胱甘肽过氧化物酶(GSH-Px)试剂盒,碧云天生物技术有限公司。
1.1.3 主要的实验仪器设备 多功能微孔检测仪(瑞士TECAN,M200 PRO),流式细胞仪(BD公司,FACSVerseTM),超净工作台(苏州苏净,SW-CJ-2FD),高速离心机(美国Eppendorf)。
1.2 实验方法
1.2.1 细胞培养 将细胞株从液氮罐中取出迅速在37℃水浴锅中水浴,复苏后接种于完全培养基(含有10%胎牛血清的低糖DMEM培养基)中。在5%CO2、37℃的细胞培养箱中培养,待细胞生长至80%时进行消化传代,本实验选取5~7代对数生长期细胞进行研究。
1.2.2 H2O2和PGG最佳浓度的筛选 用完全培养基将GMCs细胞稀释成单个细胞悬液并接种于96孔板中,24 h细胞贴壁后,换用无血清的低糖DMEM培养基饥饿12 h,用无血清低糖DMEM培养基配制不同浓度H2O2(100 μM、200 μM、300 μM、400 μM、500 μM、600 μM),PGG用DMSO溶解后用无血清低糖DMEM培养基稀释成不同浓度(0.1 μM、1 μM、5 μM、10 μM、20 μM),CCK8试剂盒检测分别筛选出最佳浓度的H2O2(对细胞产生一定损伤的浓度)和PGG(对细胞不产生毒性的浓度)。
1.2.3 流式细胞术检测各组ROS和细胞凋亡水平 取对数生长期细胞均匀接种于6孔板上,分为6组:正常组、阳性组、10 μM PGG组、5 μM PGG组、1 μM PGG组、0.1 μM PGG组,每组3个复孔,待贴壁后换无血清培养基饥饿3 h各组进行加药处理,正常组为不做处理的GMCs细胞,阳性组细胞给予600 μM的H2O2刺激,PGG各组细胞给予600 μM的H2O2和不同浓度PGG刺激,各组在处理18 h后,通过流式细胞仪上机检测,采用Flowjo 7.6软件对结果进行分析,计算ROS和凋亡水平。
1.2.4 试剂盒检测各组SOD和GSH-Px水平 各组细胞按上述方法在6孔板中处理后,分别加入裂解液,蛋白裂解后制成样品,用试剂盒检测每个样品中SOD和GSH-Px含量,再检测样品的蛋白含量,最终结果以单位总蛋白中的目的蛋白的含量为准。

2 结果
2.1 H2O2和PGG最佳浓度的筛选 当H2O2浓度达到500 μM时,OD值与正常组开始产生显著差异(P<0.05),在600 μM浓度下,与正常组间差异更明显(P<0.01),因此,600 μM的H2O2可作为较合适的浓度,刺激细胞产生氧化作用。见表1。PGG浓度在达到20 μM时,其OD值明显低于正常组(P<0.01),说明此浓度对GMCs细胞产生了一定毒性,细胞发生凋亡,所以本实验选择PGG的最高浓度为10 μM。见表2。

表1 不同浓度H2O2对GMCs细胞产生的影响
注:与正常对照组比较,a:P<0.05,b:P<0.01

表2 不同浓度PGG对GMCs细胞产生的毒性影响
注:与正常对照组比较,a:P<0.01
2.2 不同浓度PGG对H2O2诱导GMCs细胞中ROS含量的影响 流式细胞仪检测结果(见图1)显示,随着PGG浓度的升高,GMCs细胞产生的ROS逐渐减少,0.1 μM PGG组虽然减少但与阳性对照组比较差异无统计学意义(P>0.05)。从1 μM PGG浓度开始,PGG各组与阳性对照组的ROS含量有明显差异(P<0.05),其中10 μM PGG组与正常组间已无差异,表明在一定浓度范围内PGG的抗氧化作用随着浓度的升高而增强。


图1 不同浓度PGG对H2O2诱导的GMCs细胞产生ROS的影响
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;与阳性组比较,#P<0.05,##P<0.01,###P<0.001
2.3 不同浓度PGG对H2O2诱导GMCs细胞凋亡的影响 氧化应激可引起GMCs细胞产生细胞凋亡,本实验结果显示(见图2),在600 μM H2O2的浓度下,细胞凋亡最多,达到38.76%,当加入PGG保护时,随着PGG浓度升高,细胞凋亡率逐渐减少,但仍存在一定凋亡,与阳性组相比,有显著降低(P<0.05)。

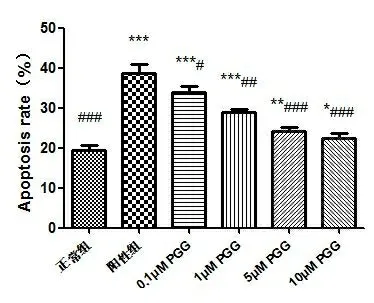
图2 不同浓度PGG对H2O2诱导的GMCs细胞凋亡的影响
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001;与阳性组比较,#P<0.05,##P<0.01,###P<0.001
2.4 不同浓度PGG对H2O2诱导的GMCs细胞SOD、GSH-Px活力的影响 10 μM、5 μM和1 μM PGG组的SOD水平均明显高于阳性组,10 μM PGG组的SOD活性较其他加药组最高,与正常组间差异无统计学意义(P>0.05),0.1 μM PGG组则与阳性组间差异无统计学意义(P>0.05)。PGG组细胞的GSH-Px水平均明显高于阳性组,但低于正常组,差异有统计学意义(P<0.5),随着PGG浓度的升高,GSH-Px活力水平也相应增加。见表3。

表3 不同浓度PGG对H2O2诱导的GMCs细胞产生氧化应激的相关因子活性
注:与正常组比较,a:P<0.05,b:P<0.01,c:P<0.001;与阳性组比较,d:P<0.05,e:P<0.01,f:P<0.001
3 讨论
糖尿病肾病作为糖尿病主要慢性并发症之一,近年来临床及实验研究表明其发病机制与很多因素有关,主要包括氧化应激、蛋白激酶C、蛋白非酶糖基、多元醇通路4种学说,其中氧化应激在其发展中起到关键作用[4-5]。氧化应激指的是机体遭受到各种刺激后,体内的ROS产生过多,引起氧化系统和抗氧化系统的失衡,细胞产生脂质过氧化,导致溶酶体和线粒体损伤,进而导致组织损伤的一系列过程[6]。ROS作为机体代谢过程中氧化还原反应产物,参与调节杀菌、解毒等多种代谢途径[7],也是细胞凋亡的前期产物。而过量的ROS是引起糖尿病肾损伤多条通路激活的共同途径[8]。过氧化氢(H2O2)是一种强氧化剂,能够诱导机体产生大量的ROS,导致机体产生氧化应激反应,从而引起氧化损伤。目前由于H2O2比较容易获得并且其性质相对稳定,易透过细胞膜,从而生成活性氧自由基,因而很多研究都是通过H2O2作为诱导细胞产生氧化应激模型[9-10]。
当细胞内ROS产生和清除的动态平衡被打破时,就会启动有效地抗ROS防御体系,如SOD、GSH-Px等因子[11]。SOD 和 GSH-Px是细胞内重要的抗氧化酶,具有降解细胞内ROS的作用[12]。SOD能够催化ROS生成H2O2和O2,其活性在一定程度上体现了机体对活性氧自由基的清除能力[13],通过特异地与超氧化物阴离子(O-2) 发生歧化反应,清除O-2,保护机体免受自由基的损害。GSH-Px进一步代谢H2O2,加速H2O2的分解形成分子O2和H2O[14],阻断氧化反应发挥拮抗脂质过氧化作用,避免H2O2对细胞的影响。
PGG具有多种生物及药理活性,如抗炎、抗氧化、抗肿瘤、抗血管再生以及延长寿命等,近年来有研究发现PGG在治疗糖尿病方面具有较高的价值[15]。本实验通过600 μM H2O2刺激GMCs细胞并同时加入不同浓度PGG,检测ROS水平及细胞凋亡程度,并检测细胞中抗氧化相关因子SOD和GSH-Px水平,从而研究不同浓度PGG是否对氧化应激损伤下的GMCs细胞产生一定的抗氧化作用。最终结果表明,随着PGG浓度的升高,GMCs细胞中ROS水平逐渐降低,细胞凋亡程度减轻,当PGG浓度达到10 μM时,与正常组间无显著差异,说明此浓度下的PGG能有效减少H2O2诱导细胞产生的ROS,从而减少细胞凋亡程度;PGG各组的SOD和GSH-Px活性均显著高于阳性组,其中10 μM PGG组表达量最高,说明氧化应激水平明显降低,所以,PGG可能通过影响细胞内SOD和GSH-Px的水平,减少H2O2对GMCs细胞产生的氧化应激,减少ROS产生,进一步减少细胞凋亡,从而对细胞起到一定的保护作用。
综上所述,PGG对于H2O2引起的GMCs细胞产生的氧化应激有一定抗氧化作用,提示PGG可能作为一种抗氧化途径解决糖尿病肾病损伤,为后续PGG在糖尿病肾病方面的研究提供了一定的理论依据和实验基础。

