中国脑小血管病的临床研究优先发展战略规划
中国卒中学会脑小血管病专家联盟(执笔:王伊龙;学术委员会主席:王拥军)
脑小血管病(cerebral small vessel disease,CSVD)是老年人中最常见的脑血管疾病,也是一种全身性、全脑性的慢性重大疾病,为老龄化社会带来沉重的疾病负担。CSVD不仅可以引起急性症状,如腔隙性脑梗死、脑出血等,占症状性卒中的20%,同时也可隐匿起病,如痴呆、步态异常、尿潴留及情绪障碍等[1],20%~40%的老年性痴呆与CSVD相关[2]。然而,由于缺乏脑小血管结构与功能的可视化测量工具,CSVD真正的致病机制尚不明确,阻碍了对疾病的精确诊断和有效治疗。本规划旨在探讨目前CSVD发病机制和临床诊疗研究的局限性和重大挑战,并展望CSVD未来可能的优先发展的临床研究方向。
1 脑小血管病目前的诊断和分类
理论上,CSVD指的是小动脉、毛细血管和小静脉血管壁的病理改变,比如脂质玻璃样变和纤维素样坏死,其病因有多种,最常见的是老龄及血管危险因素相关的小动脉硬化。Leonardo Pantoni[1]根据病因将CSVD分为小动脉硬化性、散发及遗传性脑淀粉样血管病、其他遗传性小血管病、炎症及免疫介导的小血管病、静脉胶原性疾病及其他病因(如放疗后脑病)等。然而,由于目前无法在活体中将血管的病理改变可视化,病理学诊断在临床使用受到一定限制。病理-影像学研究发现,这些脑小血管内的病理改变与脑实质的病变密切相关,在头颅影像学如CT和MRI上表现为脑白质病变、腔隙、腔隙性梗死灶等脑实质损伤的间接征象,这些损伤征象在临床诊断CSVD上有一定的实用价值[3]。因此,目前CSVD的诊断主要依赖于头颅影像学上脑损伤的间接征象血管变化的神经影像学报告标准(STandards for ReportIng Vascular changes on nEuroimaging,STRIVE)分型,分型建议了6个公认的CSVD影像学表现,包括脑白质高信号改变(MRI-FLAIR序列上表现为脑白质高信号)、新发的皮质下小梗死、腔隙、血管周围间隙、微出血及脑萎缩,作为CSVD诊断的主要依据[4]。
值得一提的是,CSVD虽然有多种影像学及临床表现,但在急性脑血管病的分类标准中,“脑小血管病”特指急性小动脉闭塞引起的卒中,其相应的名称和意义在不同的分型中有略微的差别,如牛津社区卒中项目(Oxfordshire Community Stroke Project,OCSP)分型中的“腔隙综合征”[5]、急性卒中治疗低分子肝素试验(Trial of Org 10 172 in Acute Stroke Treatment,TOAST)分型[6]和中国缺血性卒中分型(Chinese Ischemic Stroke Subclassification,CISS)[7]中的“小动脉闭塞性卒中”,以及动脉粥样硬化-小血管疾病-心脏来源-其他原因(atherosclerosis-small vessel disease-cardiac source-other cause,ASCO)分型[8]中的“小血管病”。这些在临床上时常被笼统地称为“腔隙性脑梗死”,但这些分类标准对CSVD的诊断都有一定缺陷。“腔隙综合征”是一个纯粹基于临床综合征的诊断,其依据是牛津社区的一项流行病学研究结果,该研究总结出一系列的临床综合征,根据累及的血管并将这些综合归因划分为前后循环大血管梗死及皮质下小血管梗死。需要注意的是,“腔隙性脑梗死”并不等同于小血管病引起的卒中,大血管源性栓塞导致的部分皮层梗死临床上也可以引起腔隙性综合征[9]。而TOAST、CISS、ASCO 3种分型则是综合临床症状及病史、头颅影像学显示的腔隙性梗死病灶(皮质下直径<20 mm的小梗死灶),以及排除大血管病因、栓塞等其他病因后,最终诊断“小动脉闭塞”,因而是一个排他性的诊断。实际上,影像学所见的腔隙性梗死灶病因有多种,包括栓塞(动脉-动脉、心源性、反常栓子)、载体动脉粥样硬化、深穿支动脉粥样硬化,以及深穿支和更小的血管自身管壁的病变如玻璃样变,只有最后者才是真正的CSVD。由于缺乏可视化小血管病病变的影像学技术,临床上并不能很好地区分这几种病因,尤其是大穿支动脉的动脉粥样硬化(微动脉粥瘤)与小动脉玻璃样变或其他小血管管壁的自身病变(图1)。
2 脑小血管病诊断的局限与挑战
如前所述,CSVD的诊断存在诸多局限性和挑战。
首先,影像学的诊断仍以定性为主。尽管脑白质病变及血管周围间隙等有相应的评分量表和容积计算等方法评估严重程度,但是仍然缺乏真正针对小血管本身的定量的疾病负荷评价体系。
第二,这些脑实质影像学改变本身也存在异质性,如虽然MRI脑白质高信号病灶看似相同,但其潜在的脑实质及血管病理生理学机制可能不同,导致的临床表现和转归也存在差异,但这些异质性在平扫MRI序列无法得到体现,因而最终被笼统地归类于同一种病变。
第三,临床诊断仍然比较混乱。虽然卒中分型不断被修订和改进,但对小血管病的诊断仍旧为排他性。这些卒中分型比较适用于大血管源性的卒中,对小血管性的卒中诊断价值有限。因此,目前CSVD诊断缺乏与病理生理机制结合的临床诊断标准,如脑小血管形态、数目改变,管壁的物理结构、化学成分的分析及功能评价等等,这些均有赖于可视化的影像学技术和分子影像学技术,如高分辨或高场强MRI将小动脉显影,或者可测量小动脉管壁功能及血脑屏障完整性的新MRI序列,以及可分析小血管壁成分的分子生物学技术等。CSVD结构、功能及发病机制的部分影像学技术见表1。
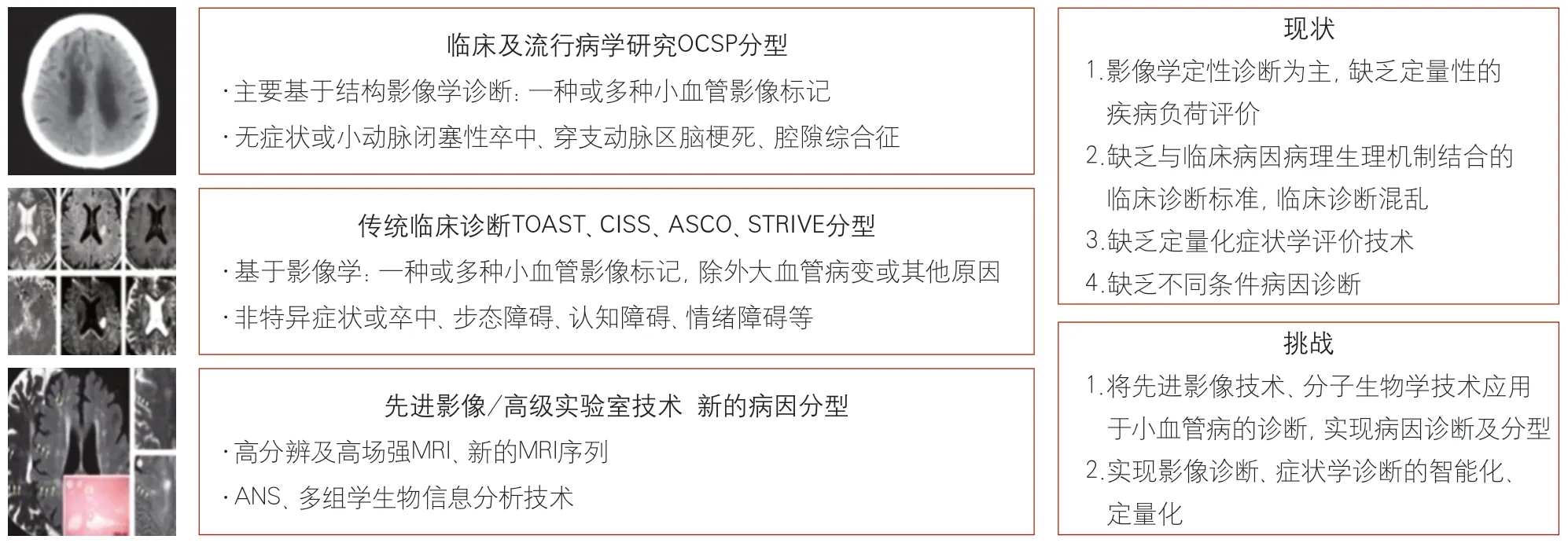
图1 脑小血管病诊断的现状及挑战
最后,CSVD的临床表现除卒中急性发作以外,还有很大一部分为非卒中样急性发作表现,如认知下降、步态障碍、情绪障碍等[1]。但是目前尚缺乏一个能将这些临床症状综合和分类的CSVD诊断标准,同时,如何定量化评估以上临床症状和结局也有待进一步探索。
因此,如何将先进的影像学技术、分子生物学技术应用于CSVD的诊断,从而实现更精确的病因诊断和分型,以及如何将影像学诊断和症状学诊断进行定量化、智能化,是目前CSVD和症候学诊断面临的重要挑战(图1)。
3 脑小血管病的治疗现状与挑战
目前CSVD的治疗仍然十分有限,大部分都处于研究阶段(表2),且没有特异性的治疗措施。根据CSVD是否为卒中的急性期分为急性期治疗和非急性期治疗。由于尚无针对CSVD的卒中急性期治疗指南,CSVD卒中急性期治疗与大血管卒中相同,包括超急性的溶栓治疗、取栓治疗和急性期的抗栓治疗。虽然有研究提示,CSVD影像学改变与溶栓后出血有关,如脑白质病变及微出血是溶栓后脑出血的预测因素[10]。但是,尚无研究探讨小血管本身的病变引起的梗死是否适用于溶栓治疗。另外,值得一提的是,根据氯吡格雷用于急性非致残性缺血性脑血管病事件高危人群的疗效(Clopidogrel in High-risk Patients With Acute Non-disabling Cerebrovascular Events,CHANCE)研究结果,轻型卒中和高危TIA的双抗治疗(阿司匹林+氯吡格雷)已被纳入国内外卒中的急性期治疗指南[11-12]。但CSVD引起的卒中并不等同于“小卒中”(轻型卒中),因为出血风险增加等因素,合并CSVD可能会降低急性轻型卒中强化抗血小板治疗的临床净获益比例。
CSVD的非急性期治疗主要为抗栓和血管危险因素的防控。皮层下小卒中二级预防研究3(Secondary Prevention of Small Subcortical Strokes 3,SPS3)研究结果显示,腔隙性脑梗死患者使用双抗3个月以上将导致出血风险增加及死亡率升高,因此需谨慎对腔隙性脑梗死患者使用长期双抗治疗[13];针对CSVD的单抗研究较少,有队列研究及小样本临床试验提示,其他抗血小板药物如西洛他唑可能减少痴呆发生率[14]或减缓脑白质病变进展[15]。虽然C.Miller Fisher[16]的早期病理学研究提示,CSVD患者小动脉壁的脂质玻璃样变及纤维素样坏死是由于长期高血压导致,多项临床研究亦显示了CSVD与高血压之间密不可分的关系,如中国国家卒中登记(China National Stroke Registry,CNSR)研究提示,高血压病史与小动脉闭塞性卒中的复发显著相关[17],但目前的临床研究尚未证实CSVD与高血压之间的因果关系。既往的临床研究中,降压对CSVD的疗效并不一致。有些研究提及降压治疗对减少脑白质病变继续进展效果非常微弱或者没有效果[18-19],但这些研究入组的并非特异的CSVD患者,仅结局评价包括脑白质病变进展。SPS3与小血管病血压治疗(Blood Pressure Treatment in Small Vessel Disease,PRESERVE)两项研究均以腔隙性脑梗死或腔隙性脑梗死合并脑白质病变为入组标准,均对比常规降压与强效降压之间的差异。SPS3结果提示强效降压安全,有潜在降低卒中复发的趋势(HR0.81,95%CI0.64~1.03,P=0.08),但对改善腔隙性脑梗死后认知功能无益[20];PRESERVE研究提示,强效降压并不会降低严重脑白质病变患者脑血流量[21]。在收缩压干预试验(Systolic Blood Pressure Intervention Trial,SPRINT)认知研究部分入组的462例无糖尿病或卒中病史的高血压患者中,与标准降压组相比,强化降压组患者的脑白质病变体积进展更慢,但脑容积下降幅度更大[22];与之相似,强化与标准降压预防老年人功能衰退(INtensive versus standard ambulatory blood pressure lowering to prevent functional DeclINe in the ElderlY,INFINITY)研究在2019年美国心脏病学会大会公布的初步结果也提示,在有脑白质病变的高血压患者中,强化降压组相对于标准降压组脑白质病变体积增幅更小,且两组患者的跌倒和晕厥症状无统计学差异[23]。这些研究的异质性较大,入组标准和结局评估均有差异,随机对照研究很少。未来的临床研究需要更好地筛选CSVD患者,探索降压的时机、疗程、目标血压,同时使用多维度的结局评价。

表1 脑小血管病结构、功能及发病机制相关的部分影像学技术

表2 脑小血管病潜在的干预药物及靶点①
其他二级预防治疗如他汀类药物对CSVD的治疗效果也有一定争议,强化降低胆固醇预防卒中(Stroke Prevention by Aggressive Reduction in Cholesterol Levels,SPARCL)研究结果提示,阿托伐他汀(80 mg/d)或许可以降低卒中患者小动脉闭塞性卒中的复发率[24],但其他研究结果显示他汀类对延缓脑白质病变进展并无显著效果[25]。缺血性卒中高危出血患者心血管事件的预防(PreventIon of CArdiovascular events in iSchemic Stroke patients with high risk of cerebral hemOrrhage,PICASSO)研究提示,高出血风险的缺血性脑血管病患者(其中60%为CSVD)在使用单抗(阿司匹林或西洛他唑)时加用普罗布考可能减少心血管事件发生率[26]。维生素补剂如维生素B12、叶酸也可能是未来CSVD治疗研究的方向。维生素预防卒中(VITAmins TO Prevent Stroke,VITATOPS)研究MRI亚组的一项事后分析提示,补充维生素B12与脑白质体积进展减小显著相关[27]。
由此可以看出,由于上文提及的CSVD诊断困难和标准的不统一,临床试验面临较大困难,主要体现在患者的选择和入组方式及预后评价体系的制订。专门针对CSVD的随机对照临床研究非常有限,主要以发生过腔隙性脑梗死为CSVD的入组标准,如SPS3研究[13]。如前所述,腔隙性脑梗死与CSVD并不完全等同。无论是以OCSP腔隙综合征为入组标准还是以“排除法”进行病因诊断的TOAST等分型筛选CSVD患者,都不能很好地反映CSVD真正的靶点,不仅将一部分大血管病因的患者混在其中,甚至也很有可能将不同病理生理学机制导致的CSVD患者混为一谈,这些原因也许可以部分解释为什么目前很少有CSVD的随机对照临床试验发现显著的疗效。其次,单以卒中的复发作为临床结局也存在一定问题。目前认为,CSVD是一个全脑性且有动态变化的疾病,卒中仅为整个疾病谱中的一个临床表现。除卒中外,CSVD病程可以缓慢而隐匿,或呈阶梯式加重,如认知障碍、步态异常等[1],以卒中复发作为预后评价体系并不能完全体现整个疾病的进展。
因此,未来的CSVD临床试验需要一个更为明确的诊断,这一点有赖于对CSVD机制的进一步探索,需要更多的大样本临床试验;另外,还需要建立一个更加完善的多维度CSVD预后评价体系,综合考虑卒中复发、认知功能、步态异常及血管功能、结构的改变等。
4 基于脑小血管病病理生理学机制的潜在干预靶点
CSVD的诊断和治疗措施主要囿于对其病理生理学机制有限的认知。虽然在常规的CT和MRI平扫中,CSVD表现为看似一致的腔隙性脑梗死及脑白质病变等脑实质改变,但是最新证据表明,这些病灶的结局并不相同,如部分腔隙性梗死灶液化为腔隙,而其他的则转变为脑白质高信号病灶持续存在,或者有些也可以消失[28];脑白质病变除了可以持续保持不变或者进展至更大面积病灶以外,还可以逆转或者消失[29]。这些证据提示,CSVD本身有很大的异质性,可逆和不可逆性病灶可能是由不同的病理生理学过程导致,但目前对这些机制的了解还十分有限。
CSVD是一个复杂的全脑疾病,其致病过程可大致总结如下:①由于老龄、高血压等血管危险因素、遗传、淀粉样血管变性、氧化应激、炎症等导致小血管结构和功能异常;②小血管的结构和(或)功能异常引起血管源性脑改变,即STRIVE指南中提及的腔隙性脑梗死、血管周围间隙扩大、脑白质病变等;③脑结构的损伤进而导致脑网络功能障碍,如脑白质纤维物理连接的断裂,或者脑功能网络连接的异常等。每一个层面涉及的不同机制都有待进一步探索(图2)。
研究表明,CSVD病变不仅仅局限于小动脉,小静脉和毛细血管也受到累及,但具体每个层级血管的结构及功能改变和产生的机制目前尚不清楚。有猜想认为,CSVD的血管损伤早期可能始于血管内皮损伤,例如血压升高或血液中的有害物质如炎症因子可诱发血管内皮损害。动物学实验表明,由压力过高导致的血管壁剪切力升高可以直接损害血管内皮细胞。也有越来越多的证据提示,炎症在CSVD中扮演着重要的角色[30-31]。然而,不同层级的血管是否存在不同的病理及生理学机制,以及是否产生不同的病灶目前也尚无定论。
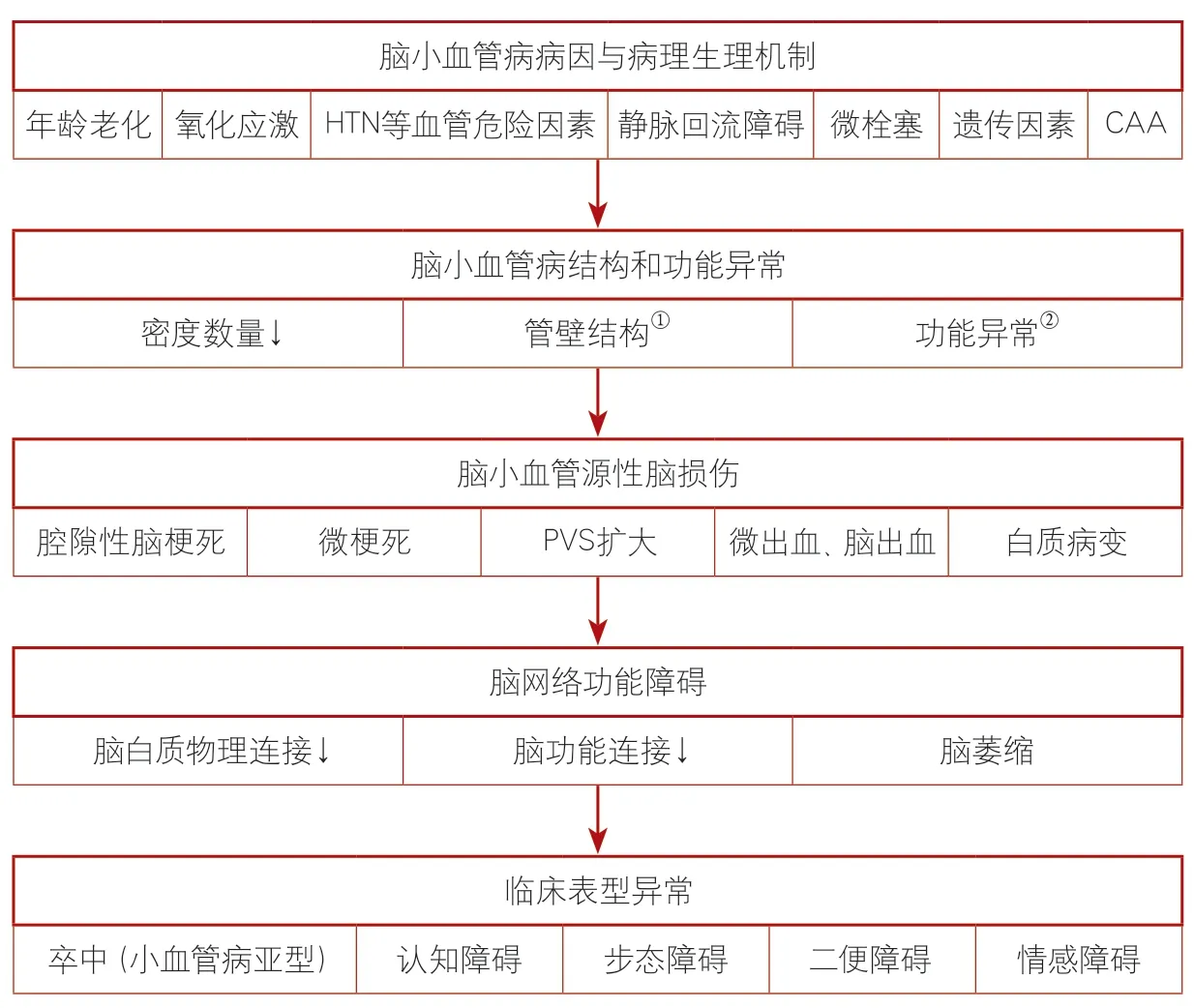
图2 脑小血管病的致病过程
在此提出假设,将CSVD的典型影像学改变分为3类(图3):①400~900 μm直径的较大穿支动脉主要功能为血液运输,其闭塞的主要病因考虑为动脉粥样硬化,可引起较大的脑深部单发梗死灶,因而其主要的治疗措施可能为抗动脉粥样硬化;②多发的小皮质下梗死(伴或不伴脑白质高信号)则可能为典型的小动脉、小分支病变。这些血管直径为40~400 μm,主要功能为调节血液灌注,梗死机制可能包括小动脉硬化、脂质玻璃样变、中膜平滑肌丢失等,其相应的治疗靶点可能为改善内皮细胞功能、抗炎、改善血管僵硬程度等;③更小的微动脉或毛细血管,直径在40 μm以下,主要功能为氧、能量和物质的交换,是构成血脑屏障的基本单元。当此类血管发生病变时,也许仅引起脑白质病变但不发生梗死,或在看似正常的脑白质组织中隐匿出现,其病理改变可能为良性、可逆的,但也可能是阿尔茨海默病等神经退行性疾病的早期病因,因而是否有必要治疗及如何治疗尚存争议,还需更多研究来证实和探索[32]。
5 展望
目前,CSVD优先发展临床研究方向总结为以下几个方面:①进一步探索CSVD病理改变的异质性,探讨潜藏在貌似相同的影像学改变之下不同的脑组织改变、血管结构和功能变化及病因;②以临床问题为切入点,在临床前开展基础转化研究探索内皮损伤、血脑屏障破坏、炎症及应激等机制在CSVD中的作用,为CSVD的治疗提供新的治疗靶点[33];③开展基于影像表型的多组学研究,绘制CSVD发生、发展的遗传与环境暴露图谱;④以单基因遗传性CSVD为天然模型,开展干预靶点研究,为研究多暴露因素导致的复杂CSVD干预靶点提供科学依据;⑤针对潜在的不同的病理生理学机制,筛选可能的药物和非药物治疗方式,如血管内皮保护药物、抗炎药物等[34],根据患者的异质性进行分层,针对性地进行临床前期或者临床试验,为CSVD患者提供精准的治疗证据,预防卒中及痴呆的发生。
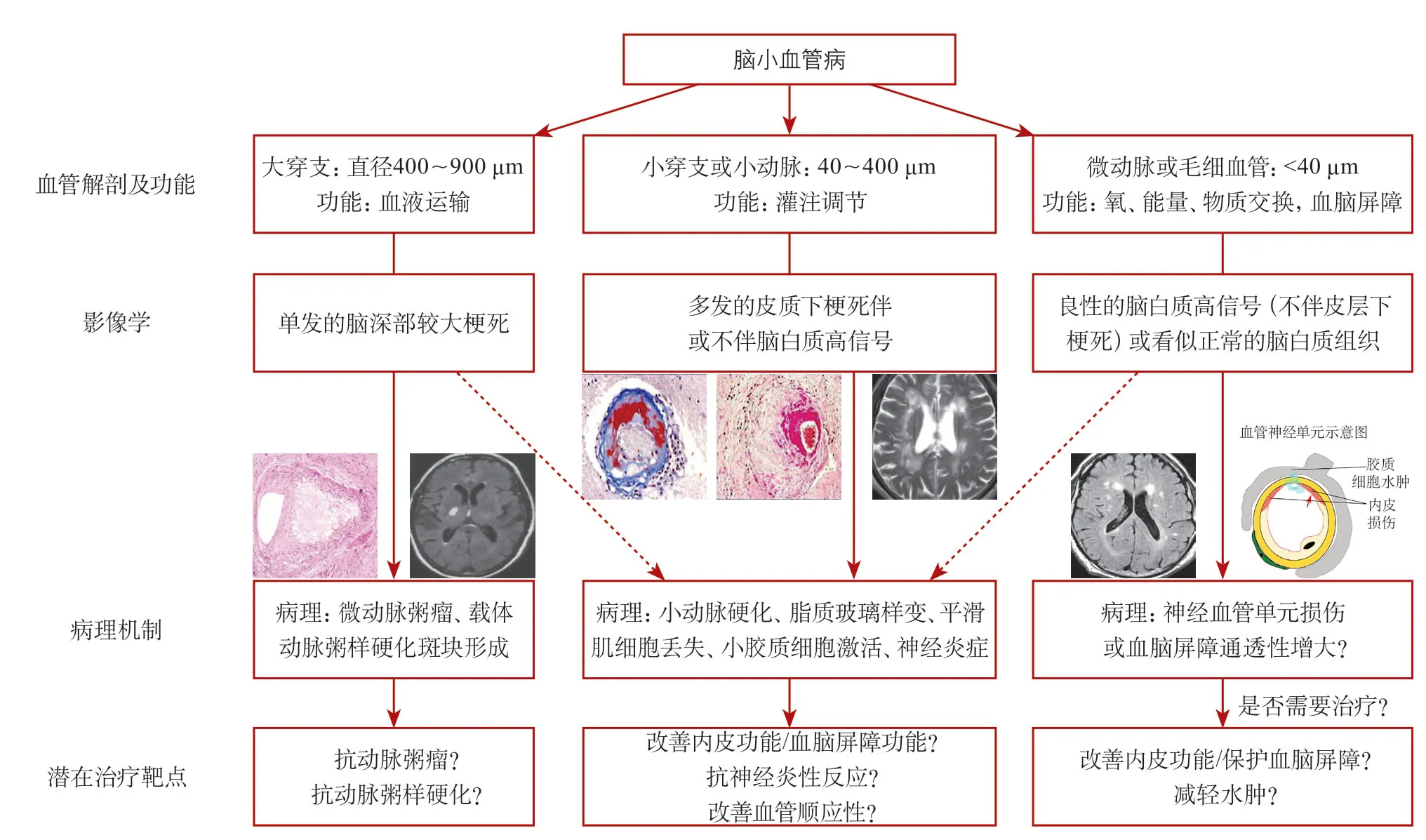
图3 脑小血管病不同影像学改变可能的病理机制及潜在治疗靶点猜想

