黄顶菊对不同入侵地植物群落及土壤微生物群落的影响
祁小旭,张思宇,林 峰,张玲玲,杨殿林,皇甫超河,王 慧,*
1 农业农村部环境保护科研监测所,农业农村部产地环境污染防控重点实验室/天津市农业环境与农产品安全重点实验室,天津 300191 2 沈阳农业大学植物保护学院,沈阳 110866 3 安徽大学资源与环境工程学院,合肥 230000
植物群落、土壤养分、土壤微生物有密不可分的关系。土壤微生物是土壤生态系统的重要组成部分,是土壤养分循环和植物对养分利用过程中重要参与者,对维持土壤肥力和植物的生长有重要的作用[1],因此土壤微生物多样性能够作为生态系统功能的敏感指标,指示生态环境变化和生态系统功能的变化[2]。植物群落的变化将会影响土壤微生物的群落结构和多样性、土壤理化性质(C、N、P)和其他生物学指标[3-5]。外来物种对栖息地的入侵是造成全球生物多样性减少的重要威胁之一。外来物种由于其快速的繁殖能力、较强的化感作用、强的生理生态适应性在入侵地迅速繁殖,形成单一优势种群,减少土著植物的竞争力,从而减少生物多样性、改变土壤微生物的结构和功能多样性、影响区域经济发展和威胁公共健康等。例如:银荆(Acaciadealbata)、豚草(Ambrosiatrifida)等通过自身的化感作用,从而改变土壤微生物的群落结构,使土壤养分向有利于自身生长的方向改变,从而增加自身的竞争能力,改变入侵地的植物群落构成,严重减少当地的物种多样性[6-7]。
黄顶菊(Flaveriabidentis)属菊科(Asteraceae)万寿菊族(Tageteae)黄菊属(Flaveria),一年生恶性杂草,原产于南美洲。2001年首次在我国天津、河北省衡水湖地区被发现,后在河南省、山东省也发现有黄顶菊的生长,于2010年被列入国家环保总局公布的《中国第二批外来入侵物种名单》,后于2013年被列入《国家重点管理外来入侵物种名录(第一批)》[8]。已有研究表明,黄顶菊在入侵过程中对入侵地的养分有较强的利用能力,对盐碱和干旱等胁迫条件有较强的适应能力,通过化感作用对入侵地土著植物产生抑制作用,降低入侵地植物群落多样性[9-10]。黄顶菊入侵还能够改变土壤微生物的群落结构,使入侵地土壤的细菌群落多样性降低,改变入侵地土壤中放线菌和真菌的含量,且随时间的变化而变化,生长前期表现为减少,生长盛期达到峰值后下降,衰老期数量最低[11]。Montserrat等[12]在研究剑叶花属(Carpobrotusspp)和臭椿(Ailanthusaltissima)对不同入侵岛屿的植物群落组成和土壤理化的影响存在地区特异性。以往对黄顶菊入侵地植物群落和土壤微生物群落的研究只关注同一地点,单一的地上部分或地下部分的研究,对于不同纬度入侵地植物群落和土壤微生物群落的综合影响鲜有报道。因此,本研究通过野外调查试验,通过分析4个不同纬度黄顶菊入侵地和非入侵地的植物群落多样性、土壤微生物群落结构、土壤理化性质等的变化,以期探求黄顶菊对不同入侵地植物群落和土壤生态系统的影响规律及相关性。该研究能够丰富黄顶菊的入侵机制,为入侵植物生态控制提供一定的理论依据。
1 材料与方法
1.1 研究区域概况
本试验选取天津市静海县(Jinghai,JH)、河北省沧州市(Cangzhou,CZ)、河北省衡水市(Hengshui,HS)、河南省安阳市(Anyang,AY)4个不同的黄顶菊入侵典型样地作为取样点,各样地概况见表1。

表1 各样地概况Table 1 General situation of study regions
1.2 试验设计与样品采集
于2018年7月30日—8月10日采集四个地区入侵地(invaded)和非入侵地(native)的供试土壤(其中静海、沧州、衡水入侵年限15年以上,安阳入侵年限5年),入侵地和非入侵地中间距离10 m或更少,确保两种土壤主要差异为是否有黄顶菊生长,取样点距离植物群落边缘至少有3 m。每个样地按照S型设置4个样方,每个样方大小1 m×1 m,因此,四个样地中总共划定32个样方。在每一个样方中记录物种数据(即物种名称和株数),物种的命名和本地种/入侵种的定义遵循USDA Plants (USDA NRCS 2017),汇总数据,采用α物种多样性指数[13-14]表示植物群落特征,如下所示:
Simpson 多样性指数:
Ds= 1 -ΣPi2
Shannon-Wiener 多样性指数:
λ= -ΣPilnPi
Pielou 均匀度指数:
E= (-ΣPilnPi)/lnS
Margalef 丰富度指数:
D=(S-1)/lnN
式中,S是一个种植小区内的物种数,Pi是某一个物种的相对丰度,N为个体总数。
在每个样方中用直径5 cm的土钻按照梅花五点取样法收集土壤,每个小区内选取5个取样点,入侵地和非入侵地每个取样样方土样单独混匀,取样深度20 cm,在取样前去除地面植物和凋落物等有机杂质,装入冰盒并保持冰盒内温度4℃条件下带回实验室,用于土壤理化、土壤微生物的测定。
1.3 土壤理化性质的测定
土壤有机质测定采用重铬酸钾-浓硫酸外加热氧化法;土壤全氮采用浓硫酸消煮法,之后采用流动分析仪(AA3,Bran+Luebbe Crop,德国)测定;土壤硝态氮、土壤铵态氮采用氯化钙浸提法,之后采用流动分析仪测定,土壤全磷采用钼锑抗比色法;土壤pH采用玻璃电极法(MP511 pH计)按土水比 1∶2.5 测定。
1.4 土壤微生物的测定
采用PLFA法测定土壤中的土壤微生物群落结构。称取 3 g 冷冻干燥的土壤样品于50 mL特氟隆离心管中,单相提取剂(氯仿∶甲醇∶柠檬酸比为1∶2∶0.8)提取总脂,经 SPE 柱收集磷脂,磷脂通过温和碱性甲酯化为磷脂脂肪酸甲酯,加入十九烷酸甲酯(19:0)用安捷伦气相色谱-质谱仪联用 GC-MC(6890-5973N)分析磷脂脂肪酸的种类及含量[15]。磷脂脂肪酸的命名采用Frostegard等[16]方法命名,PLFA 含量用nmol/g表示,PLFA的生物表征见表2[17-18]。并计算真菌/细菌、革兰氏阴性菌/革兰氏阳性菌、微生物群落多样性指数[12-13]等指标。
1.5 数据分析
试验数据用SPSS 21.0 软件处理,对入侵地和非入侵地的植物群落多样性指数和微生物群落多样性指数(Patrick丰富度指数、Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数)、微生物类群(真菌、总PLFA、真菌/细菌、革兰氏阴性菌/革兰氏阳性菌)等差异显著性分析采用独立样本t检验,差异显著性水平设为α=0.05,用相关性分析分析植物群落多样性与微生物群落多样性的相关关系,用冗余分析植物群落和土壤微生物群落结构与土壤理化的相关关系,用SPSS 21.0和Canoco5.0分析,结果图表用OriginPro 9.1、WPS Excel 2019绘制,数据为平均值±标准误。

表2 PLFAs生物表征Table 2 PLFAs characterizing microbes
2 结果与分析
2.1 黄顶菊入侵对不同地区植物群落多样性的影响
JH、CZ、HS、AY入侵地和非入侵地植物物种组成见表3。由图1可以看出,黄顶菊入侵改变入侵地的植物群落多样性,但对不同地区的影响不同。黄顶菊入侵显著降低了JH、CZ、HS三个地区的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数和Margalef丰富度指数(P<0.05),HS地区四个多样性指数的减少程度最大,安阳地区的影响没有显著差异(P>0.05)。
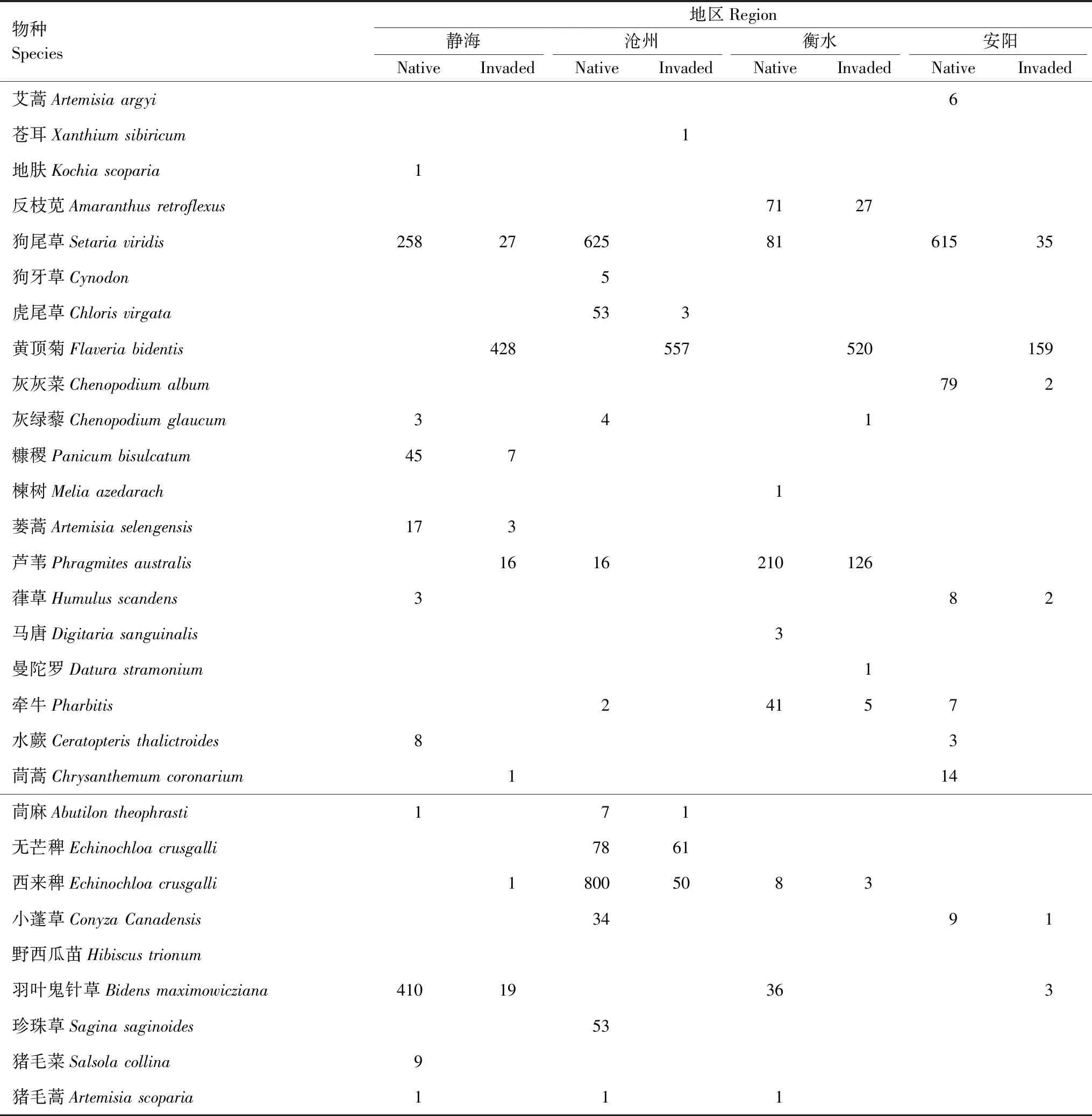
表3 不同地区植物物种组成Table 3 Plant composition in different region
表中数据为不同地区各样地类型中每个物种总株数
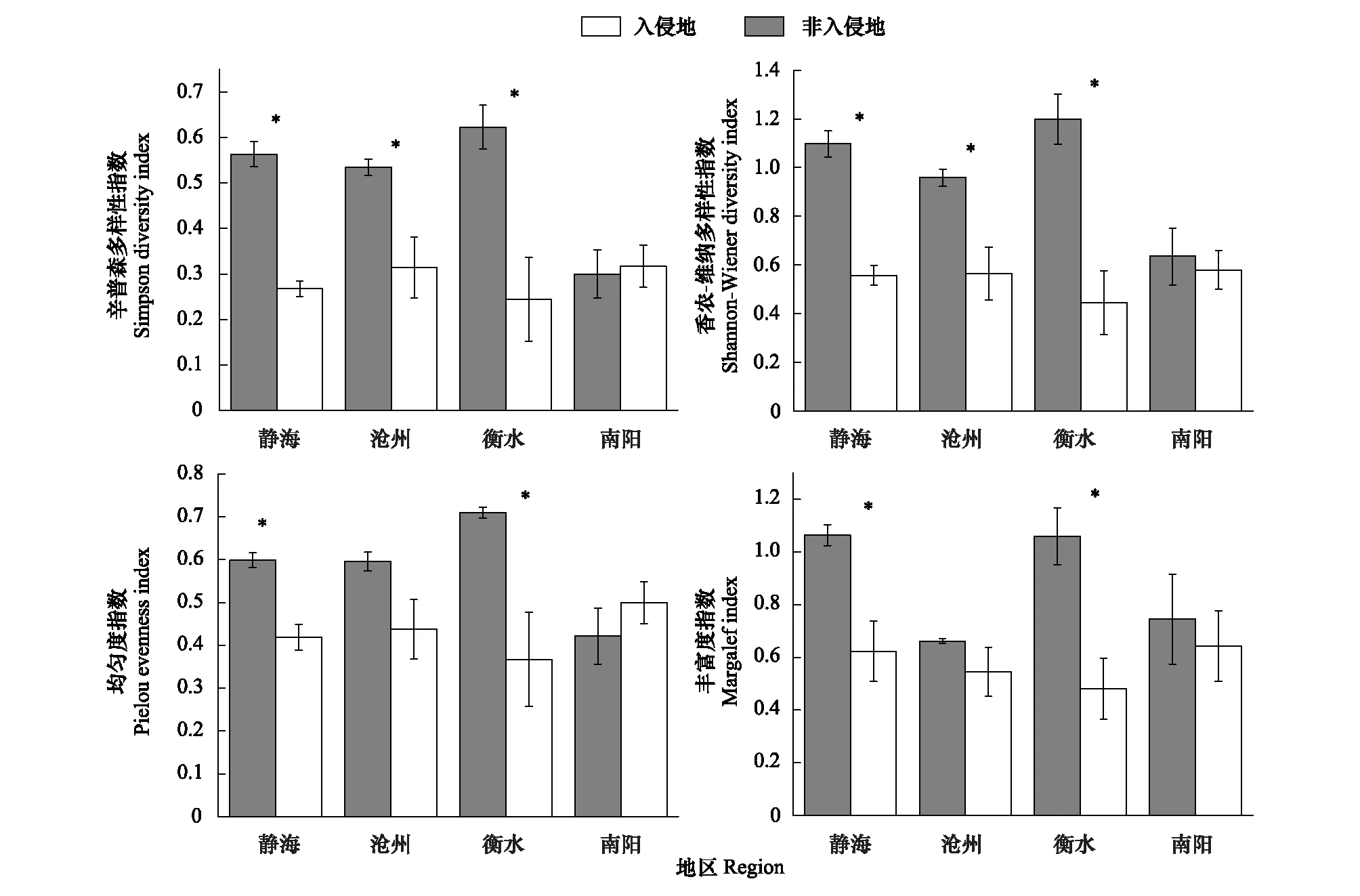
图1 黄顶菊入侵对不同地区植物群落多样性的影响Fig.1 The effect of Flaveria bidentis invasion on plant community variables of different region其中标*为不同处理达到显著性差异(P<0.05)
2.2 黄顶菊入侵对不同地区土壤理化性质的影响
黄顶菊入侵显著改变了四个地区的土壤理化性质(表4),但存在地区差异。黄顶菊入侵显著增加了四个地区的铵态氮和有机质含量(P<0.05),显著降低了全磷的含量(P<0.05),例如:JH地区的铵态氮含量从4.1mg/kg升高到了5.07 mg/kg,升高了23.7%,CZ地区的铵态氮含量从2.2 mg/kg升高到了3.25 mg/kg,升高了47.7%。JH、CZ、AY三个地区的硝态氮含量显著增高(P<0.05),而HS地区可能由于本地土壤的硝态氮含量较高,因此显著降低(P<0.05),JH、CZ地区的全氮含量显著增加、pH显著降低(P<0.05),而HS、AY两地区的全氮含量和pH的变化规律与前两个地区相反,全氮含量显著减少、pH显著增加(P<0.05)。
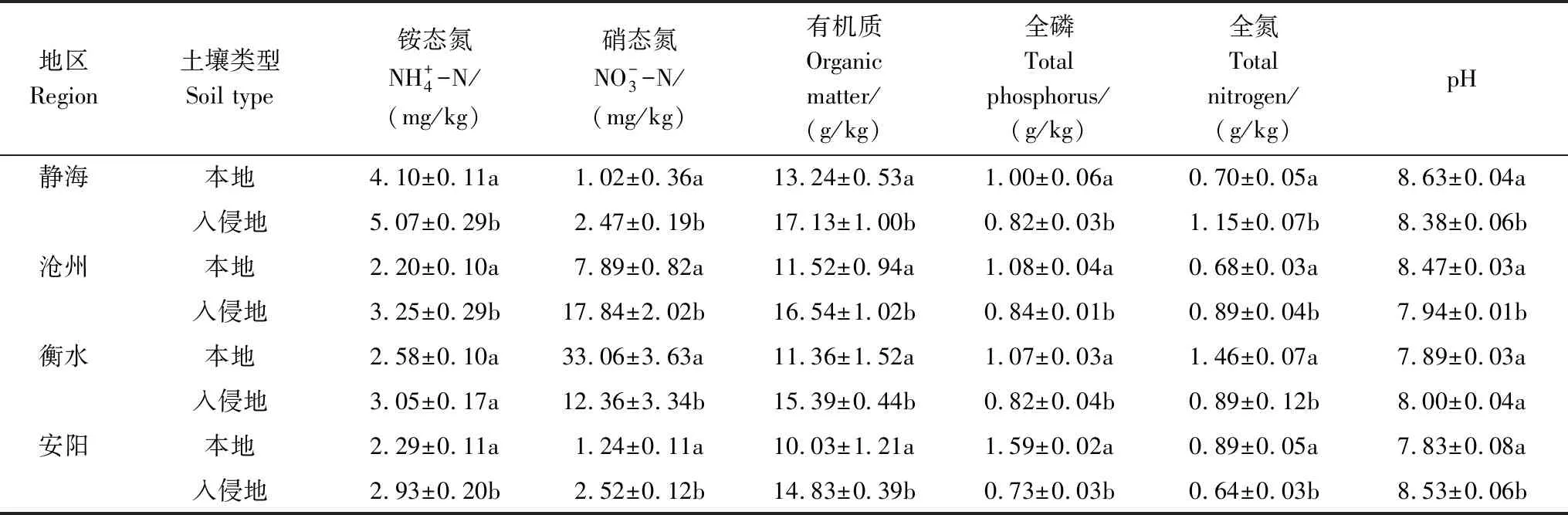
表4 黄顶菊入侵对不同地区土壤理化性质的影响(平均值±标准误)Table 4 The effect of Flaveria bidentis invasion on soil physical and chemical factors in different region (means±SE)
同一地区同一列中,不同字母表示差异显著(P<0.05)
2.3 黄顶菊入侵对不同地区土壤微生物群落结构特征的影响
黄顶菊提高了4个入侵地区真菌PLFA的含量、总PLFA的含量、真菌/细菌、革兰氏阴性菌/革兰氏阳性菌(图2),JH、CZ、HS、AY地区的真菌PLFA的含量、总PLFA的含量、真菌/细菌、革兰氏阴性菌/革兰氏阳性菌均达到显著性差异(P<0.05),但HS和AY地区的革兰氏阴性菌/革兰氏阳性菌差异不显著显著(P>0.05),但增加量分别达到了37%和54%;由表5可以看出,黄顶菊入侵显著提升了四个地区土壤微生物的Margalef丰富度指数(P<0.05),除HS地区入侵地和非入侵地的Shannon-Wiener 多样性指数、Pielou均匀度指数差异达到显著水平(P<0.05)外,JH、CZ、AY地区的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数差异不显著(P>0.05)。
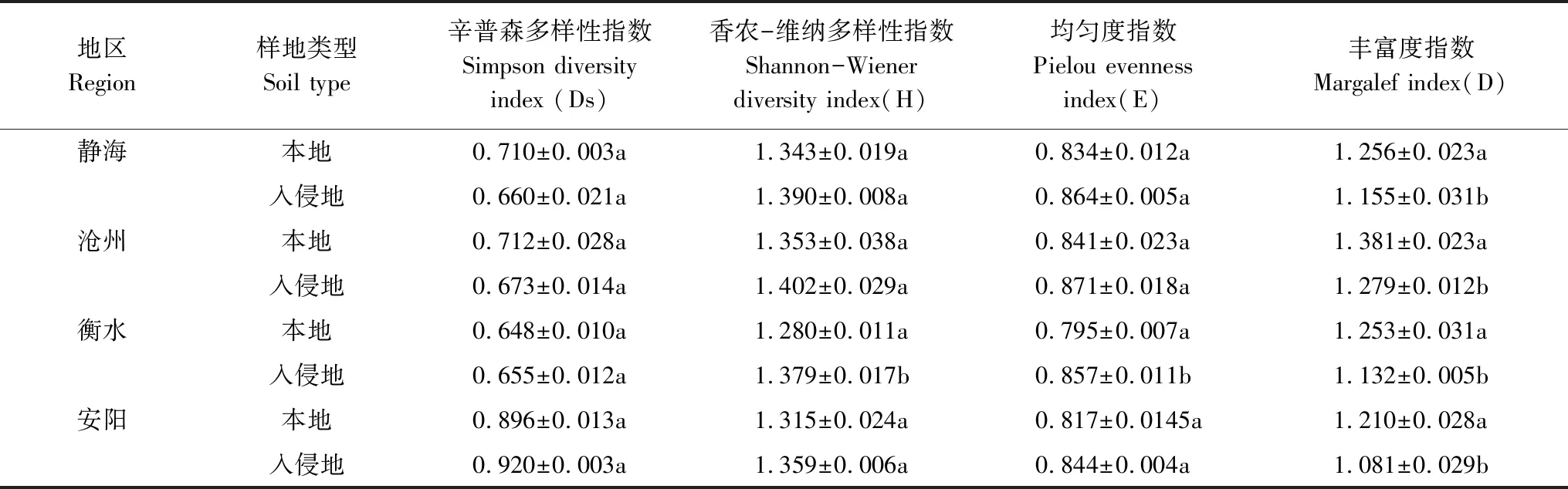
表5 黄顶菊入侵对不同地区土壤微生物群落多样性的影响(平均值±标准误)Table 5 The effect of Flaveria bidentis invasion on soil microbial communities variables in different region (means±SE)
同一地区同一列中,不同字母表示差异显著(P<0.05)
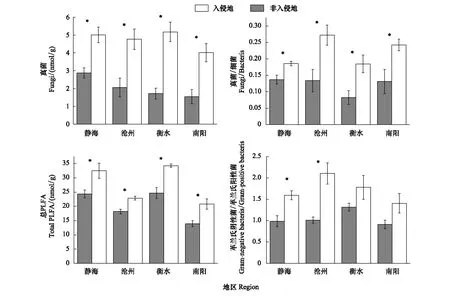
图2 黄顶菊对不同入侵地土壤PLFAs的影响Fig.2 The effect of Flaveria bidentis invasion on soil PLFAs of different region其中标*为不同处理达到显著性差异(P<0.05)
2.4 土壤理化、土壤微生物群落、植物群落的相关性分析
对土壤理化和植物群落多样性指数进行冗余分析可知(图3A),排序轴1明显区分了黄顶菊入侵地和非入侵地的植物群落多样性指数、土壤理化性质、土壤微生物群落结构,CCA1和CCA2解释了排序轴变异的38.1%和6.8%,其中,硝态氮、全氮的含量对植物群落的影响较大;对土壤理化和土壤PLFAs进行冗余分析可知(图3B),CCA1和CCA2解释了排序轴变异的45.4%和8.7%,其中,铵态氮的含量对土壤微生物群落结构的影响较大。
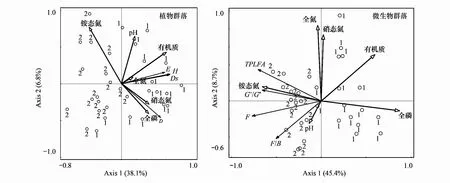
图3 土壤理化与植物群落多样性指数和土壤微生物群落的相关关系 Fig.3 The correlation between soil physical and chemical factors wth plant communities diversity indices or soil microbial community
对植物群落多样性与土壤微生物群落多样性进行相关性分析可知(表6),植物群落的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数与土壤微生物群落的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数有显著的负相关关系(P<0.05),而丰富度指数没有显著相关关系。
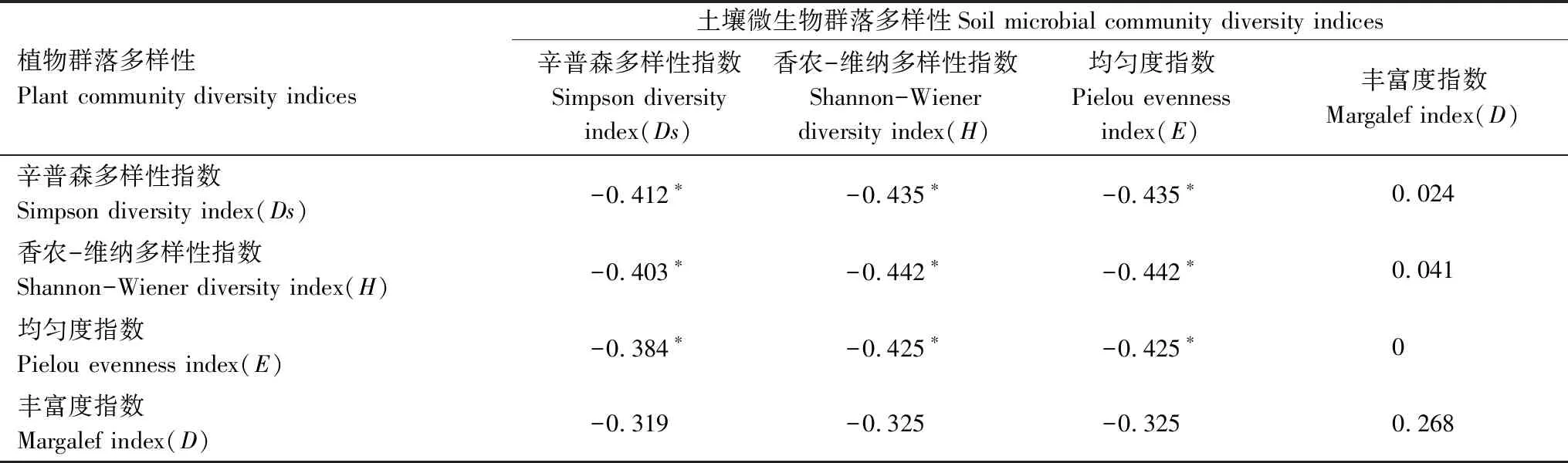
表6 土壤微生物群落多样性与植物群落多样性相关性分析Table 6 The correlation analysis between soil microbial community diversity indices and plant community diversity indices
3 讨论
外来植物入侵能够改变自然群落生态系统基本生物学特征[14,19],降低入侵地植物群落的丰富度和多样性,改变入侵地的土壤养分[11],外来植物的入侵过程与土壤微生物群落和植物群落的反馈变化密切相关,这一过程可以提高入侵生物在新生态系统中成功定植的可能性[20],研究土壤微生物群落特征与植物群落和土壤理化因子的相关性是揭示黄顶菊入侵机制的重要途径。本文研究了黄顶菊入侵对4个不同地区植物群落、土壤理化性质、土壤微生物群落特征的影响,结果表明:黄顶菊入侵改变了入侵地的植物群落特征,减少了入侵地植物群落的多样性指数;改变了入侵地的理化性质;改变了土壤微生物的群落结构特征,但存在地区差异。
3.1 黄顶菊入侵对不同地区植物群落多样性的影响
“天敌逃逸假说[21]”和“增强竞争力假说[22]”认为入侵植物在新的生境中由于缺少原有生境的竞争对象(病原菌、取食对象),在新的生境中可以不受控制的增长,竞争入侵地光资源和土壤养分,促使入侵植物形成单一优势群落,从而减少入侵地的植物群落多样性。Wang等在研究加拿大一枝黄花(SolidagocanadensisL.)的入侵影响中表明[20],加拿大一枝黄花对入侵地的植物群落的影响随入侵程度的变化而不同,对中度和重度入侵地的植物群落多样性影响较大,对轻度入侵地植物群落多样性的影响不大;李会娜等[23]研究表明,黄顶菊分别与马唐和小藜混合种植时,混合种植马唐的生物量是马唐单独种植的61%,抑制了马唐的生长,且显著抑制了小藜的生长。本研究结果表明(图1):黄顶菊入侵显著减少了JH、CZ、HS三个地区的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数和Margalef丰富度指数(P<0.05),HS地区四个多样性指数的减少程度最大,对AY地区的影响没有显著差异(P>0.05)。黄顶菊由于在入侵地缺少原生境竞争对象,对资源的利用能力较强,有利于自身的生长发育,从而增强自身对入侵地土著植物的竞争力,且黄顶菊出苗期较早,且植株高大,对入侵地土著植株产生荫蔽作用,使土著植物所获得的光资源减少,从而减少入侵地植物群落的多样性;HS地区入侵地植物群落多样性指数较非入侵地较少程度最大,可能是由于HS地区硝态氮含量较高(表4),有利于黄顶菊的生长,因此黄顶菊物种优势度较高,对土著植物的竞争力较强所致;AY地区由于入侵年限较短,对入侵地植物群落的影响不明显,也可能是安阳地区纬度较低,土著植物可获取的光资源较JH、CZ、HS地区更为较为丰富,物种丰富度较高,对黄顶菊入侵的抵御能力较强所致。
3.2 黄顶菊对不同入侵地土壤理化性质的影响
土壤养分是维持植物生长的重要条件,不同植物对养分的利用也不尽相同,有研究表明[24-25],入侵植物通过对土壤养分的选择性或化感作用等方式对土壤理化特性产生影响,而这种影响又有利于入侵植物的生长,从而增加入侵植物在入侵地的优势度,有利于入侵植物的进一步入侵,但Dassonville、Santoro等[26-27]的研究表明,同种植物对不同地域入侵后,对入侵地营养成分的改变不尽相同。本研究中(表4),黄顶菊入侵显著增加了四个地区的铵态氮和有机质含量(P<0.05),JH、CZ、AY三个地区的硝态氮含量显著高于非入侵地(P<0.05),而HS地区的硝态氮含量显著低于非入侵地(P<0.05),有研究表明[28-29],入侵植物通过增加入侵地速效氮、有机质的含量增加入侵植物的相对竞争力,黄顶菊入侵后通过提高铵态氮、硝态氮和有机质的含量,促进自身形成单一优势群落,增加自身的竞争力;而HS地区的硝态氮含量减少可能是由于本地土壤硝态氮含量较高,黄顶菊对硝态氮的吸收增强,从而导致硝态氮含量减少。JH、CZ地区的全氮含量显著增加、pH显著降低(P<0.05),而HS、AY两地区的全氮含量和pH的变化规律与前两个地区相反,全氮含量显著减少、pH显著升高(P<0.05),说明黄顶菊对土壤养分的利用与土壤本底养分有关(静海和沧州地区的全氮含量较低,pH较高),对入侵地养分的利用有均一化的特点[30],且有一定的地域特异性。
3.3 黄顶菊入侵对不同地取区土壤微生物群落结构特征的影响
土壤微生物在植物生长发育过程中有重要的作用,外来植物在入侵过程中会改变原有生境的土壤微生物群落结构和多样性,打破入侵地的土壤生态平衡,影响入侵地植物群落的生长和群落更替,使外来植物实现进一步的入侵[31-32]。郑洁等[33]在研究互花米草(Spartinaalterniflora)的入侵过程中发现,互花米草改变了入侵地的土壤微生物群落特征,显著提高了土壤中革兰氏阳性细菌、真菌的含量,降低了革兰氏阴性细菌、放线菌的含量,降低了土壤微生物群落多样性指数,从而有利于互花米草的生长,进而实现进一步入侵。李会娜[23]等的研究表明,黄顶菊入侵区域在黄顶菊生长盛期增加了真菌和放线菌的含量,细菌的含量在整个生育期内处于绝对优势地位。本研究结果表明:黄顶菊显著增加了JH、CZ、HS、AY地区的真菌PLFA的含量、总PLFA的含量、真菌/细菌、革兰氏阴性菌/革兰氏阳性菌(P<0.05)(图2),此部分结果和李会娜等的研究结果一致;显著降低了四个地区土壤微生物群落的Margalef丰富度指数(P<0.05)(表5)。有研究表明[34]土壤中氮含量的增加可以增加土壤中真菌的数量,因此本研究中四个地区土壤真菌PLFA含量的增加可能是由于黄顶菊增加了入侵地土壤氮含量所致,从而导致总PLFA含量和真菌/细菌的增加;革兰氏阴性菌/革兰氏阳性菌表征土壤的营养状况,其值越高表征土壤中受到营养胁迫越小[34],本研究中黄顶菊入侵显著增加了革兰氏阴性菌/革兰氏阳性菌,说明黄顶菊入侵地受到的营养胁迫较小,通过土壤理化的变化可知(表4),黄顶菊增加了入侵地的铵态氮含量,而这铵态氮是土壤营养的主要组成部分,因此增加了入侵地的营养成分,从而较少了入侵地的营养胁迫。利用PLFA法表征土壤微生物群落多样性指数Margalef丰富度指数随总PLFA的升高而降低,黄顶菊入侵地土壤微生物群落Margalef丰富度指数的减少主要是由于土壤总PLFA的升高所致。
3.4 土壤理化、土壤微生物群落、植物群落的相关性分析
土壤理化性质与植物群落和土壤微生物群落结构有重要的关系,土壤理化的性质的改变会影响植物的生长状况和土壤微生物群落的结构组成[1],由冗余分析(图3)可知,排序轴1明显区分了黄顶菊入侵地和非入侵地的植物群落多样性指数、土壤理化性质、土壤微生物群落结构,说明黄顶菊对入侵地的植物群落多样性指数、土壤理化性质、土壤微生物群落结构产生了较大的影响,对土壤理化和植物群落多样性指数进行冗余分析可知,硝态氮、全氮的含量对植物群落的影响较大;对土壤理化和土壤PLFAs进行冗余分析可知铵态氮的含量对土壤微生物群落结构的影响较大,而硝态氮、铵态氮、全氮是土壤营养成分的重要组成部分,说明黄顶菊入侵主要改变入侵地土壤的氮营养水平,从而对入侵地的植物群落和土壤微生物群落产生进一步影响;由植物群落多样性与土壤微生物群落多样性的相关性分析可知(表6),植物群落的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数与土壤微生物群落的Simpson 多样性指数、Shannon-Wiener 多样性指数、Pielou均匀度指数有显著的负相关关系(P<0.05),说明硝态氮、铵态氮、全氮含量的变化,改变了土壤真菌含量和某些细菌含量(革兰氏阴性菌、革兰氏阳性菌等)的变化,影响土壤微生物群落结构和多样性的变化,从而有利于黄顶菊在入侵地的生长,进而影响入侵地植物群落多样性的变化。
综上所述,本文选取4个黄顶菊入侵地从植物群落多样性和土壤微生物群落方面研究了黄顶菊入侵对入侵地群落结构和土壤生态系统的影响,结果表明黄顶菊显著改变了四个入侵地的土壤理化性质,从而改变土壤微生物群落结构和多样性,有利于黄顶菊的生长,促使其形成优势群落,影响入侵地土著植物区的生长,进而影响入侵地植物群落多样性的变化,但对不同地区的影响存在地区差异,本研究丰富了黄顶菊对入侵地土壤生态系统的影响机制,为理解入侵种对群落结构和土壤生态系统的影响提供理论依据。本研究采用的土壤微生物分析方法为PLFA法,不能分析土壤微生物的种群和数量,需要采用更为先进的土壤微生物分析方法,如高通量测序、同位素示踪技术等,且本研究为一年的研究,不同年份的环境变化可能对研究结果产生影响,因此要深入研究黄顶菊的入侵机制,还需要做长期的监测研究。

