早期直肠癌内镜下黏膜剥离术与经肛门内镜微创手术的临床效果对比
李青科 何立芳 梁 磊 韩龙才 马国明 刘远廷▲ 王志武
1.河北省唐山市人民医院胃肠外科,河北唐山 063000;2.河北省唐山市人民医院肾内科,河北唐山 063000;3.河北省唐山市人民医院放化疗一科,河北唐山 063000
随着经济的发展,人民生活水平的提高,高脂饮食、肥胖等情况日渐增加,工作及生活压力越来越大,直肠癌的发病率也随之增加[1-2]。而随着结肠镜筛查的普及,早期直肠癌的发现率也随之增加。早期直肠癌患者5 年总生存率约为81.2%[3]。随着患者预后的改善,患者对治疗后生活质量的追求日渐强烈,保肛、微创的需求也越来越高,因此,越来越多的微创治疗方式应运而生。其中经肛门镜微创手术(transanal endoscopic microsurgery,TEM)和内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)均常用于治疗局限在黏膜层及黏膜下层的早期结直肠肿瘤患者,因此本研究对两种治疗方式进行了对比分析,对其优缺点进行了分析。
1 资料与方法
1.1 一般资料
选取2010 年5 月—2016 年5 月河北省唐山市人民医院(以下简称“我院”)就诊早期结直肠肿瘤患者。纳入经肠镜检查取得病理并经超声内镜检查明确肿瘤分期为uTis-uT1,经盆腔MRI 除外直肠局部淋巴结转移,经胸腹部断层扫描除外远处转移;排除严重的多脏器功能疾病者。最终纳入研究对象211 例,按治疗方式分为ESD 组(98 例)和TEM 组(113 例)。本研究经我院医学伦理委员会批准。
1.2 方法
TEM 主要由德国进口肛门镜(STORZ)手术系统设备,包括肛门镜及腔镜显像系统和操作器械。ESD设备有奥林巴斯电子肠镜(GIF-H260)、Dual 刀(KD-650L)、高频治疗钳(FD-410LR)、爱尔博高频电装置(200D)、喷洒管(威尔逊WF 型)、医用透明质酸钠凝胶;亚甲蓝注射液(济川药业;生产批号:1807112);去甲肾上腺素(天津金耀药业;生产批号:2003121)。
做好充分肠道准备,由我院内镜中心高年资医师对ESD 组患者进行治疗,胃肠外科高年资医师对TEM组患者进行治疗。ESD 操作步骤:①明确病变范围并标记;②Dual 刀于病变外缘0.5~1.0 cm 处环周标记;③在标记点外侧黏膜下多点注射含0.2%靛胭脂和0.1%肾上腺素的甘油果糖使病变区域隆起,黏膜层与肌层分开;④自病变边缘标记点外周切开黏膜,沿间隙逐层剥离,并及时止血;⑤标本置于10%福尔马林溶液中保存并送病理。TEM 操作步骤:①直肠前壁肿瘤患者取折刀位,余取截石位;②全麻成功后常规消毒、铺单;③轻柔扩肛后自肛门置入TEM 直肠镜,调节位置并固定,连接各种线路后向直肠腔内注入CO2气体,气压保持在12~15 mmHg(1 mmHg=0.133 kPa);④从直肠镜后面板插入针形电刀和组织钳,在瘤体的四周用电刀电凝出切除的标记线,切线应距肿瘤边缘1.0 cm 以外,手术从瘤体的右侧缘切开黏膜直至肠壁外脂肪层,用组织钳轻轻牵起切开的瘤体侧,然后沿标记线将瘤体包括整块肠壁完整切除;⑤取出标本后,可吸收滑线将直肠创面作横向行进的连续缝合。
1.3 观察指标
收集患者的年龄、性别,病灶性状(肿瘤直径、距肛缘距离)。比较两种手术方式的手术时间、住院时间、术中出血、肿瘤完整切除、肿瘤残留及复发例数;术后出血、穿孔、梗阻、狭窄等并发症发生情况。
1.4 统计学方法
采用SPSS 23.0 统计学软件进行数据分析,计量资料用均数±标准差(±s)表示,两组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组性别、年龄、肿瘤距肛门、肿瘤大小比较,差异无统计学意义(P >0.05),具有可比性。见表1。
表1 两组一般情况比较(±s)
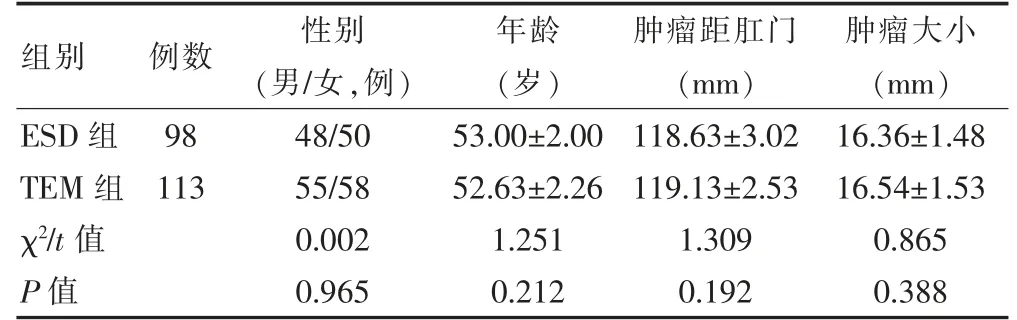
表1 两组一般情况比较(±s)
注:ESD:内镜黏膜下剥离术;TEM:经肛门镜微创手术
2.2 两组手术情况比较
ESD 组手术时间、住院时间短于TEM组,差异有高度统计学意义(P <0.01);两组术中出血、肿瘤完整切除率、肿瘤残留率及复发率比较,差异无统计学意义(P >0.05)。见表2。
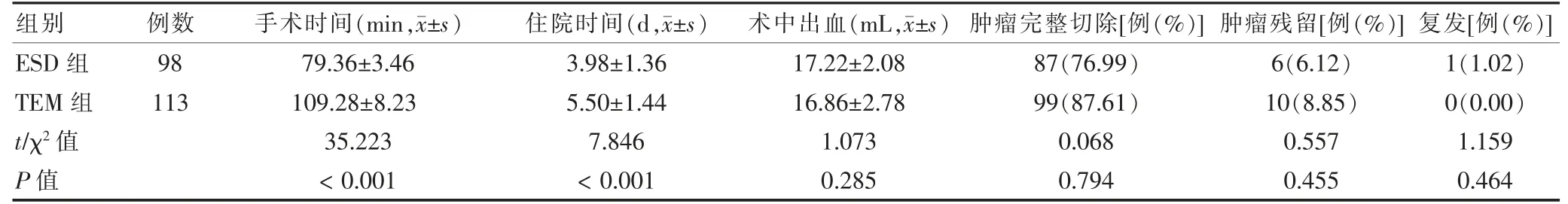
表2 两组手术情况比较
2.3 两组患者术后出现并发症例数比较
两组并发症发生率比较,差异无统计学意义(P >0.05)。见表3。
3 讨论
全球结直肠肿瘤的患病率及死亡率均逐年增高[4],仅次于肺癌、胃癌及食道癌,已经成为危及人类生命的第四大恶性肿瘤[5],早期结直肠癌是指肿瘤组织局限在黏膜或黏膜下层,不论有无淋巴结转移。随着电子结肠镜的普及,国家对癌症早期筛查项目的扩展,以及人民健康意识的提高,早期结直肠癌的诊出率逐年增高[6]。Lee 等[7]认为对于早期结直肠癌,采取内镜治疗效果基本等同于外科手术治疗,而内镜治疗具有微创、快速康复的优点,越来越被人们所接受[7-8]。本研究对我院应用ESD 和TEM 两种方式治疗早期直肠癌患者进行回顾性对比分析,进一步评估两种术式的有效性和安全性。研究结果发现,ESD 组手术时间、住院时间短于TEM 组(P <0.01);两组患者在肿瘤完整切除率、肿瘤残留率、术中及术后出血、穿孔、狭窄、梗阻、复发等方面比较,差异无统计学意义(P >0.05)。
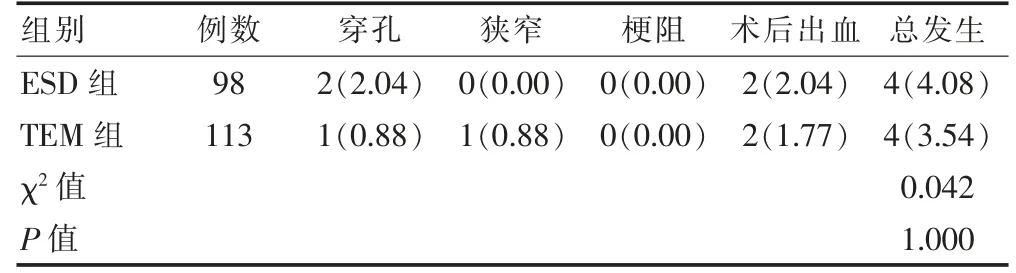
表3 两组患者术后并发症比较[例(%)]
临床上已广泛应用ESD 治疗早期结直肠肿瘤[9]。理论上,对于没有淋巴结、脉管瘤栓的结直肠肿瘤都能够应用ESD 进行治疗。对于早期侵入黏膜下层的深浸润癌(SM2),即术后病理标本黏膜下浸润深度测量>1000 μm 时,目前考虑不是内镜治疗的适应证,应考虑再行外科手术扩大切除范围,而此时可以追加TEM 手术[10]。本研究中也有5 例患者,经TEM 补充后,结局无差异。决定行内窥镜下切除前,需要评估肿瘤直径、预测浸润深度、明确肿瘤组织分化程度。对于局限黏膜下层的浅浸润癌(SM1),ESD 可以实现对病灶的整体切除,所取得的病理标本能够实现准确的诊断和评估,实现日间手术操作,随治随走等优点[11-12]。TEM 通过3D 双眼视和新型直肠镜仪器,可以更好地接近直肠病变组织,近距离观察直肠肿瘤病变并放大手术区域[13]。这样的优势具有对病变部位及其周围组织显露更加清晰,能够实现更加精确的操作,更好地保肛,以及提供更加完整的组织标本便于病理学评估,而这些优势在较高位的直肠肿瘤中表现的更为突出[14]。有文献显示[15-16],TEM 在直肠良性肿瘤和早期直肠癌手术治疗方面提供了比传统的经肛直肠肿瘤局部切除术更优化的病理结果,且并未增加手术并发症。而TEM 对于浸润深度T2、T3的直肠癌高龄患者,心肺功能评估较差,无法耐受经腹或腹腔镜下直肠前切除术的患者可行新辅助放化疗,评估放化疗效果,获得明显降期(T0~1)后采取TEM 行局部全层切除术,对于评估为病理完全缓解(CCR)有主张采取“Watch and wait(观察和等待)”策略,但该策略目前还存在很多争议。而在本研究中发现2 例患者为高龄(≥80 岁)、心肺功能较差,术前盆腔MRI 评估分期分别为cT2N0M0、cT2N1M0,2 例患者均采取新辅助放疗+口服卡培他滨化疗,8 周后再次评估分期为cT0N0M0、cT1N0M0,TEM 行局部全层切除术,术后病理为:ypT0N0M00 期、ypT1N0M01 期,经多次复查均未见复发及转移。
本研究存在一定局限性:①操作人员熟练程度可能对预后有一定影响,操作失败的主要原因就是穿孔、出血和肠瘘,而对于查体时抬举征阴性的患者,除了穿孔的风险较高,还存在较高的病变残留风险[17],在实施有效的ESD 或TEM 过程中要求术者不仅有手术的丰富经验,也需要有扎实的内镜操作水平,因此需要一个重要的学习曲线或临床专业知识积累;②经肛门内镜微创手术的指南包括所有良性病变,组织学良好的T1恶性病变,小于3 cm,没有淋巴结或转移性疾病的放射学证据。组织学良好,低分级,无淋巴血管浸润或肿瘤出芽,边缘清楚[18]。本研究入选标准限制直肠病变的分期是在肠镜病理下确定的,这个与实际选取组织的部位有关,存在局限性。
尽管存在一定局限性,本研究也有优点:本研究收集病例211 例,并在肿瘤完整切除、手术时间、住院时间及术后并发症等方面进行比较,结果显示ESD和TEM 对早期直肠癌的治疗是安全有效的。本研究回顾性对比分析了ESD 与TEM 用于早期直肠癌手术治疗方法的不同,虽然ESD 组手术时间与住院时间均短于TEM,但其可能与TEM 的人群特点、住院需要全身麻醉有关,虽然两组肿瘤完整切除率比较,差异无统计学意义(P >0.05),但TEM 肿瘤完整切除率高于ESD 组。Judd 等[19]和Kim 等[20]认为,考虑到早期直肠癌病变普遍较小,肿瘤相对进展缓慢,建立长期随访的术后病例数据库能便于评估内镜治疗方法的相对有效性,这对于进行前瞻性研究提供了初步理论支持和指导。

