乳源凝固酶阴性金黄色葡萄球菌挥发性代谢特征分析
代义闯,陈娟,谈永萍,胡凯丽,唐俊妮
(西南民族大学生命科学与技术学院,四川成都610041)
乳房炎(mastitis)是奶牛乳腺组织的炎症,可引起组织损伤、纤维化,降低奶产量、奶的品质和营养价值,影响奶制品的加工,是造成奶业经济损失最为严重的疾病[1]。据国际奶牛联合会统计,全世界每年因奶牛乳房炎造成的经济损失高达2000 多亿元[2];我国每年由乳房炎引起奶牛产奶量下降,所造成每头奶牛损失约为1 200 元~3 600 元,每年因乳房炎造成的经济损失在150 亿元~450 亿元[3]。引起奶牛乳房炎的病原微生物达150 多种,但临床上最常见的有20 多种,尤其葡萄球菌(Staphylococci)是最主要的感染病因之一[4-5]。葡萄球菌广泛存在于外界环境中,挤奶员的手、擦洗乳房用的抹布和消毒不严的挤奶杯,是传播该菌的主要媒介。
随着国内对奶牛疾病防控的重视,奶牛乳房炎防控水平提高,致病菌种类和优势菌发生了一定变化[6]。凝固酶阴性葡萄球菌(coagulase-negative Staphylococcus,CNS)引起的隐性乳房炎正处于上升趋势,在国内外均有大量的报道。杨有武[7]对青海地区奶牛乳房炎葡萄球菌的分离鉴定结果发现,CNS 菌检出比例为43.42%。王旭荣等[8]对山西省乳房炎病原菌分离鉴定发现,分离细菌中葡萄球菌属所占比例为7.87%,葡萄球菌中CNS 菌的检出率为71.43%。徐佳[9]对江苏省某奶牛场乳腺炎葡萄球菌的调查结果发现,CNS 菌检出率为73.1%。郝俊玺等[10]对呼伦贝尔高寒地区奶牛乳房炎CNS 菌分离鉴定,分离率为34.5%。CNS 菌为机会致病菌,通过形成生物被膜黏附在挤奶设备、挤奶人员手部和奶牛皮肤上,进而定植在乳腺内造成其广泛传播[11]。由CNS 菌引起的隐性乳房炎具有隐蔽性和持久性的特点,给防治带来的困难更大。因此,能在早期快速地检测凝固酶阴性葡萄球菌,对于奶牛健康状况和奶源质量的监控是十分必要的。
目前,在细菌检测技术中,大多采用的是传统培养法,其耗时周期长、操作过程繁琐复杂;而基于分子生物学的聚合酶链式反应(polymerase chain reaction,PCR)技术成本高、容易出现假阴性和假阳性[12]。随着分析化学技术的进步,寻找各种细菌的特征性代谢产物及代谢产物谱已成为微生物快速检测和鉴定研究的一个重要方向[13]。微生物挥发性代谢产物(microbial volatile organic compounds,MVOCs)是微生物代谢产物的重要组成部分[14-15],也是检测微生物的一种灵敏、特异和新型的生物标记物[16]。Fischer-Tenhagen 等[17]利用警犬可以比较准确地嗅探出金黄色葡萄球菌污染的牛乳,说明受金黄色葡萄球菌污染的牛乳具有独特的气味特征。Hettinga 等[18-19]分析了乳中病原菌的挥发性代谢特征,得出金黄色葡萄球菌和凝固酶阴性葡萄球菌产生特殊的挥发性代谢产物,能与大肠杆菌和链球菌的代谢轮廓进行区分。这些研究涉及葡萄球菌的菌株数量有限,鉴定出葡萄球菌挥发代谢产物种类偏少,不够全面。
研究者所在课题组前期从成都市青白江区散养牛场采集的乳样中分离出大量的凝固酶阴性葡萄球菌,并经分子生物学手段鉴定出CNS 菌中许多为金黄色葡萄球菌,说明凝固酶阴性金黄色葡萄球菌在该地区广泛流行。因此,本研究拟以5 株凝固酶阴性金黄色葡萄球菌分离菌株为对象,在胰蛋白胨大豆肉汤(tryptic soy broth,TSB)和牛乳中分析不同菌株挥发性代谢产物类型和典型代谢产物的峰强度变化规律,为建立基于挥发性代谢特征快速检测牛乳中金黄色葡萄球菌的新方法提供数据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
金黄色葡萄球菌标准菌株CMCC43300:中国医学细菌保藏管理中心;5 株凝固酶阴性金黄色葡萄球菌菌株编号31B、777H、0250H、S12-1 和S2-2,分离于成都市青白江区散养牛场的牛乳,由西南民族大学食品安全与食品微生物实验室保存。
1.1.2 主要试剂
胰蛋白胨大豆肉汤(tryptone soy broth,TSB)培养基、Baird-Parker(BP)琼脂基础、亚碲酸盐卵黄增菌液:青岛高科园海博生物技术有限公司;蒙牛纯牛奶:市售;氯化钠:成都市科隆化学品有限公司;2×PCR Master Mix、DL 2000 DNA Marker:北京擎科新业生物技术有限公司;TE 缓冲液(10 mmol/L Tris-HCl,1 mmol/L pH 8.0 乙二胺四乙酸二钠盐):大连TaKaRa 公司;所有试剂均为分析纯。
1.2 仪器与设备
热电气相色谱/质谱联用仪(gas chromatography/mass spectrometer,GC/MS)[配置Triplus 自动进样器,碳分子筛/二乙基苯/聚二甲基硅氧烷(carboxen/divinylbenzene/polydimethylsiloxane,DVB/CAR/PDMS)萃取头(50/30 μm)]:美国Supelco 公司;MOF-4086S 低温冰箱、MLS-3020 高压蒸汽灭菌锅:日本三洋公司;SW-CJ-1F 超净工作台:苏州安泰空气技术有限公司;DHG-9203A 电热恒温鼓风干燥箱:上海一恒科技有限公司;DHP-9162D 电热恒温培养箱:上海齐欣科学仪器有限公司;ZWY-100H 恒温振荡培养箱:上海智城分析仪器制造有限公司;DYY-12 型电泳仪:北京市六一仪器厂;PCR 扩增仪:四川新科仪器有限公司。
1.3 方法
1.3.1 分离菌株的鉴定
1.3.1.1 PCR 鉴定
微波法[20]提取5 株分离菌株的基因组DNA,用葡萄球菌16S rRNA 特异性引物(Staphylococci 16S rRNA)和金黄色葡萄球菌16S rRNA 特异性引物(Staphylococcus aureus 16S rRNA)对其进行PCR 扩增,PCR 引物序列及退火温度详见表1。PCR 反应体系为:2×TSINGKE Master mix 10 μL,上下游引物各0.4 μL,其余由去离子水补齐至20 μL。
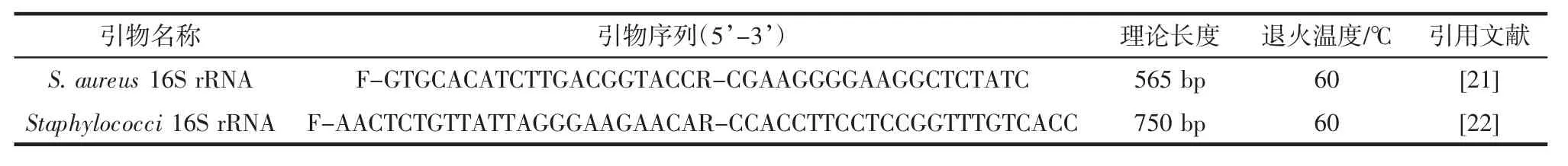
表1 引物序列和退火温度Table 1 Primer sequences and annealing temperatures
1.3.1.2 血浆凝固酶试验
将保藏菌液划线至Baird-Parker 平板,于37 ℃恒温培养18 h。待长出典型菌落,分别挑取菌落至5 mL TSB 中,于37 ℃、200 r/min 振荡培养18 h。
吸取7×0.5 mL 新鲜兔血浆至小试管中,再分别加入0.3 mL TSB 培养物,置于37 ℃恒温培养,每隔0.5 h观察一次并记录,连续观察6 h。如果呈现凝固(即将试管倾斜或倒置时,呈现凝块)或凝固体积大于原体积的一半,则视为阳性结果,同时以血浆凝固酶试验阳性菌CMCC43300 和无菌生理盐水分别作为阳性对照和阴性对照。
1.3.2 菌株挥发性代谢产物分析
1.3.2.1 细菌新鲜培养物制备
吸取凝固酶阴性金黄色葡萄球菌冷冻保藏菌液50 μL 接种入5 mL TSB 培养基中,于37 ℃,200 r/min条件下培养13 h,将菌液划线于BP 固体培养基上,37 ℃下培养24 h。挑取具有典型特征的单菌落接入5 mL TSB 培养基中,于37 ℃,200 r/min 条件下培养13 h,作为细菌新鲜培养物。
1.3.2.2 样品制备
将凝固酶阴性金黄色葡萄球菌的新鲜培养物进行梯度稀释至10-4,吸取10-4菌悬液200 μL 分别接入350 mL TSB 和牛乳中,使初始接种量为100 cfu/mL~200 cfu/mL,于37 ℃下,200 r/min 振荡培养,培养至12、16、20、24 h 各吸取5 mL 培养物转入20 mL 顶空瓶内,加入2 g 氯化钠,加盖密封,每个时间点取3 个平行样品,同时取3 个空白培养基作为对照样品。
1.3.2.3 挥发性代谢产物测定
1)萃取条件
采用50/30 μm DVB/CAR/PDMS 萃取头,在80 ℃预孵化30 min,萃取10 min。
2)气相色谱分析条件
TR-FFAP 色谱柱(30 m×0.25 mm×0.25 μm);分流模式,分流比为20 ∶1;流速1 mL/min;升温程序:40 ℃保持3 min,以7 ℃/min 升温至220 ℃并保持2 min;载气为99.999%氦气;进样口温度230 ℃;解吸时间2 min。
3)质谱分析条件
电子电离源,电子能量70 eV;离子源温度250 ℃;传输线温度220 ℃;全扫描模式,质量扫描范围30 amu~550 amu。
1.4 数据定性与定量分析
质谱结果经计算机自动检索(NIST 08)进行定性分析,同时由Xcalibur 软件系统完成手动对照检索,要求正向反向匹配因子均大于750。以化合物的特征离子为依据,采用提取特征离子流模式报告挥发性代谢产物的峰面积,作为峰信号响应强度。每个取样时间点的峰信号强度为3 个平行样品的平均值扣除空白培养基质的本底值。
2 结果与分析
2.1 分离菌株PCR 鉴定结果和血浆凝固酶试验结果
葡萄球菌16S rRNA PCR 扩增产物电泳图见图1,金黄色葡萄球菌-16S rRNA PCR 扩增产物电泳图见图2,血浆凝固酶试验结果见表2。

图1 葡萄球菌16S rRNA PCR 扩增产物电泳图Fig.1 Electrophoresis map of Staphylococci 16S rRNA PCR amplification products

图2 金黄色葡萄球菌-16S rRNA PCR 扩增产物电泳图Fig.2 Electrophoresis map of S.aureus 16S rRNA PCR amplification products

表2 血浆凝固酶试验结果Table 2 Results of coagulase test
由图1 和图2 可知,5 株分离菌株的基因组DNA都能扩增出葡萄球菌属16S rRNA 特异性条带和金黄色葡萄球菌16S rRNA 特异性条带,表明这些菌株都为葡萄球菌,并且都为金黄色葡萄球菌。由表2 的血浆凝固酶试验结果可得,这5 株分离菌株均为血浆凝固酶阴性菌株。
2.2 TSB 中5 株凝固酶阴性金黄色葡萄球菌挥发性代谢产物类型和强度分析
在TSB 培养基中,对16 h 培养物检出的物质类型进行统计,5 株凝固酶阴性金黄色葡萄球菌总计检出33 个挥发性代谢产物详见表3,包括醇类6 个、酸类2 个、醛类8 个、酮类7 个、酯类4 个、硫化物1 个、苯环类3 个、含氮化合物2 个。菌株31B 检出醇类3 个、酸类2 个、醛类4 个、酮类4 个、酯类1 个、苯环类1 个;菌株0250H 检出醇类4 个、酸类2 个、醛类4 个、酮类4 个、硫化物1 个、苯环类3 个;菌株777H 检出醇类2 个、酸类2 个、醛类4 个、酮类4 个、酯类1 个、苯环类2 个、含氮化合物2 个;菌株S12-1 检出醇类4 个、酸类2 个、醛类6 个、酮类2 个、酯类2 个、硫化物1 个、苯环类2 个;菌株S2-2 检出醇类3 个、酸类2 个、醛类5 个、酮类3 个、酯类1 个、苯环类2 个、含氮化合物1 个。另外,菌株检出的3-甲基-丁醛、苯甲醛、苯乙醛、丙酮、3-苯基-呋喃和2,4-双(1,1-二甲基乙基)-苯酚的相对百分含量与TSB 空白基质相近或低于TSB 空白基质,说明菌株没有产生这些物质。5 株菌共同检出了1-丁醇、乙酸、3-甲基-丁酸和2-丁酮,TSB 空白没有这些物质,可认为是凝固酶阴性金黄色葡萄球菌在TSB 中典型的挥发性代谢产物。

表3 TSB 中5 株凝固酶阴性金黄色葡萄球菌16 h 培养物的挥发性代谢产物类型统计(相对百分含量)Table 3 Varieties of volatile metabolites produced from coagulase-negative Staphylococcus aureus in TSB at the 16 h(relative percentage)

续表3 TSB 中5 株凝固酶阴性金黄色葡萄球菌16 h 培养物的挥发性代谢产物类型统计(相对百分含量)Continue table 3 Varieties of volatile metabolites produced from coagulase-negative Staphylococcus aureus in TSB at the 16 h(relative percentage)
进一步对TSB 中凝固酶阴性金黄色葡萄球菌产生的乙酸、1-丁醇、3-甲基-丁酸和2-丁酮响应强度进行动态变化分析见图3。


图3 在TSB 培养过程中凝固酶阴性金黄色葡萄球菌代谢产物峰响应强度变化Fig.3 Variation of response intensities of volatile metabolites from coagulase-negative Staphylococcus aureus during cultivation process in TSB
由图3 可知,5 株菌产生乙酸、1-丁醇和2-丁酮的变化规律相似,在培养周期内这些峰信号强度变化幅度很小,乙酸和1-丁醇信号强度大体在0.21×106~3×106范围内,2-丁酮信号强度在0.1×105~3×105。5 株菌的3-甲基-丁酸信号强度呈上升趋势,24 h 时累积强度达到最高,菌株31B、0250H、S12-1 和S2-2 的峰信号强度在1×106~1.6×106,菌株777H 的峰强度为4.56×105,不同菌株之间3-甲基-丁酸的产生能力存在差别。
2.3 牛乳中5 株凝固酶阴性金黄色葡萄球菌挥发性代谢产物类型和强度分析
在牛乳中,对16 h 培养物检出的物质类型进行统计,结果见表4。
5 株凝固酶阴性金黄色葡萄球菌培养物总计检出28 个挥发性代谢产物,包括烷烃类1 个、醇类2 个、酸类11 个、醛类1 个、酮类9 个、苯环类2 个、含氮化合物2 个,在各类挥发性代谢产物中酸类数量最多,其次是酮类物质。其中菌株31B 检出烷烃类1 个、醇类2个、酸类4 个、酮类7 个、含氮化合物1 个、苯环类1个;菌株0250H 检出醇类1 个、酸类6 个、酮类5 个、苯环类1 个;菌株777H 检出醇类1 个、酸类7 个、醛类1 个、含氮化合物1 个;菌株S12-1 检出醇类2 个、酸类6 个、醛类1 个、酮类6 个、苯环类1 个;菌株S2-2 检出醇类1 个、酸类3 个、醛类1 个、酮类7 个、含氮化合物2 个。另外,菌株检出的癸酸、丙酮、2-戊酮、2-庚酮、2-壬酮、2-十一烷酮的相对百分含量和牛乳空白相近,甚至低于空白基质,说明菌株并没有产生这些物质。5 株菌共同检出了2-呋喃甲醇、辛酸和3-甲基-丁酸,牛乳空白没有这些物质,被认为是凝固酶阴性金黄色葡萄球菌在牛乳中典型的挥发性代谢产物。

表4 牛乳中5 株凝固酶阴性金黄色葡萄球菌16 h 培养物的挥发性代谢产物类型统计(相对百分含量)Table 4 Varieties of volatile metabolites produced from coagulase-negative Staphylococcus aureus in milk at 16 h(relative percentage)
进一步对牛乳中凝固酶阴性金黄色葡萄球菌产生的2-呋喃甲醇、辛酸和3-甲基丁酸的峰响应强度进行动态变化分析见图4。
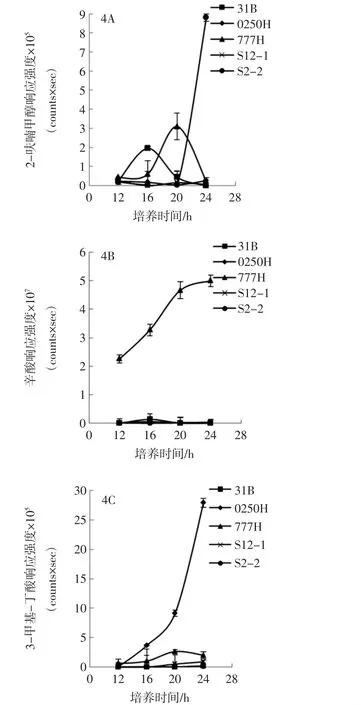
图4 在牛乳培养过程中凝固酶阴性金黄色葡萄球菌代谢产物峰响应强度变化Fig.4 Variation of response intensities of volatile metabolites from coagulase-negative Staphylococcus aureus during cultivation process in milk
从图4 可以看出,菌株31B 和777H 产生的2-呋喃甲醇强度变化规律是先升高后降低,菌株31B在16 h 时信号强度达到最高(1.95×105),菌株777H 在20 h 时信号强度达到最高(3.1×105)。菌株0250H 和S12-1 产生的2-呋喃甲醇强度偏低,培养周期内变化幅度很小,强度范围在0.3×104~2.5×104。菌株S2-2 产生的2-呋喃甲醇强度在20 h 之前基本保持不变(约1.00×104),但24 h 时快速增至8.78×105。菌株777H 产生的辛酸强度明显高于其它4 株菌,菌株777H 产生的辛酸信号强度大于2×107,而其余4 株菌产生的辛酸信号强度为0.03×106~1.36×106。对于3-甲基丁酸,菌株0250H 产生的峰强度明显高于其余4 株菌,从12 h 开始增加,24 h 时累积强度达到2.79×106。菌株777H 的峰信号强度在20 h 时达到最大(2.64×105),之后稍微降低。菌株31B、S12-1 和S2-2 产生的3-甲基-丁酸信号水平很低,仅在103~104水平。不同菌株之间代谢物产量有较大差异。
比较TSB 和牛乳可以看出,无论是在TSB 还是牛乳中,3-甲基-丁酸始终是凝固酶阴性金黄色葡萄球菌稳定的挥发性代谢产物。菌株31B、S12-1 和S2-2在TSB 中产生的3-甲基丁酸信号强度(1×106~1.6×106)远远高于牛乳中的强度(1×104~2×104),菌株777H在TSB 中产生的3-甲基丁酸信号强度稍微高于牛乳中的强度,只有菌株0250H 在TSB 和牛乳中产生的3-甲基丁酸信号强度相近。表明不同的培养基质会影响菌株的代谢活动。
3 结论与讨论
本研究针对凝固酶阴性金黄色葡萄球菌在TSB和牛乳中的代谢特征进行分析,发现TSB 中凝固酶阴性金黄色葡萄球菌检出的挥发性代谢产物以醛类、酮类和醇类物质居多,1-丁醇、乙酸、3-甲基-丁酸和2-丁酮是5 株菌共同检出的典型挥发性代谢产物。牛乳中检出的挥发性代谢产物以酸类物质最多且相对百分含量最高,其次是酮类物质,辛酸、3-甲基-丁酸和2-呋喃甲醇是五株菌共同检出的典型挥发性代谢产物。无论是在TSB 还是牛乳中,3-甲基-丁酸始终是凝固酶阴性金黄色葡萄球菌稳定的挥发性代谢产物。不同菌株产生3-甲基-丁酸的强度不同,并且同一菌株在TSB 和牛乳两种不同基质中3-甲基-丁酸的产生强度也不相同。Chen 等[23]报道金黄色葡萄球菌ATCC6538在TSB 培养物从第10 天开始检出3-甲基-丁酸,强度不断增加。Tait 等[24]对在TSB 中培养了18 h 的金黄色葡萄球菌NCTC 6571 检出了较高含量的3-甲基-丁酸(543 μg/mL)。Hettinga 等[18-19]分别对金黄色葡萄球菌和凝固酶阴性葡萄球菌污染的牛乳样品进行分析,均检出3-甲基-丁酸,并且在培养过程中3-甲基-丁酸的检出强度不断上升。本研究显示,在培养过程中5 株凝固酶阴性金黄色葡萄球菌产生的3-甲基-丁酸强度呈现稳定增长趋势,产生情况与上述文献报道相符。

