食品级TiO2对豚鼠细胞毒性表达和作用的研究
杨磊,柳明,赵琢,王华,翟自芹,左玥华,孙俐,刘烜
(天津海关工业产品安全技术中心,天津300308)
近年来,纳米二氧化钛(Nano-TiO2)已在诸多领域得到了广泛应用,特别是在食品添加剂领域。美国食品和药品监督管理局已允许将它用于食品添加剂中,我国卫计委(原卫生部)也于2001 年公布Nano-TiO2可用于食品,但是另一方面,它对环境及人类健康的危害作用也日益得到人们的关注[1],特别是对人类健康方面[2]。有研究报道它可在人体内多个脏器中积累并对各组织及器官产生毒性效应[3-7]。同时也有文章报道鼠皮肤涂抹纳米二氧化钛60 d 后,可在其大脑内检出纳米二氧化钛颗粒,但这些Nano-TiO2并未对小鼠脑部造成实质性的病变影响[8]。此外,试验表明Nano-TiO2能够诱导小鼠大脑中胶质细胞产生应激反应从而导致神经元受损和大脑功能障碍[9]。还有试验数据表明,鼻腔给药后,可通过电感耦合等离子体-质谱(inductively coupled plasma-mass spectrometry,ICP-MS)方法检测到在小鼠的各个脑区内均含有钛元素。然而,Nano-TiO2在脑部是否引起氧化应激反应并对大脑细胞产生毒性,从而进一步影响大脑的相关生物学功能,目前尚未系统性研究。
有试验结果显示,纳米氧化铁在小鼠脑细胞内相关特征数值产生变化,例如超氧化物歧化酶(superoxide dismutase,SOD)活性的增加,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和组成型一氧化氮合酶(construtive nitric oxide synthasec,NOS)的活性明显增加,而谷胱甘肽还原型(L-glutathione reduced,GSH),氧化型(L-glutathione oxidized,GSSG) 比例GSH/GSSG 明显下降,神经元细胞膜结构破坏,溶酶体增多[10-12]。本研究通过观测纳米TiO2处理后小鼠脑的病理变化,钛在脑中的含量变化,抗氧化酶活性和重要非酶物质含量等,以及重要的神经化学分子如谷氨酸,乙酰胆碱酯酶和一氧化氮(NO)的含量指标的变化,研究纳米TiO2引起的脑部氧化损伤毒性机制。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
Nano-TiO2、甲醛、硝酸、过氧化氢、肝素钠(分析纯):美国Simga 公司;磷酸盐(phosphate buffer saline,PBS)缓冲液:赛默飞世尔科技公司;总RNA 提取试剂盒:宝日医生物技术(北京)有限公司;活性氧类测定试剂盒:南京建成生物有限公司。
1.1.2 实验动物
实验用ICR 小鼠购自于中国医科大学动物中心,体重(22±2)g,性别均为雌性。饲养温度(20±2)℃,相对湿度为(60±10)%。实验小鼠被随机分为6 个试验组和1 个对照组。连续14 d,试验组每天注射纳米二氧化钛(锐钛矿型),剂量分别为5、10、50、100、150、200 mg/kg;对照组每天注射生理盐水。实验进行过程中观察记录小鼠摄食、行动、健康相关信息。实验结束后逐个称重,乙醚麻醉处死,快速剥离脑组织(脑组织分离出皮层和海马),样本逐个称重,转入细胞冻存管,-80 ℃保存待用。
1.1.3 仪器
1.2 方法
1.2.1 测定脑体比
详细记录每只实验动物的体重和脑重,计算公式如下:

1.2.2 组织病理学观察
试验组中,选取4 只小鼠并分离脑组织。多聚甲醛(4%)26 ℃固定4 h~6 h。然后更换新鲜的固定液,4 ℃孵育过夜。PBS 液洗一次。更换30%蔗糖的PBS 溶液,直至样品沉底为止。再次更换为新配制的30%蔗糖的磷酸缓冲液,4 ℃孵育,最后更换为100%包埋剂,过夜孵育。包埋,-80 ℃保存。切片之前将样本块提前放置在冰冻切片机内,冷却1 h。组织固定后,进行石蜡包埋,蜡块大小控制在2 cm×2 cm×0.5 cm 范围内,75%、80%、85%、90%、95%、95%、100%、100%乙醇依次脱水,每个脱水步骤时长4 h。石蜡切片厚度小于5 μm左右,放入55 ℃温水浴箱中展片,捞片,70 ℃过夜烤片,贴牢。石蜡切片经二甲苯脱蜡10 min,重复一次,然后依次放入100%、95%、90%、80%、70%的各级乙醇溶液中,每个步骤保持10 min,3%双氧水封闭10 min,最后放入蒸馏水中。苏木精-伊红染色不超过4 min,依次蒸馏水冲洗,酸性酒精冲洗,蒸馏水冲洗,0.5%氨水冲洗,中性树脂封片,光镜下观察细胞形态。
1.2.3 小鼠脑组织中的钛元素含量
取0.3 g 脑组织进行消化,将组织放入消解罐中,加入0.5 mL 浓硝酸,过夜消化。随后,在反应液中加入0.5 mL 的过氧化氢(H2O2)。将消解罐在160 ℃加热至组织块彻底溶解。将温度降低至120 ℃继续加热,直至所得溶液最终为无色透明,确保所有硝酸被除尽。最后,用3.0%硝酸将所得溶液定容至3.0 mL。小鼠大脑组织中的钛含量,采用电感耦合等离子质谱仪来进行测定。
1.2.4 脑组织中的活性氧类含量
将剥离出的小鼠大脑组织用PBS 冲洗干净,滤纸吸干;转入提取器中,加入50 mmol/L 的Tris-HCl(pH 7.4)制成匀浆。8 000 r/min 离心20 min,取上清液备用。根据羟胺法测定脑组织中的氧自由基含量。取上清液0.2 mL,加入10 mmol/L 盐酸羟胺溶液0.2 mL,25 ℃孵育20 min。加入1.0 mL CHCl3,混匀后静置20 min 萃取。8 000 r/min 离心20 min 取上清液。529 nm 波长条件下测定最终溶液吸光度。大脑组织中的H2O2含量用商业试剂盒来进行检测。活性氧类检测试剂盒,利用的是2',7'-二氯二氢荧光素二乙酯(2',7'-dichlorofluorescin diacetate,DCFH-DA)作为标记。细胞内的活性氧类(reactive oxygen species,ROS)可以将无荧光的2',7'-二氯二氢荧光素(2',7'-dichlorohydrofluorescein,DCFH)氧化成有荧光的2',7'-二氯荧光素(2',7'-dichlorofluorescein,DCF)。因此,测定DCF 的荧光就可以获知细胞内活性氧类的水平。
1.2.5 脑组织中的脂类过氧化物含量
丙二醛(modeldriven architecture,MDA)是反映细胞膜脂过氧化程度的常用指标,本实验通过测定MDA 含量来反应小鼠脑组织中的脂类过氧化物水平。实验首先将剥离出的小鼠大脑组织进行匀浆,用0.15 mmol/L HCl 溶液,其中含有3.0%硫代巴比妥酸(thiobarbituric acid,TBA)裂解组织。将裂解混合液在80 ℃孵育120 min,最终用丁醇萃取TBA-MDA 混合物,测定吸光度及MDA 含量。
1.2.6 脑组织中的抗氧化酶活性
剥离出的小鼠大脑组织用PBS 冲洗干净,滤纸吸干;转入提取器中,加入用冰预冷的1 % 聚乙烯聚吡咯烷酮(polyvinyl pyrrolidone,PVPP)的PBS 溶液(50mmol/L,pH7.6),制成匀浆。15000r/min 离心20min,取上清备用。分别测定上清液中的超氧化物歧化酶值、过氧化氢值(catalase from micrococcus lysodeikticus,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)值及谷胱甘肽过氧化物酶的活性。
采用商业试剂盒测定APX 活性。向每100 μL 组织匀浆液中,加入50 mmol/L PBS 溶液,25 mmol/L 抗坏血酸,100 μmol/L EDTA-Na2,以及17 mmol/L H2O2。每30 s 测定290 nm 波长下吸光度值(A290)。抗坏血酸过氧化物酶活单位以1 min 内A290减少0.1 单位的酶量为一个单位行计算。GSH-Px 的活性利用商业试剂盒测定。
1.2.7 脑组织中抗氧化剂的含量
利用检测设备为荧光分光光度计测定小鼠的脑组织匀浆液的GSH 和GSSG 含量,激发波长350 nm,发射波长420 nm。同样对组织匀浆液中的还原型抗坏血酸(ascorbic acid,ASA)和氧化型抗坏血酸(dehydroascorbic acid,DASA)含量进行测定,取60 μL 样本脑组织匀浆液,加入600 μL 3%CHCl3;37 ℃孵育4 h,加入1.0 mL 60%的H2SO4终止反应。采用2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)法对上述产物进行测定,蛋白质含量用Lowry 法进行测定。
1.2.8 脑组织中神经化学物质的含量
在大脑中,一氧化氮(NO)的合成主要依赖于一氧化氮合成酶(NOS)的专一性催化。NOS 主要有两种类型:组成型(cNOS)和诱导型(iNOS),在大脑正常生理功能中起到有重要作用。乙酰胆碱酯酶(AchE)在神经信号的传导和功能实现中同样具有关键作用。对其含量及活性测定均采用相应的商业试剂盒完成。
1.3 数据分析
试验数据用平均数及标准差进行表示。SPSS 13软件数据分析软件。多组数据之间的组间方差差异采用ANOVA 进行分析。各处理组与对照组之间的差异采用Dunnett-t 检验来进行分析。如果P<0.05,表示存在显著性差异,具有统计学意义。
2 结果与讨论
2.1 小鼠脑体比的变化
在本实验中,各试验组小鼠的脑体比测定数据参见表1。

表1 连续给药纳米TiO2 后ICR 小鼠的体重与脑重变化Table 1 Changes of the net weight and brain of ICR mice after administration of TiO2
结果表明,各小组中小鼠的体重未见明显差异,说明给药不同剂量的纳米二氧化钛对小鼠体重无显著性影响。在脑体比这一指标上,低剂量组与对照组相比无显著性差异。但随着Nano-TiO2给药剂量的增加,脑体比呈现出逐渐下降的趋势,有明显的剂量依赖效果,随着给药剂量的升高,与对照组相比的差异逐渐达到了显著水平(P<0.05)和极显著水平(P<0.01)。最终在高剂量组中检测到了脑萎缩,说明在该剂量Nano-TiO2已对小鼠脑组织造成了严重损伤。
2.2 小鼠大脑组织的病理改变
小鼠大脑组织的病理改变可见图1 所示。
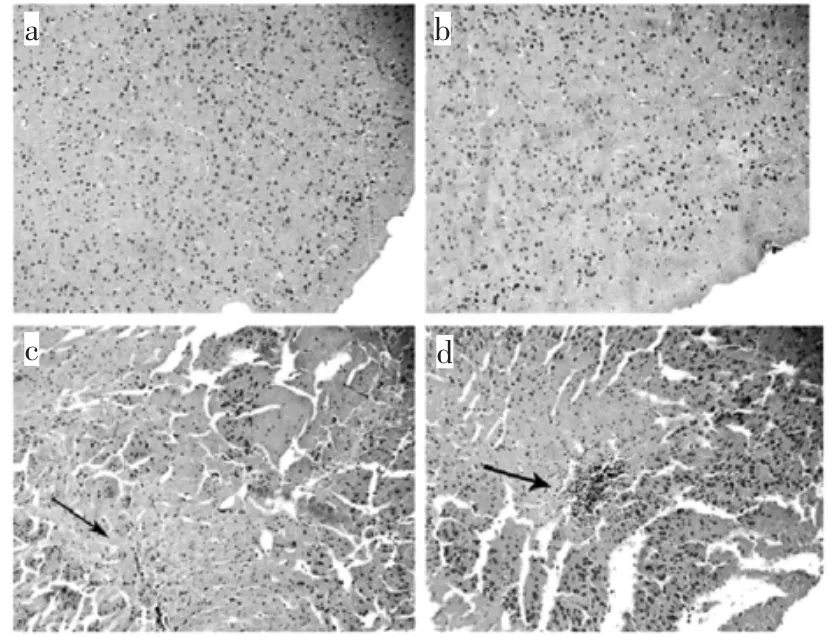
图1 小鼠大脑组织的病理切片结果Fig.1 Pathological changes in mice brain tissue
图1a、图1b 中,与对照组相比,50 mg/kg 处理组小鼠大脑组织中的神经细胞形态表现正常,处理组与对照组之间未表现出显著性差异。但随着给药剂量的升高,在100 mg/kg 剂量的试验组中,观察到了有部分脑神经细胞出现了局部区域的细胞破裂和裂解(图1c)。当剂量增加到150 mg/kg 时,我们可以观察到在大脑组织中出现了炎症细胞侵润现象,说明较高浓度的Nano-Tio2可对小鼠大脑组织造成明显损伤并产生炎症反应(图1d)。
2.3 钛在大脑组织中的含量
钛元素在ICR 小鼠大脑组织中的含量可见于表2。

表2 连续给药纳米TiO2 之后小鼠脑组织中的钛元素分布Table 2 Content of Ti in brain after TiO2 administration
在5、10 mg/kg 两个低剂量组中,未能在试验组和对照组中发现钛元素含量的显著性差异。但随着Nano-TiO2给药剂量的增加,脑体比呈现出逐渐下降的趋势,有明显的剂量依赖效果,随着给药剂量增加,与对照组相比的差异均达到了显著水平(P<0.05)甚至极显著水平(P<0.01)。
2.4 小鼠大脑组织中的氧自由基和脂类过氧化水平
ICR 小鼠大脑组织中的氧自由基(O2-·和H2O2)和脂质过氧化水平变化情况可参照表3。
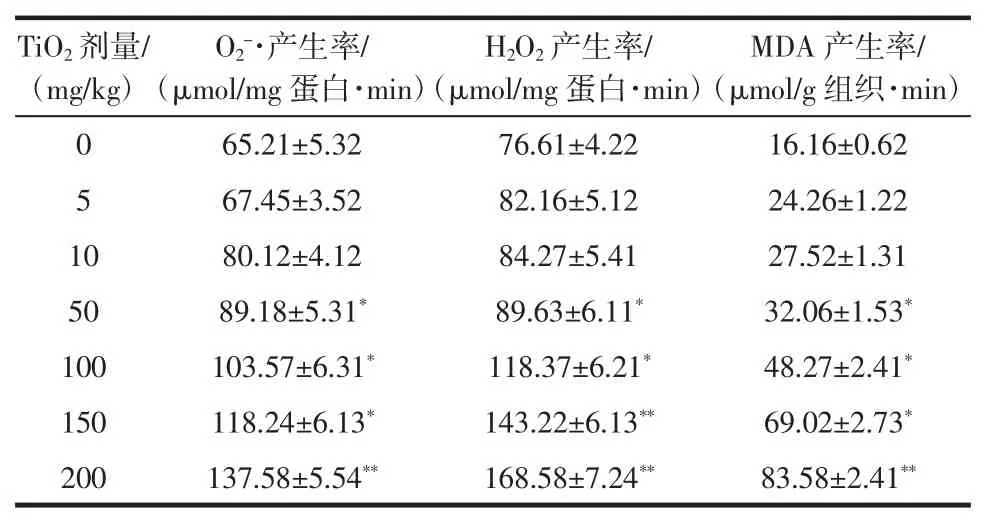
表3 TiO2 连续给药后,小鼠大脑组织中的氧自由基和脂类过氧化水平变化Table 3 Generation rate of ROS and lipid peroxidation in brains with TiO2 administration
在5、10 mg/kg 两个低剂量组中,未能在试验组和对照组中发现氧自由基(O2-·和H2O2)和脂质过氧化水平(MDA 含量)存在显著性差异。但随着Nano-TiO2给药剂量增加,在高剂量组50、100、150、200 mg/kg TiO2处理组中,(O2-·和H2O2)和(MDA)含量也显著提高,与对照组相比表现出了显著性差异或极显著差异。在不同的指标上,无论是氧自由基还是脂质过氧化水平,高剂量给药组都明显高于低剂量给药组,说明大脑组织的氧化应激反应强度与Nano-TiO2的给药剂量呈一定的剂量依赖性。
实验中,小鼠脑组织中的抗氧化系统酶活性改变结果见表4。

表4 连续给药纳米二氧化钛后,小鼠大脑组织中各种抗氧化酶的变化Table 4 The activities of antioxdative enzymes in brains with TiO2 administration

续表4 连续给药纳米二氧化钛后,小鼠大脑组织中各种抗氧化酶的变化Continue table 4 The activities of antioxdative enzymes in brains with TiO2 administration
仅在5 mg/kg 剂量组中未能发现APX、CAT、GSHPx 和SOD 的活性存在显著性差异。随着纳米二氧化钛给药剂量的增加,与对照组相比,在TiO2给药剂量为10、50、100、150、200 mg/kg 的处理组中,APX、CAT、GSH-Px 和SOD 的活性明显逐步降低。
小鼠大脑组织中的还原/氧化型抗坏血酸(ASA/DASA)比例,以及还原/氧化型谷胱甘肽(GSH/GSSG)比例水平的变化情况见图2。

图2 TiO2 连续给药后小鼠脑组织中(ASA/DASA)比例和谷胱甘肽还原型/氧化型(GSH/GSSG)的比例Fig.2 Ratio of ASA/DASA and GSH/GSSG in mice brains with administration of TiO2
在5 mg/kg 低剂量组中,未能在试验组和对照组中发现ASA/DASA 和GSH/GSSG 水平的显著性差异。但随着剂量的增加,在较高剂量组10、50、100、150、200 mg/kg TiO2处理组中,ASA/DASA 和GSH/GSSG 的比例降低显著。值得注意的是,与10 mg/kg~100 mg/kg的剂量组相比,150 mg/kg 和200 mg/kg 的高剂量组中的ASA/DASA 和GSH/GSSG 比例降幅相对较小。而浓度的增加也使得总抗氧化能力(T-AOC)降低。
2.7 小鼠大脑中一氧化氮合酶及一氧化氮水平的改变
ICR 小鼠大脑组织中的一氧化氮合酶(NOS)活性和一氧化氮(NO)水平的变化情况可参照表5。
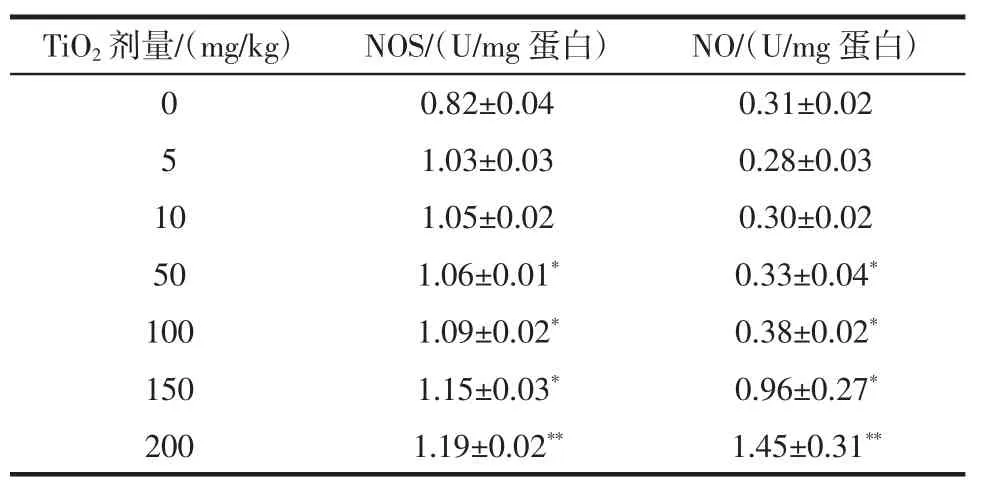
表5 连续给药TiO2 后小鼠脑组织中的NOS 与NO 水平Table 5 The activities of antioxdative enzymes in brains with TiO2 administration
在5、10 mg/kg 低剂量组中,未能在试验组和对照组中发现NOS 和NO 水平的显著性差异。但随着纳米二氧化钛给药剂量的增加,在较高剂量组50、100、150、200 mg/kg TiO2处理组中,NOS 和NO 水平明显上升,与对照组相比具有显著性差异。
2.8 小鼠大脑组织中的谷氨酸及乙酰胆碱酯酶改变
在实验中,未能在试验组和对照组中发现谷氨酸(Glu)和乙酰胆碱(AchE)水平的显著性差异。但随着Nano-TiO2给药剂量的增加,在较高剂量组50、100、150、200 mg/kg TiO2处理组中,Glu 和AchE 的水平逐渐下降,与对照组相比具有显著性差异。
3 讨论与结论
随着Nano-TiO2在各种医药、材料、涂料、以及各类食品领域中的广泛应用,人类接触Nano-TiO2的频率越来越高,在诸多接触方式中,食品类往往最容易被忽视,而Nano-TiO2经呼吸道、消化道和皮肤进入人体是最主要的入侵方式。本实验中,利用5、10、50、100、150、200 mg/kg 的剂量Nano-TiO2对小鼠进行14 d 连续腹腔给药注射并对各参数进行比较分析。实验结果表明,各小组中小鼠的体重未见明显差异,说明给药不同剂量的纳米二氧化钛对小鼠体重无显著性影响。在脑体比这一指标上,低剂量组与对照组相比并无显著性差异。在高剂量处理组中检测到了脑萎缩,说明Nano-TiO2已对脑组织造成了严重损伤,随着纳米TiO2给药剂量的增加,脑体比呈现出逐渐下降的趋势;但脑组织中钛元素的含量持续升高,有明显的剂量依赖效果。值得注意的是,在高剂量处理组中,还出现了脑神经细胞的形态改变和炎症性细胞侵蚀。
已有试验表明,鼻腔能够直接吸入纳米TiO2颗粒,这些颗粒可通过嗅神经进入脑组织并聚集在海马区[12-15],这些试验的最终结果都是导致神经元细胞的降解[16-20]。纳米颗粒还被证明能穿过血脑屏障并转移到中枢神经系统。通过本实验结果,证实了腹腔给药和鼻腔吸入纳米TiO2所引起的效应的一致性。这些结果说明,小鼠大脑组织受到的损伤是由纳米TiO2直接或间接引起的。通过进一步对脑组织受损的状况进行了观察与研究,发现炎症可在多种大脑组织中的增殖与蔓延,还观察到神经元坏死和脱落的神经元胞体,小鼠海马核的不规则和细胞变性。这些实验现象都表明,氧自由基能够攻击脑内的不饱和脂肪酸,进而引起脑组织损伤[21-22]。在显微镜下的观察结果提示脑细胞受损的严重程度与给药剂量具有一定的剂量依赖性。
在本研究中,在试验组和对照组中发现氧自由基和脂质过氧化水平并未存在显著性差异。但在高剂量组,与对照组相比,其氧自由基和脂质过氧化水平都明显升高,表现出了显著性差异。而且,无论是比较氧自由基还是脂质的过氧化水平,高剂量给药组都明显高于低剂量给药组,这说明脑组织的氧化应激程度与Nano-TiO2具有相当程度的剂量依赖性。同时也未能在低剂量试验组和对照组中发现APX、CAT、GSH-Px和SOD 的活性存在显著性差异,但随着剂量的增加,在剂量组15、50、100、150、200 mg/kg TiO2处理组中,APX、CAT、GSH-Px 和SOD 的活性逐步降低,表现出了显著性差异。在试验组和对照组中发现ASA/DASA和GSH/GSSG 并未显著性差异,但随着给药剂量的增加,在较高剂量组10、50、100、150、200 mg/kg TiO2处理组中,ASA/DASA 和GSH/GSSG 比例明显降低。
本研究结果还表明,在所有的神经胶质细胞,在接触到二氧化钛纳米粒子后引起细胞增殖,提示除大脑损伤以外,还有炎症/免疫反应会发生在海马区域。如果小鼠的神经炎症是由TiO2纳米粒子触发,那么是否可以通过改变相关的基因表达和蛋白参与的信号通路(如Toll 样受体和炎性细胞因子)来避免免疫能力降低。曾经有研究指出,腹腔注射或灌胃14 d 或30 d的TiO2纳米粒子后会产生相关的炎症级联反应和肝组织病理学变化。但是目前尚未发现纳米颗粒对动物和人类神经炎症直接相关的信号通路。

