运动激活AMPK改善非酒精性脂肪肝的研究进展
荆 文,李传芬,冯连世
(1.山东师范大学体育学院,山东济南250014;2.中国人民解放军联勤保障部队第九六〇医院,山东济南250031;3.国家体育总局体育科学研究所,北京100061)
0 引言
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一种常见的慢性肝脏疾病,影响全球20%~40% 的人群健康(Williams et al.,2011),疾病发展导致的肝炎和纤维化,给患者家庭和国家卫生系统带来巨大的负担(El-Agroudy et al.,2019)。因此,在NAFLD 发展的早期阶段进行及时干预,减少肝脏中脂类的堆积,逆转NAFLD 的发展,是人类面临的一大健康难题。迄今为止,除了改变生活方式和饮食习惯以及可能的减肥手术,还没有有效的医疗干预措施能够完全逆转NAFLD(Younos‐si et al.,2018)。
NAFLD 防治指南建议预防和逆转NAFLD 需要改变不良生活方式,坚持体育锻炼(中华医学会肝病学分会脂肪肝和酒精性肝病学组等,2018),因为运动能有效控制NAFLD 的发展(Johnson et al.,2010),减少肝脂肪含量(Romero-Gomez et al.,2017),减轻肝脂肪变性(Gehrke et al.,2019)。运动是增加机体能量消耗的有效手段,通过激活能量调节的关键酶—腺苷酸活化蛋白激酶(AMP-ac‐tivated protein kinase,AMPK),使其底物磷酸化而调节机体的能量代谢过程,抑制肝脏中脂类的聚集,减轻肝脂肪变性,发挥改善和逆转NAFLD 的作用。 因此,本文以AMPK 为核心,综述了NAFLD 的发病机理、运动训练对NAFLD 的影响以及运动激活AMPK 调节肝脏中脂类合成与氧化的代谢过程,探讨运动改善NAFLD 可能的分子机制。
1 NAFLD 的发病机理
NAFLD 是一种由多因素导致的慢性肝脏疾病,主要病理特征表现为肝细胞中甘油三酯(triglyceride,TG)的过量聚集,导致肝脂肪变性和肝脏炎症(Tarantino et al.,2010),其病理发展过程为单纯脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝硬化、肝癌、最后可能导致肝功能衰竭(Gariani et al.,2013)。NAFLD不仅可以导致肝病残疾和死亡,还与代谢综合征、2 型糖尿病、动脉硬化性心血管病等的高发密切相关(中华医学会肝病学分会脂肪肝和酒精性肝病学组等,2018)。NAFLD 发病机理比较复杂,从孤立的脂肪变性发展到NASH 通常被认为是一个循序渐进的过程,促进脂肪变性以及引发肝炎和纤维化的因素可能同时或先后发挥作用,在整个疾病发展谱系中具有不同的层次。
随着研究的深入,NAFLD 发病的可能机制也在不断完善,Day 和 James(1998)提出的“二次打击”假说认为首次打击是由于胰岛素抵抗导致的代谢紊乱使过多的游离脂肪酸(free fatty acid,FFA)进入肝脏,促进了肝脏中TG的生成和积累,引起肝脏脂肪变性;二次打击是由于TG的聚集导致肝脏对氧化应激、促炎细胞因子、内质网应激等刺激更加敏感,引起NASH 和纤维化(Rolo et al.,2012)。随着影响疾病发展的不同因素的揭示,人们逐渐发现该假说不足以解释NAFLD 发生过程中的一系列分子和代谢变化。而“多重打击”假说的提出考虑了NAFLD易感人群同时受到胰岛素抵抗、脂肪组织分泌的激素、营养因素、肠道微生物群以及遗传和表观遗传等多种因素的影响,这些因素可能以一种平行或协同的方式作用,为NAFLD 发病机制提供了更准确的解释(Buzzetti et al.,2016)。虽然近年来对NAFLD 发生发展的细胞和分子机制的研究不断深入,但各影响因素在疾病发生发展方面的确切作用仍未完全明确(Musso et al.,2016)。
2 运动训练对NAFLD 的影响
久坐不动的生活方式是导致NAFLD 发生的重要原因之一,有研究发现,儿童和成年NAFLD 患者普遍存在身体活动较少的现象(Gerber et al.,2012),而定期训练的人NAFLD 患病率相对更低(Zelber-Sagi et al.,2008)。运动训练能减轻NAFLD 患者肝脏脂肪变性(Gehrke et al.,2019),通过饮食调节和运动干预能有效减轻青少年(Tock et al.,2006)和 成 年 人(Eiichi et al.,2014)的NAFLD。 因此,控制能量摄入和增加身体活动能降低NAFLD 的患病率,改善或减轻NAFLD 患者的肝脂肪变性,是 NAFLD 患者治疗的基础(Schweitzer et al.,2017)。但对于如何通过运动逆转NAFLD 以及运动改善NAFLD的分子机制仍在不断研究。
NAFLD 与肥胖和胰岛素抵抗密切相关,降低体重能够提高胰岛素敏感性,改善NAFLD 和NASH(Brunner et al.,2019)。运动训练常常通过增加机体的能量消耗,以达到降低体重改善NAFLD 患者肝脂肪变性的目的,有研究表明,体重降低5%~10% 可以改善NAFLD 患者的肝脏脂肪变性和炎症,体重降低10% 以上可以减轻肝脏纤维化(Vilar-Gomez et al.,2015)。但也有研究发现,即使在体重不变的情况下定期运动也能降低肝脂肪含量(Rome‐ro-Gomez et al.,2017),改善血清肝酶水平,增加肝脏脂肪酸氧化(Lebrasseur et al.,2011;Lira et al.,2012),提高胰岛素敏感性(Heijden et al.,2009)。因此,不管体重降低与否,运动训练都可以有效减轻肝脂肪堆积,而运动训练改善NAFLD 的作用可能与运动降低肝内脂肪含量、增加脂肪酸氧化、诱导保护肝脏的自噬、减轻氧化应激和炎症、提高胰岛素敏感性和调节肠道微生物菌群等多种效应有关(Carbajo-Pescador et al.,2019;Cho J et al.,2014;Farzanegi et al.,2019;Kalaki-Jouybari et al.,2018)。
3 运动激活AMPK 改善NAFLD 的可能机制
3.1 运动增强AMPK 的活性
AMPK 是一种保守的能量敏感性蛋白激酶,其介导的底物磷酸化在调控和维持细胞内稳态中发挥重要作用(Steinberg et al.,2009)。AMPK 具有广泛的生物学功能,能控制食物摄入和机体能量消耗(Minokoshi et al.,2014)、增加脂肪酸氧化和葡萄糖摄取(Long et al.,2005)、调节线粒体能量代谢(李铁瑛等,2019)等。
AMPK 是由 α、β、γ 3 个亚基组成的异源三聚体,α 是催化亚基受AMP/ATP 比值的调节(Zhang et al.,2009);运动过程大量消耗ATP,升高AMP/ATP 的比值,提高AMPK磷酸化水平(Duck-Pil et al.,2018),增强肝脏(Gehrke et al.,2019)、脂肪组织(Natalia et al.,2018)和骨骼肌(Diniz et al.,2019)中的AMPK 的活性,引起的一系列的代谢改变。AMPK 的活性还受运动强度的调节,长时间低强度(Wojtaszewski et al.,2002)和60% 最大摄氧量的中等强度运动训练均能显著增强AMPK 的活性(Chen et al.,2003;Diniz et al.,2019;Wojtaszewski et al.,2003)。 活 化 的AMPK 磷酸化激活一系列下游靶分子,抑制糖原、脂肪和胆固醇合成,降低细胞合成代谢速率,减少ATP 的利用;促进脂肪酸氧化和葡萄糖转运,提高细胞分解代谢速率,增加ATP 的生成(Musso et al.,2010)。
3.2 活化的AMPK 能改善NAFLD 肝脏中脂质聚集
肝脏AMPK 活性受损是胰岛素抵抗及肝脂肪变性等代谢综合征发展的关键病理事件(Ruderman et al.,2013),而AMPK 的活化可以降低体重和肝脂肪含量(Duck-Pil et al.,2018),改善脂类水平和胰岛素抵抗(Wong et al.,2009)。研究发现,高脂饮食诱导的NAFLD小鼠AMPK 蛋白磷酸化水平比正常饮食组显著降低(Duck-Pil et al.,2018;Sinha-Hikim et al.,2011),而在肝脏中重新恢复AMPK 的磷酸化水平足以使肝脏脂质含量正常化;但肝脏特异的AMPK 敲除小鼠表现出正常的肝脏脂质稳态,没有发生脂肪肝的倾向(Boudaba et al.,2018),以上结果表明,高脂饮食引起的肝脂肪变性下调了AMPK 的磷酸化水平,而AMPK 活性的降低可能会进一步加剧肝脏中脂质代谢失衡,促进肝脏脂类的堆积;AMPK 表达水平的降低并不一定是诱导NAFLD 的发生发展的主要原因,但AMPK 活性的恢复确能减轻或逆转肝脂肪变性。
有研究表明,运动可以通过激活高脂饮食诱导的NAFLD 小鼠肝脏中AMPKα 的活性,抑制脂肪生成,促进脂肪酸β-氧化,阻止了高脂饮食诱导的肝脂肪变性(Geh‐rke et al.,2019)。运动也可以通过激活AMPK,使小鼠肝脏、骨骼肌、脂肪组织中乙酰辅酶A 羧化酶(acetyl-CoA carboxylase,ACC)磷酸化而失活,同时升高丙二酸单酰辅酶A 脱羧酶的活性,降低丙二酸单酰辅酶A 的含量,表现出抑制脂肪合成,促进脂肪酸氧化的特征(Park et al.,2002)。 运动还可以通过激活瘦素-AMPK-ACC 信号途径,改善肝脏葡萄糖和脂类代谢(Yi et al.,2013)。而运动联合饮食改变可降低AMPK 蛋白表达,增加AMPK 磷酸化水平和肉毒碱棕榈酰基转移酶1(Carnitine palmitoyl transferase 1,CPT1)蛋白表达,导致体重和肝脂肪含量下降(Duck-Pil et al.,2018)。因此,运动激活的 AMPK 既可以通过抑制ACC 的活性而抑制肝脏中脂肪合成,又可以通过提高CPT1 的表达而促进肝脏中脂肪酸氧化等途径调节机体的糖脂代谢过程,减轻和逆转肝脂肪变性。
3.3 活化的AMPK 改善NAFLD 的可能机制
运动激活AMPK 发挥改善NAFLD 的作用,而活化的AMPK 可能通过抑制肝脏脂肪合成、增加肝脏脂肪酸氧化、增强脂肪组织线粒体功能等途径调节机体的脂肪代谢过程,逆转NAFLD 的发展。
3.3.1 活化的AMPK 能抑制肝脏中脂肪合成
NAFLD 的病理特征是肝脏中TG 的过量聚集,降低肝脏中TG 的生成,可能起到抑制和逆转NAFLD 发展的作用。而运动可以通过激活AMPK,抑制肝脏脂肪生成,减轻肝脂肪变性(Gehrke et al.,2019)。脂肪从头合成是糖类转化为脂肪酸的代谢途径,糖类经糖酵解生成乙酰辅酶A,在ACC 催化下生成丙二酸单酰辅酶A,经一系列催化过程生成脂肪酸,与甘油酯化为TG。健康人群肝脏中通过脂肪从头合成途径生成的TG 小于5%,而在NAFLD患者肝脏中26% 的TG 来源于脂肪从头合成途径(Donnel‐ly et al.,2005;Lambert et al.,2014),以上结果表明,从头合成脂肪的增加在一定程度上促进了NAFLD 的发生发展,而降低脂肪从头合成的关键酶(ACC)的活性能抑制脂肪的从头合成,缓解肝脂肪变性。有研究发现,活化的AMPK 能够磷酸化固醇调节元件结合蛋白-1c(sterol regu‐latory element binding protein-1c,SREBP-1c)(Ser372),抑制SREBP-1c 的活化,降低其靶基因ACC 和脂肪酸合成酶(fatty acid synthase,FAS)的表达水平,减少TG 的合成和聚 集(Kalaki-Jouybari et al.,2018;Kohjima et al.,2008;Li et al.,2011;Yuan et al.,2009)。活化的 AMPK 也可直接磷酸化 ACC1(Ser79)和 ACC2(Ser212),降低 ACC 活性(Cho et al.,2010),减少丙二酸单酰辅酶 A 的合成,同时升高丙二酸单酰辅酶A 脱羧酶的活性,增加丙二酸单酰辅酶A 的分解,共同导致细胞内丙二酸单酰辅酶A 的含量降低(Park et al.,2002),减少脂肪酸的生成,从而抑制TG 的合成(Cho et al.,2010)。因此,运动激活的AMPK可 以 通 过 AMPK/SREBP-1c/ACC (FAS)途 径 或 AMPK/ACC 途径,抑制脂肪的合成代谢过程。
活化的AMPK 除了直接或间接降低ACC 的表达水平和活性,减少脂肪从头合成之外,还可通过激活沉默信息调节因子 1(silence information regulator,SIRT1),降低SREBP-1c 的表达,抑制肝脏脂肪合成。SIRT1 是一种依赖烟碱胺腺嘌呤二核苷酸(NAD+)的组蛋白去乙酰化酶,在成熟组织广泛表达,通过调节哺乳动物肝脏和脂肪组织中许多转录因子的表达,维持机体内能量平衡(Colak et al.,2014)。AMPK 的活化能增加细胞内 NAD+的水平,提高 SIRT1 的活性(Jeninga et al.,2010),降低 SREBP-1c的表达水平,减少肝脏脂肪生成(Gillum et al.,2011)。而SIRT1 也可以通过使肝激酶(liver kinase B1,LKB1)去乙酰化,促进LKB1 从细胞核转运到细胞质中被激活,进而磷酸化并激活AMPK(Lan et al.,2008),研究发现,通过激活LKB1/AMPK 通路,对肝脏脂肪生成有缓解作用(Kim et al.,2019)。这些研究表明,运动激活的AMPK 可以通过AMPK/SIRT1/SREBP-1c 途径抑制脂肪合成,同时机体内可能存在1 个AMPK/SIRT1 循环,两者相互促进,共同调控细胞的能量代谢过程。
3.3.2 活化的AMPK 能促进肝脏中脂肪酸氧化
NAFLD 的发展与肝脏中脂肪酸氧化速率有关,增加肝脏中脂肪酸氧化可以改善NAFLD(Perry et al.,2015),而减少肝脏脂肪酸氧化可以加重NAFLD 的症状(Zhang et al.,2007)。 24 周高脂饮食导致小鼠肝脏中AMPK、FAS 蛋白表达水平升高,活化的AMPK 和CPT1 蛋白表达水平降低,使小鼠肝脏中脂肪合成增加,脂肪酸氧化减少,增加了肝脏中脂类的聚集;而运动可以升高活化的AMPK 和CPT1 蛋白表达水平,促进脂肪酸氧化(Duck-Pil et al.,2018),减轻了肝脏中脂类的聚集。活化的AMPK还可通过提高过氧化物酶体增殖物激活受体γ 辅激活因子 1α(Peroxisome proliferator-activated receptor γ coactivator 1α,PGC-1α)的表达水平(Suwa et al.,2003),或通过磷酸化激活 PGC-1α 的表达(Jager et al.,2007),增强 CPT1 的表达,加速脂肪酸氧化。而SIRT1 是PGC-1α 的调节因子,能使PGC-1α 去乙酰化而增强线粒体脂肪酸氧化相关基因转录(Zhao et al.,2014)。 因此,运动也可以通过AMPK/SIRT1/PGC-1α/CPT1 途 径 ,增 加 线 粒 体 氧 化(Oliveira et al.,2014),改善糖脂代谢(田阁 等,2018)。运动激活的AMPK 提高了细胞内NAD+的水平,诱导SIRT1 介导的 PGC-1α 去乙酰化(Canto et al.,2009),进而加强脂肪酸氧化速率,调控细胞的能量代谢。因此,调节机体能量代谢的关键因子AMPK 通过增加PGC-1α 的表达水平或磷酸化激活PGC-1α,也可通过激活SIRT1 使PGC-1α 去乙酰化,共同提高CPT1 的表达,加速脂肪酸氧化。 同时,活化的AMPK 通过磷酸化SREBP-1c,抑制ACC 的表达,或直接磷酸化ACC 使其失活,导致丙二酸单酰辅酶A 合成减少。而丙二酸单酰辅酶A 是CPT1 的变构抑制剂,因此,活化的AMPK 抑制了ACC 的活性,降低了丙二酸单酰辅酶A 对CPT1 的抑制,增加了线粒体基质中脂肪酸的供应,促进了肝脏中脂肪酸氧化(McGarry et al.,1980)。
3.3.3 活化的AMPK 能增强脂肪组织线粒体功能
血浆FFA 是肝脏合成TG 的主要来源(Donnelly et al.,2005),是导致NAFLD 患者肝脏中脂质过量聚集的主要原因。而脂肪组织线粒体的功能影响脂肪释放入血的FFA 含量,线粒体功能的维持依靠线粒体生成与降解的平衡,AMPK 不仅参与线粒体的生物合成,也控制着线粒体的裂解和自噬(Herzig et al.,2018)。PGC-1α 是线粒体生物发生的重要调节因子(王平 等,2019),PGC-1α 的活性在不同代谢状况时会做出精确调节,活化的AMPK 通过增加PGC-1α 的表达或磷酸化激活PGC-1α,促进线粒体的生物发生,增强脂肪组织的线粒体功能,促进脂解的脂肪酸氧化,降低血浆 FFA 含量(Desjardins et al.,2018)。而脂肪细胞特异性敲除AMPK β1/β2 的小鼠,由于脂肪组织中缺失AMPK/PGC-1α 调节途径,导致棕色脂肪组织线粒体功能减弱,白色脂肪组织线粒体含量降低,白色脂肪棕色化减少(Mottillo et al.,2016)。该小鼠线粒体功能减弱可能与线粒体自噬减少,受损线粒体无法及时清除有关,而线粒体含量降低可能与线粒体生成减少有关,AMPK的活化可以促进线粒体生成,增强线粒体自噬(孙磊等,2018;Egan et al.,2011)。因此,敲除 AMPK 减少了线粒体生成与自噬,引起线粒体代谢失衡,导致脂肪组织线粒体功能减弱。在白色脂肪组织中,线粒体功能受损使ATP合成减少,降低了白色脂肪组织的能量存储功能,导致脂肪酸被重新运送到肝脏等周围组织;在棕色脂肪组织中,线粒体功能紊乱抑制脂肪酸氧化,导致脂肪酸向外周组织转移(Smith et al.,2016)。脂肪组织释放的FFA 进入肝脏,使肝脏中脂质合成增多,导致肝脏脂肪变性。因此,维持脂肪组织线粒体的功能可以预防胰岛素抵抗,减少FFA 的 释 放 ,预 防 NAFLD 的 发 生(Kusminski et al.,2012)。
4 总结与展望
NAFLD 是一种与肥胖、胰岛素抵抗、2 型糖尿病等多种疾病密切相关的代谢应激性肝损伤,其发病机制比较复杂,多种因素可能同时或依次发挥作用,导致NAFLD的发生发展,而运动训练能减轻肝脂肪变性,是逆转NAFLD 的有效途径。运动过程大量消耗ATP,导致AMP/ATP 比值升高,激活AMPK 的活性,抑制肝脏中脂肪的合成,促进肝脏中脂肪酸氧化,维持脂肪组织线粒体的正常功能,减少脂肪酸向外周及肝脏组织转移,降低肝脏中TG 的聚集(图1)。
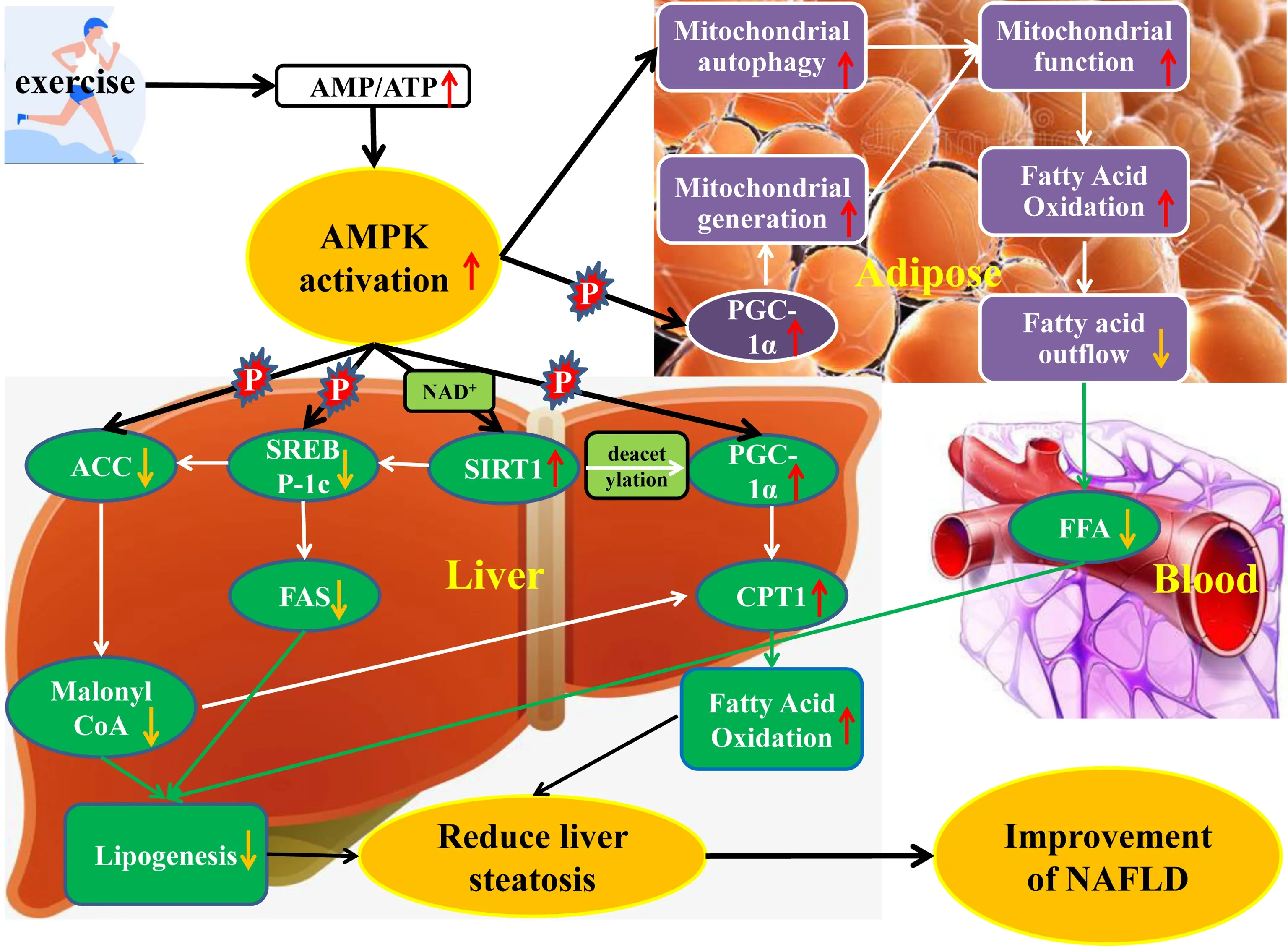
图1 运动激活AMPK改善NAFLD的可能机制Figure 1. The Mechanism of Exercise Improving NAFLD by Activating AMPK
AMPK 是调节肝脏脂肪合成与脂肪酸氧化、维持脂肪组织线粒体功能的关键酶,在运动改善和逆转NAFLD 中发挥重要作用,但目前仍有许多问题还未明确:1)肝脏AMPK 活性受损是胰岛素抵抗及肝脂肪变性等代谢综合征发展的关键病理事件(Ruderman et al.,2013),但AMPK活性受损与肝脂肪变性的因果关系仍不明确,是肝脂肪变性导致AMPK 活性受损,还是AMPK 活性降低引起肝脂肪变性?2)如何选择激活AMPK 的最佳运动方式和运动强度,使活化的AMPK 更有效地调控机体代谢?3)运动激活的AMPK 发挥调节作用的时效性,决定了运动处方中的运动频率,停止运动后AMPK 的活性如何变化,肝脂肪变性会怎样发展?4)施加于运动系统的刺激,如何引起AMPK 在非运动系统中被激活并发挥作用? 5)AMPK 具有广泛的生物学功能,运动激活的AMPK 是否还通过对饮食控制、氧化应激、胰岛素抵抗等功能的调节,发挥逆转NAFLD 的作用?
运动训练是通过增强运动系统的活动引起机体功能发生变化的过程,运动训练对机体的影响是系统的、全面的,要探究运动训练改善NAFLD 的可能机制,后续的研究需从NAFLD 的发病机理出发,在整体水平上探讨由运动激活的AMPK 对运动系统能量代谢的调节、对神经-内分泌系统功能的调节、对循环系统中糖脂含量及相关激素水平的调节、对脂肪和肝脏组织代谢的调节,最终表现出改善肝脏中脂类堆积、肝脏炎症、氧化应激、胰岛素抵抗等特征,即由运动训练刺激机体产生一系列的反应和适应,从而减轻肝脏损伤、恢复肝脏功能,逆转NAFLD。

