5 株乳酸菌吸附丙烯酰胺稳定性的比较
赵思佳,李 蕊,刘 彤,孙洪洋,沈 玉,赵筱铎,商佳琦,邵美丽,2,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江省绿色食品科学院,黑龙江 哈尔滨 150030)
日常饮食中,由于生冷食材的贮藏、加工、或者烹饪方式不当会产生一些有害物质,丙烯酰胺(acrylamide,AA)在食品热加工过程中由天冬酰胺和葡萄糖经美拉德反应形成[1-2]。研究证实AA会对人体和动物产生神经毒性、遗传毒性、生殖毒性和致癌性,给健康造成极大隐患[3-6],已被国际癌症研究机构划分为2A组致癌物质。因此,人们利用各种物理、化学、生物等方法减少AA含量,或降低其在食品中所带来的负面影响[7-10]。然而,物理和化学方法具有一定的局限性,例如:某些营养成分可能会丧失,或影响到食品的发全性,或必须用到昂贵的设备[11]。因此,近年来,专家学者对利用生物方法降低有害物质毒性进行了重点探究。
乳酸菌作为生物吸附方法的常用工具不仅应用范围广,而且兼具发全高效、生理功能多样性等明显优势。已证实乳酸菌对多种有害物质具有良好的吸附能力。例如嗜热链球菌和德氏乳杆菌对黄曲霉毒素B1和黄曲霉毒素G1具有较好的吸附能力[11-12];Corassin等[13]发现鼠李糖乳杆菌、德氏乳杆菌、保加利亚乳杆菌对黄曲霉毒素M1的吸附率均在11%左右;Abbès等[14]利用副干酪乳杆菌对伏马菌素B1进行去除,也取得良好效果;Wang Ling等[15]通过实验证实6 株乳酸菌对棒曲霉毒素具有清除效果;并且一些乳酸菌对许多重金属[16-18]及其他有害物质[19]也具有较好的吸附作用[20]。
目前有关乳酸菌吸附AA的研究很少。Serrano-Niño等[21]认为乳酸菌细胞表面可以与AA单体结合形成比较牢固的网状基质。Shen Yu等[22]发现乳酸菌细胞比表面积和细胞壁的粗糙程度与其吸附能力密切相关,细胞比表面积大的乳酸菌具有更好的吸附能力,并且AA的吸附率与细胞壁粗糙程度呈正比,细胞壁结构主要由肽聚糖和表面蛋白构成,二者共同影响细胞壁表面粗糙程度。肽聚糖中的3 种官能团(C—O、C=O、N—H)被认为是细胞壁“高度多孔”的主要因素,增加了细胞壁粗糙程度,从而增强了对AA的吸附能力。Zhang Dan等[23]发现肽聚糖的完整性越高,乳酸菌对AA的吸附率越高,并且肽聚糖中的4 种氨基酸(丙氨酸、天冬氨酸、谷氨酸、赖氨酸)总含量与AA吸附率呈正比,同时4 种氨基酸中丙氨酸含量对AA吸附率的影响较为明显。
尽管少数实验证实了乳酸菌可以有效吸附AA,并对其吸附机制有了一定的认识,但没有对乳酸菌的吸附稳定性进行深入研究。而乳酸菌与AA形成的乳酸菌-丙烯酰胺复合物(lactic acid bacteria-acrylamide,LAB-AA)在体内外环境下能否稳定存在则是抑制AA毒性的关键环节。因此,本实验选择5 株乳酸菌作为研究对象,以AA释放率为考察指标,比较5 株乳酸菌与AA形成的复合物在无菌去离子水、不同有机溶剂(甲醇、乙腈-水、丙酮)及体外模拟胃、肠道环境下的稳定性,同时比较5 株乳酸菌灭活前后与AA形成复合物的稳定性差异,以期为AA毒性抑制的研究提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
植物乳杆菌ATCC8014(Lactobacillus plantarum ATCC8014)、植物乳杆菌1.0665(L. plantarum 1.0665)、植物乳杆菌806(L. plantarum 806)、干酪乳杆菌ATCC393(L. casei ATCC393)、嗜酸乳杆菌 KLDS 1.0307(L. acidophilus KLDS 1.0307)均由东北农业大学食品学院菌种库保存。
1.1.2 试剂
AA标准品(纯度≥99%) 美国Amresco公司;甲醇(色谱纯) 广州市健硕科技有限公司;丙酮、乙腈(色谱纯) 哈尔滨市志飞生物技术公司;胃蛋白酶、浓硝酸、浓盐酸、胆盐、胰蛋白酶 辽宁博雅生物科技有限公司;MRS培养基 常州兰华试验试剂公司。
1.2 仪器与设备
LC-20A高效液相色谱系统 日本岛津公司;GL-21M高速冷冻离心机、HVE-50高压灭菌锅 浙江德育制造有限公司;DHP-9272电热恒温培养箱 江苏中坤仪器厂;DK-98-II恒温水浴锅 辽宁大成试验分析仪器厂;DB-3B电子分析天平 深圳物生生物有限公司。
1.3 方法
1.3.1 菌种的活化及菌悬液配制
将实验用的5 株乳酸菌接种在MRS培养基中于37 ℃培养24 h,并连续活化2 次,培养时间为8~12 h。再将乳酸菌以3%的接种量于MRS培养基中37 ℃培养过夜,8 000×g、4 ℃离心5 min回集沉淀,并用无菌去离子水洗涤2 次,然后将其悬浮在50 mL无菌去离子水中,得到活菌菌悬液。最后,选取一半悬浮液在121 ℃灭活15 min[23],得到高压灭活菌的细菌悬浮液。2 种悬浮液分别用于后续实验。
1.3.2 AA结合实验
分别在900 μL活菌和灭活组菌悬液中加入100 μL AA(6 μg/mL)溶液,37 ℃培养6 h。8 000×g、4 ℃离心5 min回集上清液,备用。
1.3.3 高效液相色谱法测定乳酸菌对AA吸附率
采用高效液相色谱法,色谱柱为Alltima Inertsil ODSP-C18(150 mm×4.6 mm,5 μm),以5%甲醇溶液为流动相,紫外线检测器参数设置为205 nm,流速为1 mL/min,注射体积为20 μL。测定所回回上清液中AA含量[23]。以没有添加菌悬液的AA工作液作为空白对照。乳酸菌对AA的吸附率按式(1)计算:

式中:A0为空白样液中AA含量;A为加入AA的菌悬液经离心回集的上清液中AA含量。
1.3.4 LAB-AA复合物的体外稳定性分析
为测定LAB-AA复合物的稳定性,将其分别置于无菌去离子水、甲醇、丙酮、乙腈-水(2∶1,V/V)中连续洗涤3 次,8 000×g、4 ℃离心5 min,回集上清液,用高效液相色谱法测定AA释放率。AA释放率按式(2)计算:
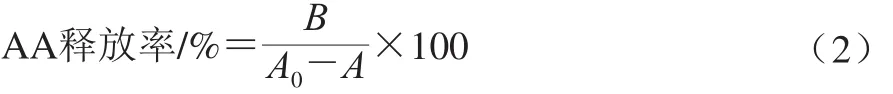
式中:B为不同洗脱液中AA含量;A0为空白样液中AA含量;A为加入乳酸菌菌悬液和AA反应后离心回集的上清液中AA含量。
1.3.5 LAB-AA复合物的体内稳定性分析
1.3.5.1 人工模拟胃环境
将10%的盐酸溶液加入无菌去离子水中,再加入胃蛋白酶,完全溶解后,得到pH值分别为1.5、2.5、3.5的人工胃液,通过0.22 μm滤膜除菌。将活菌和高压灭活菌的AA复合物分别悬浮在人工胃液中,在37 ℃培养1、2、3 h。然后,将悬浮液8 000×g、4 ℃离心5 min,回集上清液,用高效液相色谱法测定AA释放量,并计算释放率。
1.3.5.2 人工模拟肠道环境
将活菌和高压灭活菌的AA复合物分别悬浮于不同质量分数的胆盐溶液(0.1%、0.2%、0.3%、0.4%)和10 mg/mL的胰蛋白酶溶液,并调节pH值为6.8。在37 ℃培养3、4、5、6 h,8 000×g、4 ℃离心5 min,回集上清液,用高效液相色谱法测定AA释放量,并计算释放率。
1.4 数据处理
每组实验重复3 次,所有结果表示为 ±s。数据采用SPSS 21.0进行统计分析,采用Origin pro 8.6进行作图分析。
2 结果与分析
2.1 乳酸菌对AA吸附能力的比较
由图1可知,当乳酸菌暴露于AA环境中时,5 株高压灭活菌株均表现出比活菌更高的AA吸附率。其中,植物乳杆菌ATCC8014的高压灭活组和活菌组对AA的结合能力最高,吸附率分别为96.53%和93.16%,而嗜酸乳杆菌KLDS1.0307的高压灭活组和活菌组对AA的结合能力最低。这一实验结果与El-Nezami[24]和Piotrowska[25]等的研究成果相似。Piotrowska等[25]发现了3 种热灭活乳酸菌的赭曲霉毒素A吸附能力高于活性菌,并提出经高压灭活后细胞壁结构发生变化,并且通过细胞壁的疏水性,和电子供体-受体相互作用来促进与赭曲霉毒素A的结合。由此可推测,AA与乳酸菌细胞壁结合,且主要与乳酸菌肽聚糖和磷壁酸有关,而高温处理会影响乳酸菌细胞壁双层膜结构,并且肽聚糖的交联被打破,从而导致孔径增加。因此毒素除与细胞壁结合外,甚至还可以与细胞壁内的原生质膜结合,增加了乳酸菌与AA的结合位点。由此可见,细胞壁结构的改变对高压灭活乳酸菌吸附能力起到关键作用。
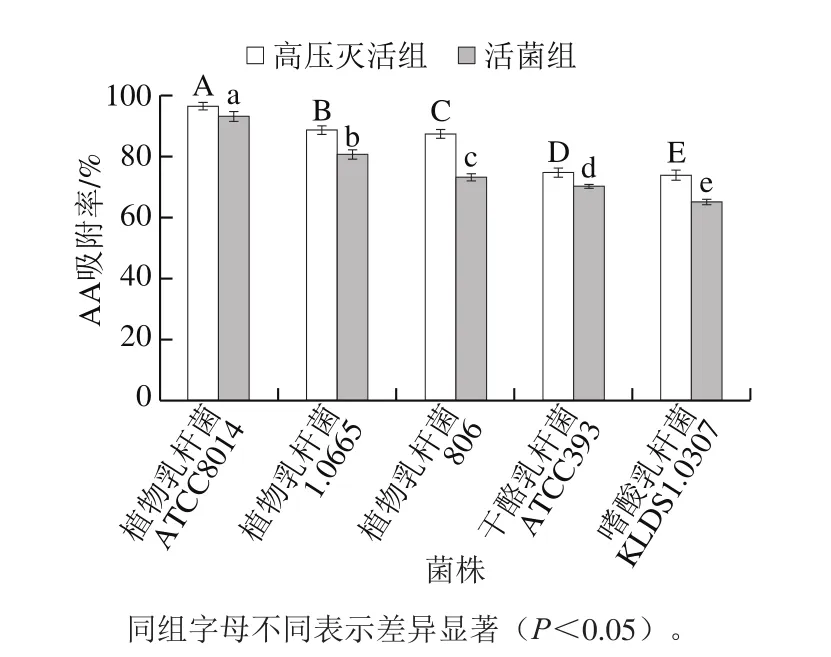
图1 5 株乳酸菌对AA的吸附率Fig. 1 AA adsorption percentages of the five strains of LAB
由图1可知,无论活菌还是高压灭活菌,5 株乳酸菌之间吸附率差异性显著(P<0.05)。Wang Ling等[15]发现不同乳酸菌与棒曲霉结合率不同,其原因是部分棒曲霉进入乳酸菌肽聚糖层,而不同品种乳酸菌肽聚糖具有不同官能团,导致肽聚糖的疏松程度不同。Zhang Dan等[23]认为,肽聚糖含量的差异也会导致不同菌种的吸附力差异。因此,推测5 株乳酸菌对AA吸附率差异是各自肽聚糖结构及含量不同导致的。
2.2 LAB-AA复合物的体外稳定性
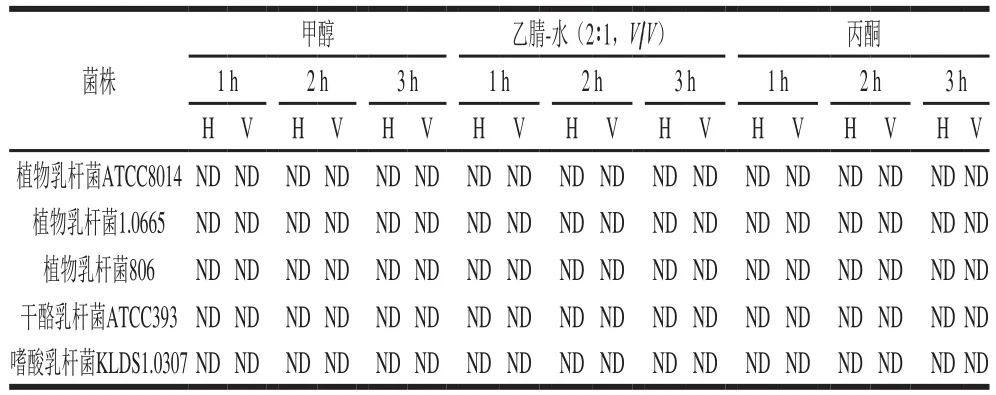
表1 LAB-AA复合物经有机溶剂洗脱的AA释放率Table 1 Stabilities of the LAB-AA complexes when exposed to organic solvents in vitro
如表1所示,LAB-AA复合物经有机溶剂的3 次洗涤,均没有AA释放,说明乳酸菌和AA的结合非常稳定。参考Serrano-Niño等[21]的结论可推测,AA单体结合与乳酸菌细胞表面形成比较牢固的网状基质,因此,LAB-AA复合物具有良好的稳定性。

表2 LAB-AA复合物经无菌去离子水洗脱的AA释放率Table 2 Stabilities of the LAB-AA complexes when exposed to aseptic deionized water in vitro%
如表2所示,5 株乳酸菌经无菌去离子水第1次洗涤后均有不同程度的释放,并且高压灭活菌的释放率均低于相对应的活菌组。而经无菌去离子水第2次和第3次洗涤后,5 株高压灭活菌和活菌的AA复合物对AA均不再释放。且高压灭活菌株的AA复合物对AA的释放率范围为3.59%~35.22%,明显低于活菌的复合物对AA的释放率7.34%~53.56%。有研究表明,疏水相互作用在乳酸菌与毒素相结合过程中起到了重要作用[26]。因此可推测,本实验中复合物水洗液中有少量AA的释放,是水对AA与乳酸菌之间的疏水作用产生影响而造成的,从而影响LAB-AA复合物稳定性。
2.3 LAB-AA复合物的体内稳定性
2.3.1 人工模拟胃环境
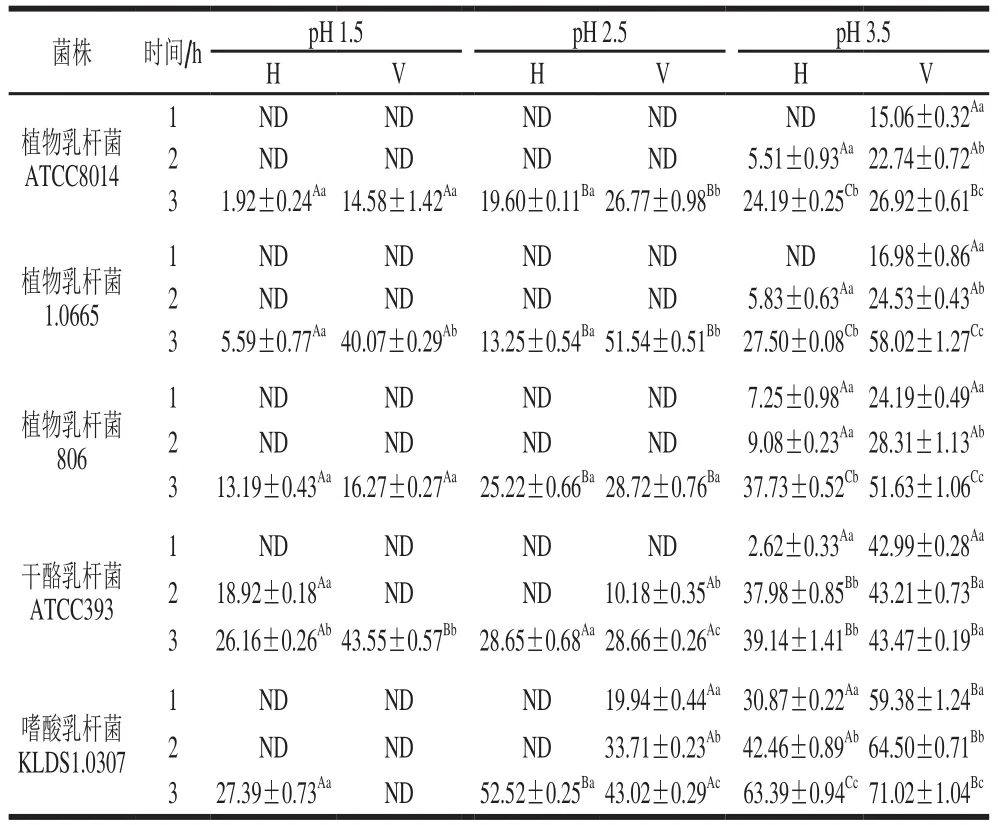
表3 pH值对LAB-AA复合物AA释放率的影响Table 3 Effect of pH on the stability of the LAB-AA complexes%
由表3可以明显看出,pH值与作用时间都会对LABAA复合物的稳定性产生影响。无论是高压灭活组还是活菌组,植物乳杆菌ATCC8014的AA复合物在pH值为1.5、2.5的人工胃液中分别作用1、2 h后,均无AA释放,说明在此条件下,该复合物是最稳定的;同时,AA释放量随着作用时间的延长而增加,当作用时间为3 h时,植物乳杆菌ATCC8014的高压灭活组复合物的AA释放率最低。综上所述,植物乳杆菌ATCC8014的AA复合物在模拟胃环境中稳定性最佳。El-Nezami等[24]认为,pH值对乳酸菌吸附黄曲霉毒素B1的稳定性有影响,相同条件下pH值低则复合物稳定性强,这与本实验结果一致:在模拟胃环境实验中,LAB-AA复合物的稳定性受pH值的影响很大,并随时间而变化。相关研究表明,pH值和作用时间对细菌活力有显著影响,且据推测,酸处理会降解乳酸菌细胞壁肽聚糖的多糖结构,从而暴露更多结合位点,使乳酸菌与AA结合更加稳定[27]。因此,本实验认为不同pH值改变了乳酸菌自身活力及其细胞壁结构,从而影响了复合物的稳定性。
2.3.2 人工模拟肠环境
2.3.2.1 胆盐对复合物稳定性影响

表4 胆盐对LAB-AA复合物AA释放率的影响Table 4 Effect of bile salt on the stability of the LAB-AA complexes%
由表4可知,在胆盐环境中,5 株LAB-AA复合物均能释放AA,但高压灭活菌组的LAB-AA复合物的释放率明显低于活菌复合物的释放率。同时,LAB-AA复合物的稳定性受时间和胆盐质量分数的影响,从整体趋势看,作用时间越长AA释放率越高。其中,植物乳杆菌ATCC8014的高压灭活菌组在0.4%胆盐条件下3 h内稳定性最佳,AA释放率仅为5.17%。先前研究发现,高质量分数胆盐能迅速溶解膜脂类并引起膜蛋白的解离,低质量分数的胆盐可通过对膜通透性和流动性的影响,从而破坏膜的完整性,并且影响细胞表面的疏水性和电位等物理化学性质[28-30]。因此,胆盐的这种破坏作用可能影响乳酸菌的蛋白质及膜的结构,从而影响LAB-AA复合物的稳定性。
2.3.2.2 胰蛋白酶对复合物稳定性影响
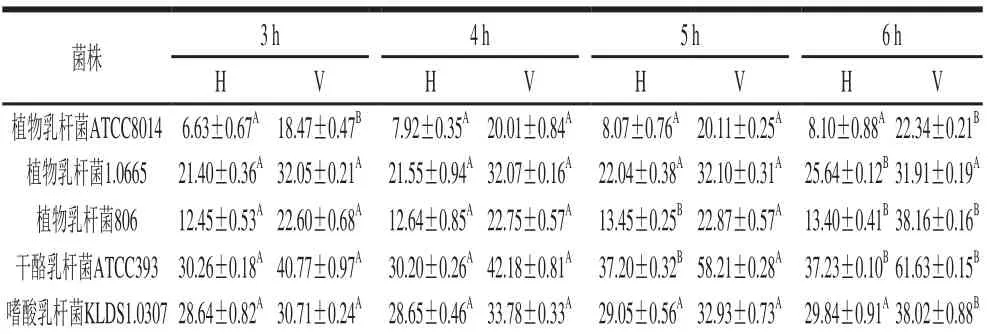
表5 胰蛋白酶对复合物AA释放率的影响Table 5 Effect of trypsin on the stability of the LAB-AA complexes%
由表5可知,在胰蛋白酶环境中,5 株乳酸菌的AA复合物均有AA释放,且作用时间对复合物的AA释放率影响不大。同样,高压灭活组的菌株复合物的稳定性明显强于活菌组,并且,植物乳杆菌ATCC8014复合物的AA释放率明显低于另外4 株乳酸菌复合物,3 h释放率最低为6.63%,说明其高压灭活组的复合物在胰蛋白酶环境中稳定性最佳。
Serrano-Niño等[21]研究发现丙氨酸是乳酸菌与黄曲霉毒素和AA结合的重要位点。Zhang Dan等[23]也得出相同结论,不仅丙氨酸是乳酸菌和AA的重要结合位点,赖氨酸也在乳酸菌吸附AA的过程中起到关键作用。同时,本实验发现5 株LAB-AA复合物的稳定性受胰蛋白酶的影响,胰蛋白酶可能正是通过作用在赖氨酸的结合位点,破坏乳酸菌和AA的结合,从而对LAB-AA复合物的稳定性产生影响。这一发现可能对乳酸菌在小肠暴露具有潜在的生物学意义,表明LAB-AA复合物可能在肠道内具有稳定性。
3 结 论
本实验中的5 株乳酸菌株均能有效吸附AA,且高压灭活菌株吸附AA的能力优于其活菌株。其中植物乳杆菌ATCC8014吸附能力最强,其高压灭活菌组和活菌组的AA吸附率分别为96.53%和93.16%。5 株乳酸菌与AA形成的复合物在甲醇、丙酮、乙腈-水中均可稳定存在。尽管在第1次无菌去离子水洗涤后,LAB-AA复合物释放出少量的AA,但第2、3次水洗均无AA释放,这说明LAB-AA复合物在无菌去离子水中也呈现较为稳定的状态。此外,通过体外胃肠道模拟实验发现,LAB-AA复合物稳定性与pH值、胆盐及作用时间有关,但在胰蛋白酶环境中LAB-AA复合物稳定性稍有减弱,且与作用时间无关。整体看,植物乳杆菌ATCC8014在上述环境中不仅对AA具有最强的吸附能力,而且其复合物也具有非常好的稳定性。本实验为进一步探究乳酸菌吸附AA的可行性及降低食品中AA对机体危害提供了理论支持。

