猪流行性腹泻病毒变异毒株与传统毒株RT-PCR鉴别诊断方法的建立
赵攀登,赵胜杰,王 岩,邓同炜,卢建洲,刘静静,朱文龙,冀梦瑶,陈 益
(1.河南牧业经济学院动物医学院,郑州450046;2.河南省动物疫病预防控制中心,郑州450000)
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种急性、高度接触性肠道传染病,临床上主要表现为呕吐、水样腹泻、脱水甚至死亡[1]。1978年,英国和比利时首次暴发PED,之后PED在全世界广泛流行[2]。我国南方地区在2010年10月暴发PED,疫情迅速蔓延至全国,对我国的养猪业造成了严重损失。随后,泰国、韩国、日本、美国、加拿大和葡萄牙等国均有PED暴发[3-8]。
猪流行性腹泻病毒属于I型冠状病毒,是有囊膜的单股正链RNA病毒。PEDV基因组全长约28 kb,依次包括5'非编码区、7个开放阅读框和3'非编码区,7个开放阅读框编码3个非结构蛋白和4个结构蛋白,基因组从5'到3'依次为5'UTR- replicase(1a/1b)-S-ORF3-E-M-N-3'UTR。我国自2010年10月暴发PED,引起了国内外研究人员的高度重视,流行病学结果表明,引起此次PED暴发的毒株与以往毒株在基因上出现明显变化,尤其是S基因,存在多处点突变、碱基的插入和缺失,并且与美国、韩国、越南等国近年来出现的毒株有较高的同源性[9-11]。
目前有多种PEDV抗原检测方法,比如针对S基因、M基因、N基因和ORF3基因的RT-PCR方法、real-time PCR方法、免疫组织化学和病毒分离等方法。但这些方法均不能区分PEDV变异毒株和传统毒株。本研究根据目前已发表的PEDV变异毒株和传统毒株S基因序列分别设计鉴别检测引物,在同时检测PEDV变异毒株和传统毒株的同时能够将两者区分。试验结果表明,该方法能够快速、简便、有效的鉴别检测PEDV变异毒株和传统毒株,为PEDV鉴别诊断和流行病学调查提供了有效的技术手段。
1 材料与方法
1.1 毒株猪传染性胃肠炎病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、猪呼肠孤病毒、猪瘟病毒、猪脑心肌炎病毒、轮状病毒由本实验室保存。
1.2 主要试剂pMD18-T载体、限制性内切酶、TaqDNA聚合酶、Mg2+、dNTPs、Trizol Plus、Oligod(T)18购自TaKaRa公司;Plasmid Miniprep Kit、DNA回收试剂盒购自BIOMEGA公司;反转录试剂盒购自Invitrogen公司。
1.3 病料肠道样品ZJ120101经基因测序为PEDV变异毒株;肠道样品JS120103经基因测序为传统毒株。其他肠道样品来源于中国9省市出现腹泻症状的猪场。
1.4 引物的设计与合成利用BioEdit软件比对GenBank发布的PEDV变异毒株和传统毒株的S基因序列,分别设计用于克隆变异毒株和传统毒株部分S基因引物和常规RT-PCR引物。Rev-F/Rev-R用于制备变异毒株和传统毒株标准品;F-V/R为变异毒株的鉴别检测引物;F-C/R为传统毒株鉴别检测引物。引物序列及在S基因中的位置详见表1。所有引物由上海英骏生物技术有限公司合成。
1.5 变异毒株和传统毒株标准品的构建分别提取ZJ120101和JS120103肠道样品中RNA,利用反转录试剂盒进行cDNA合成。以ZJ120101和JS120103肠道样品cDNA为模板,引物Rev-F/Rev-R经PCR扩增目的基因,将两种目的基因连接至pMD18-T载体,构建变异毒株的标准品pMD-SV和传统毒株的标准品pMD-SC,经酶切鉴定并送测序验证。
1.6 RT-PCR反应条件优化以标准品pMD-SV和pMD-SC为模板,用引物F-V/R、F-C/R进行优化RT-PCR条件。分别对引物浓度、Mg2+浓度、dNTPs浓度和退火温度进行梯度筛选。经过优化后的RTPCR反应体系:Taq酶0.5 μL,PCR Buffer 2.5 μL,Mg2+2.0 μL,上游引物F-V和F-C各1.0 μL,下游引物R为2.0 μL,模板pMD-SV和pMD-SC各2 μL,补ddH2O至25 μL。优化后的PCR反应程序:95℃ 预变性5 min;95℃变性 45 s,53℃退火45 s,72℃延伸80 s,35个循环,72℃ 延伸10 min。
1.7 RT-PCR特异性试验以pMD-SV和pMD-SC为阳性对照,水为阴性对照,以猪传染性胃肠炎病毒、猪伪狂犬病毒、猪繁殖与呼吸综合征病毒、猪细小病毒、猪呼肠孤病毒、猪瘟病毒、猪脑心肌炎病毒、轮状病毒经反转录得到的cDNA为模板,验证常规RT-PCR的特异性。
1.8 RT-PCR敏感性试验利用标准品pMD-SV和pMD-SC为模板,分别进行10倍倍比稀释(1×107copies/μL~1×101copies/μL),进行常规RT-PCR,确定该方法的敏感性。
1.9 RT-PCR临床样品检测试验按照建立的RT-PCR方法分别对具有腹泻症状仔猪的肠道样品进行检测。
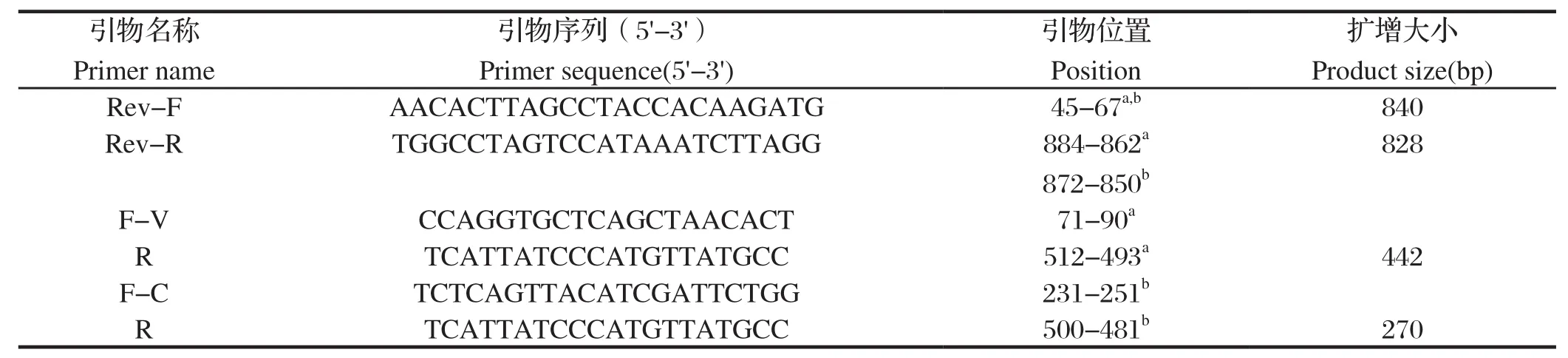
表1 本研究引物Table 1 Primers used in this study
2 结果与讨论
2.1 变异毒株和传统毒株标准品的构建重组质粒pMD-SV和pMD-SC经酶切鉴定,两种目的基因大小与预期一致(图1)。经测序验证分别是PEDV变异毒株和传统毒株序列。
2.2 RT-PCR特异性检测以pMD-SV和pMD-SC为阳性对照,水为阴性对照,其他毒株的cDNA为模板验证RT-PCR方法特异性。电泳结果显示:两个阳性对照在相应大小的位置出现条带,变异毒株条带大小为442 bp,传统毒株条带大小为270 bp,其他毒株和阴性对照均没有条带产生(图2)。
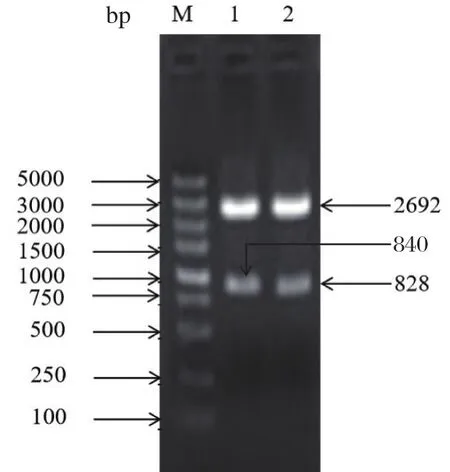
图1 重组质粒的鉴定Fig.1 Identification of recombinant plasmids by enzymedigestion
2.3 RT-PCR敏感性检测10倍倍比稀释pMD-SV质粒,以各稀释度为模板进行PCR检测,结果显示当质粒拷贝数为4×103没有条带产生,判定该方法检测PEDV变异毒株灵敏度是4×104拷贝(图3A)。以连续稀释的pMD-SC质粒为模板,同样的方法检测传统毒株灵敏度是4×104拷贝(图3B)。利用该方法对5份阳性肠道样品3次重复检测,结果一致,表明该方法具有较好的重复性。Kubota等[12]根据PEDV N基因设计一对引物扩增540 bp片段,用以检测PEDV,结果显示该方法在粪便中能检测到PEDV最低含量为100TCID50。Kweon[13]和Ishikawa[14]先后建立了检测PEDV M基因的RT-PCR方法。Song等[15]建立检测PEDV ORF3基因的RT-PCR方法用于区分疫苗毒和野毒。但是上述方法均不能区分PEDV变异毒株和传统毒株。秦毅斌等[16]根据PEDV变异毒株和传统毒株S基因的差异,建立了PEDV变异毒株和传统毒株鉴别检测方法。但是该方法仅能扩增PEDV变异毒株S基因序列,若是PEDV传统毒株感染则会出现假阴性结果。本研究能够同时检测PEDV变异毒株和传统毒株,并且根据扩增片段的大小可将两者区分,变异毒株扩增片段大小为442 bp,而传统毒株扩增片段大小是270 bp,试验表明该方法具有较好的敏感性和特异性。

图2 PEDV RT-PCR特异性试验Fig.2 The specificity of PEDV RT-PCR

图3 变异PEDV(A)和经典PEDV(B) RT-PCR敏感性试验Fig. 3 The sensitivity of conventional RT-PCR with variant PEDV (A) and classical PEDV (B)
2.4 临床样品检测结果利用建立的常规RT-PCR检测42份来自临床腹泻症状猪的肠道组织,结果显示:常规RT-PCR检测阳性样品29份,其中PEDV变异毒株27份,PEDV传统毒株2份。PEDV检出阳性率为69%(29/42),变异毒株检出率为93.1%(27/29),传统毒株检出率为6.9%(2/29)。
本研究建立的鉴别PEDV变异毒株和传统毒株RT-PCR检测方法具有快速、特异性强和灵敏度高等特点,在检测PEDV变异毒株和传统毒株的同时将两者区分,为猪流行性腹泻病原检测和流行病学调查提供了有效手段。

