miR-150调控动物成脂分化研究进展
陈星伊, 昝林森,2*
(1.西北农林科技大学动物科技学院,陕西 杨凌 712100;2.国家肉牛改良中心,陕西 杨凌 712100)
对于动物机体而言,脂肪组织十分重要,它不仅可以作为能量的储备和代谢,还可以作为分泌器官分泌多种脂肪细胞因子(adipokines)来参与调控机体的生理功能。研究发现,脂肪组织的呈现形式不单单是一种,而是在动物体的不同部位有着不同的分布类型。白色脂肪组织主要位于腹腔、皮下骨骼肌、骨髓腔和盆腔,不仅具有产生热量、贮存能量、对皮肤进行支持与保护,增加灵敏度的作用,还是第二性征的一个重要标志。在成人体内,棕色脂肪组织的含量极少,大体只有总脂肪的1%,分布于主动脉周围、背部肩胛骨间和颈部。在低温环境下,维持体温的正常调节[1]。近来,研究又发现了一种新的产热脂肪,外观呈米黄色,因而称为米色脂肪,其细胞内含有大量的棕色脂滴。在生理条件下,动物体内的白色脂肪与棕色脂肪可以相互转化,二者可发生动态转换。但如果二者之间的平衡被打破,就很可能引发出多种疾病,例如:肥胖症、Ⅱ型糖尿病、高血脂、脂肪肝、乳腺癌以及心血管疾病等。因而,了解脂肪的来源、不同类型脂肪的发生与转化等对指导人体及动物健康有实际意义[2]。
1 脂肪组织研究进展
1.1 脂肪细胞的来源
哺乳动物的白色脂肪组织和棕色脂肪组织都来源于胚胎期的间充质干细胞(mesenchymal stem cell,MSCs)。具有向脂肪细胞分化能力的脂肪前体细胞广泛分布于动物体的各类器官中。骨骼组织的造血干细胞和骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是脂肪细胞的重要来源。来自于骨髓的造血干细胞通过血液循环被运送到其他组织器官中,构成了各种组织器官的脂肪前体细胞。随着动物年龄的增长,骨髓腔中的骨髓间充质干细胞逐渐转变为脂肪细胞并储存于骨骼腔中,但之后的路径还未探究清楚。对此推断,脂肪组织可能是由这种骨髓来源的前体细胞通过转化得来的。同时也有研究表明,来自于小鼠胚胎期的神经外胚层细胞(可能是神经干细胞)也可以分化为脂肪细胞,这可能是脂肪细胞的另一个来源[3]。
1.2 脂肪的分类及关系
到目前为止,人们了解的哺乳动物脂肪有3种,分别为白色脂肪(white fat)、棕色脂肪(brown fat)和米色脂肪(beige fat)。白色脂肪组织是一个器官,可以储存一定的能量,也是人类体内最大的内分泌器官,其脂肪细胞可以分泌脂肪酸、细胞因子(cell factor)和转录因子(transcription factor)等物质,还参与进人体的肝脏、大脑等中进行的生命活动过程中,参与机体糖脂代谢[4]。因此,白色脂肪组织不仅会影响肥胖,也会对代谢综合征的发生及发展产生一定的影响。
棕色脂肪组织可以与线粒体进行氧化呼吸解偶联作用,使ATP转化为热能,从而实现热能的转化来消耗之前储存的能量[5]。对于新生个体来讲,对环境温度的抵御能力差,极容易受到温度变化的影响,为了快速维持动物个体恒定的体温,需要有大量的棕色脂肪来保证可以产生足够的热量,所以棕色脂肪是新生个体的主要脂肪形式。随着动物个体的发育,持温能力会加强,棕色脂肪就会逐渐被白色脂肪替代;等到发育为成体动物个体后,棕色脂肪主要存在于颈部的背侧和主动脉周围,白色脂肪是成年动物的主要脂肪形式[6]。
动物在消耗白色脂肪时,脂肪细胞质中的线粒体数量急剧增加,氧化代谢加快,脂肪也由白色变为米黄色[7]。因此,可以认为米色脂肪是白色脂肪向棕色脂肪转化过程中出现的中间形态。
1.3 脂肪细胞分化机制
通常脂肪分化被分成2个时期:第1个时期是间质干细胞(mesenchymal stem cell,MSC)转化成“确定的”或“定向的”前体脂肪细胞(preadipocytes),第2个时期是前体脂肪细胞终末分化为成熟的脂肪细胞(mature adipocyte)[8],如图1所示。在定向阶段,间充质干细胞(MSC)在激素、胰岛素、生长因子等刺激下分化为定向前体脂肪细胞。之后,前体脂肪细胞经历几轮必不可少的有丝分裂克隆,然后在CCAAT增强子结合蛋白(C/EBPs)家族和过氧化物增殖激活受体γ(PPARγ)等的参与下,离开细胞周期并发生终末分化,失去其成纤维细胞的形态,积累细胞质甘油三酯,形成被一个大脂滴填充的成熟脂肪细胞。在上述分化过程中,各种调控转录因子都起到了重要作用,细胞的表观遗传修饰也都发生了变化(图2)[9]。
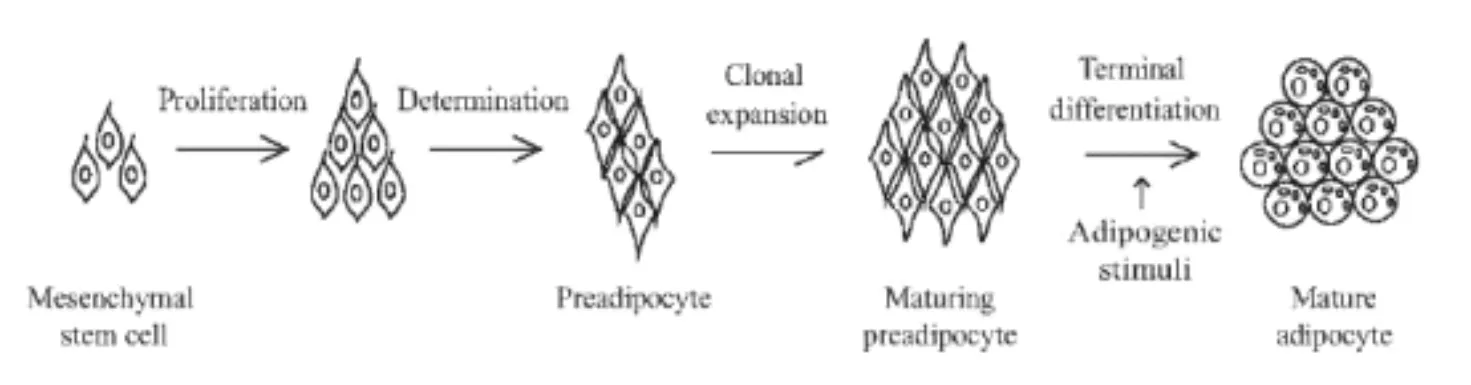
图1 多能间充质干细胞定向诱导分化为成熟的脂肪细胞的模型[10]
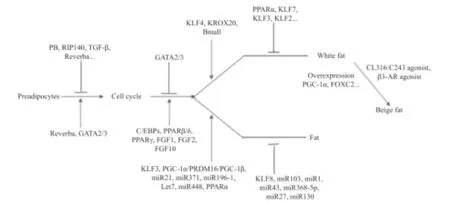
图2 脂肪相关因子对脂肪分化的作用[11]
2 miRNAs研究进展
microRNAs在动物和植物基因组中普遍存在,它在转录后水平的基因调控过程中起着不可忽视的作用[12]。与许多真核生物基因的转录物相似,miRNAs的初级转录产物pri-miRNA 5′端有加帽,3′端有许多腺苷酸结构,这类基因的转录能够被RNA聚合酶Ⅱ与许多miRNAs的启动子区结合在一起。因此,与许多真核基因类似,miRNAs也由RNA聚合酶Ⅱ转录,并具有自己的启动子区域,它们的表达会受到各种时空上的调节[13]。在动物细胞中,miRNAs通过抑制mRNA翻译或使之降解失衡[14]来行使作用,miRNAs通过与靶基因(mRNA)的3′未翻译区(3′UTR)碱基配对来下调基因表达。
2.1 microRNAs的生物合成
动物和植物体中形成成熟的miRNA的基本过程十分相似(图3):先由RNA聚合酶Ⅱ产生的较长的初级转录产物pri-miRNA,中间有一段不完美配对的茎—环结构。经过第一步切割产生pre-miRNA,再经第二步切割产生双链miRNA,双链解链形成成熟的长21 nt左右的单链miRNA。pri-miRNA在细胞核内被称为微处理器的多蛋白复合物加工,其核心成分是RNase Ⅲ酶Drosha和双链RNA结合do-main(dsRBD)蛋白DGCR8/Pasha[15]。在链分离后,其中一条双链成为进入RNA诱导的沉默复合物(RISC)的成熟miRNA分子,而另一条miRNA链经常被降解或在miRNA稳态调节和下游中发挥功能性作用[16]。RISC复合物通过与其互补靶mRNA完美或不完美的匹配起作用,并诱导靶mRNA降解或翻译抑制或从翻译机制中分离mRNA(图4)[17]。
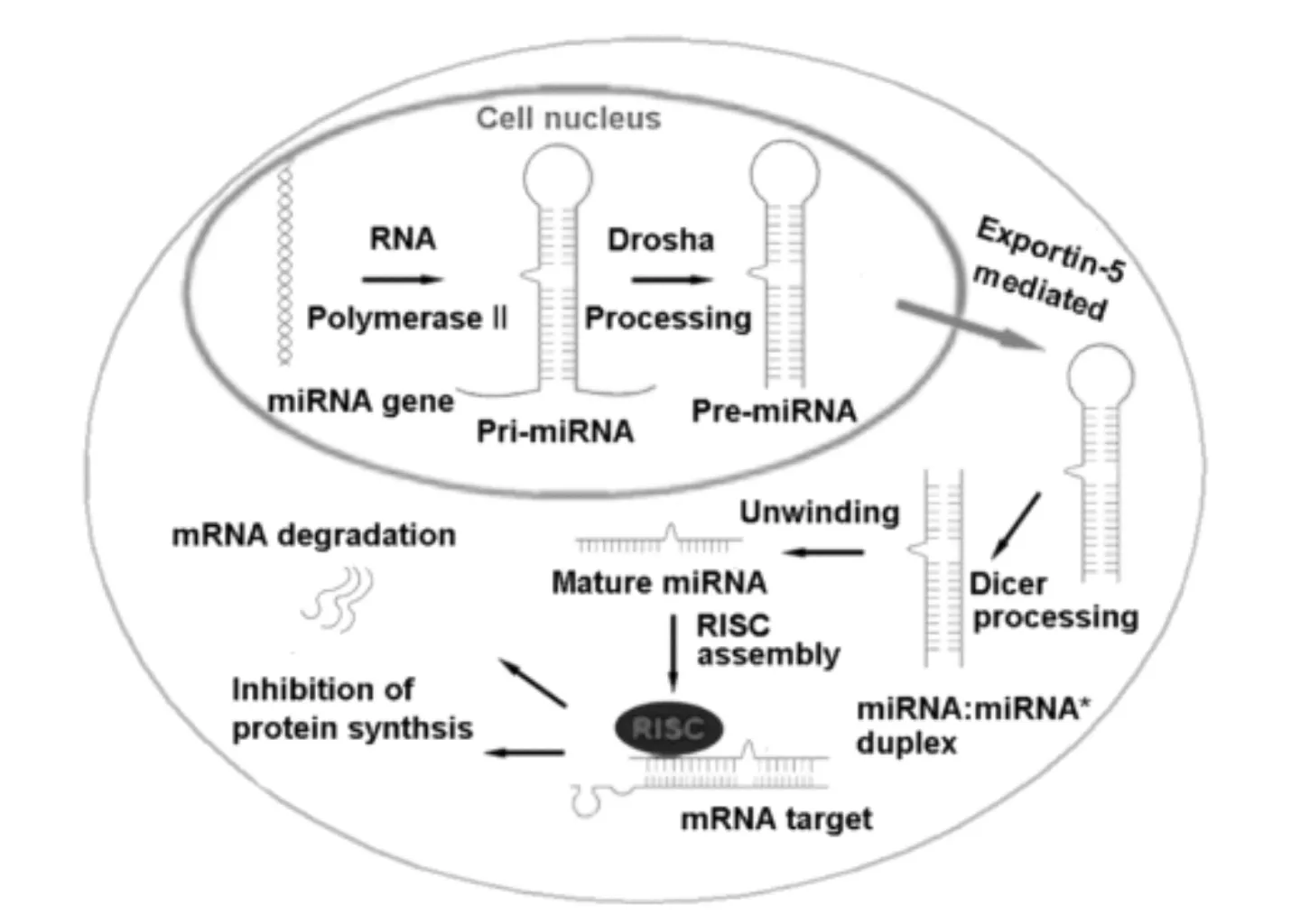
图3 miRNA的生物合成和功能[18]
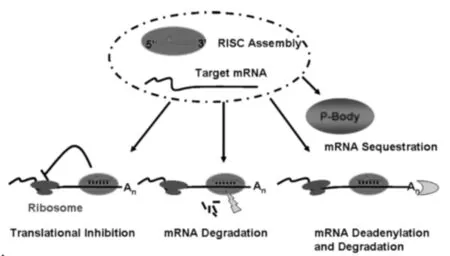
图4 miRNA的基因调节机制[19]
2.2 脂质代谢相关microRNAs及其调节机制
脂肪细胞的分化过程受到很多miRNAs的调控,包括正向调控和反向调控。miRNAs参与脂肪分化的调控主要通过两种途径:一种作用于脂肪细胞分化相关的信号通路,包括SMAD/TGFβ、MAPK、Wnt通路等;另一种是作用于一些重要的转录因子,如PPARG、C/EBPs等从而转录调控脂肪酸结合蛋白4(FABP4)、脂肪酸合成酶(FASN)、葡萄糖转运蛋白4(GLUT4)等一类脂肪相关基因的表达来影响脂肪细胞的分化,miR-143是第一个被发现可以参与调控脂肪细胞分化的miRNA,它通过调控蛋白激酶5(mitogen-actived protein kinase 5,MAPK5)来促进脂肪细胞的分化[20]。之后,越来越多的研究表明,miRNAs可以与脂肪细胞分化相关的转录因子和重要信号分子相互作用来调控脂肪形成[21]。目前已经有很多调控脂肪细胞分化的miRNAs和靶基因(表1)被发现,miRNAs调控脂肪细胞分化的网络日益完善。
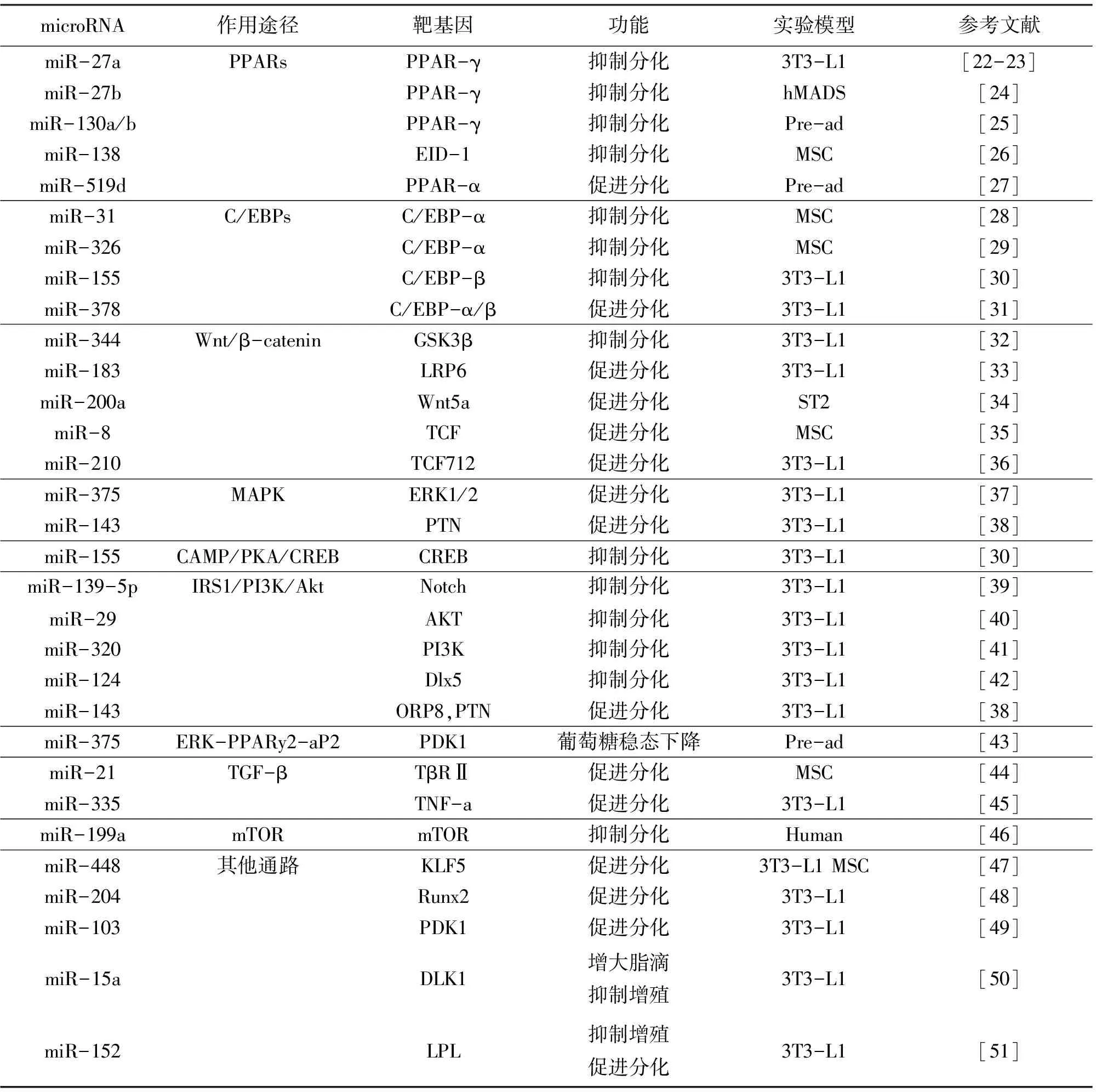
表1 miRNAs调控脂肪细胞分化
注[52]:PPARs为过氧化氢酶体增殖物激活受体;C/EBPs为CCAAT增强子结合蛋白;EID-1为EP300相互作用分化抑制因子1;Wnt/β-catenin为Wnt/β-连环蛋白;GSK3-β为糖原合成酶激酶3β;LRP6为低密度脂蛋白受体相关蛋白6;TCF为T细胞因子;MAPK为促分裂原活化蛋白激酶;ERK1/2为细胞外调节蛋白激酶1/2;cAMP/PKA/CREB为腺苷酸环化酶/蛋白激酶A/环磷腺苷效应元件结合蛋白;PI3K/Akt为磷脂酰肌醇3激酶/蛋白激酶B;IRS1为胰岛素受体底物;ORP8为氧类固醇结合蛋白相关蛋白;PTN为多效生长因子;PDK1为3-磷酸肌醇依赖性蛋白激酶1;TGF-β为转化生长因子-β;KLF为Kruppel样因子;Runx2为Runt相关转录因子2;Cav-1为微囊蛋白1;DLK1为delta样1同族物;PRDM16为锌指转录因子PR结构域包含蛋白16;UCP-1为解偶联蛋白;Pde1b为磷酸二酯酶1b;Igfbp5为胰岛素样生长因子结合蛋白5;RIP140为受体相互作用蛋白140;ADAM17为解聚素—金属蛋白酶17;Hoxc8为同源框基因8;FGFR1为成纤维细胞生长因子受体1;Pre-ad为前体脂肪细胞;hMADS为人多能脂肪干细胞;MSC为间充质干细胞;ADSC为脂肪干细胞。
3 miR-150研究进展
不同物种的miR-150定位于不同的染色体位置上,常见的hsa-miR-150定位于人类染色体19q13,mmu-miR-150定位于鼠染色体7q上,scc-miR-150定位于猪染色体6q上,bta-miR-150定位于牛染色体18q等,这种物种特异性也决定了不同的研究价值。它最初被发现在T淋巴细胞、单核细胞以及巨噬细胞当中高度表达[53],作为重要的造血细胞特异性miRNA,它在许多造血细胞系的分化过程中起着关键的作用,尤其是在淋巴细胞发育和功能中意义重大。随着研究的更加深入和实际的需要,此后miR-150的研究主要集中在癌症和细胞增殖凋亡等方面。在癌症方面,发现许多miRNA与DN(糖尿病肾病)的发生或微量蛋白尿的出现相关,并直接靶向肾脏纤维化途径,进而导致糖尿病肾脏病理损伤[54]。许多临床研究发现miR-150具有潜在的预后价值。在慢性淋巴性白血病中,miR-150显著下调,与疾病的发生相关。在各种其他的实体肿瘤组织(肺癌、乳腺癌、卵巢癌、食道癌、结肠直肠癌、胃癌和胰腺癌)中也发现了miR-150的异常表达。miR-150也被证实在食管鳞状细胞癌和原发性结直肠癌中显著下调,预示着预后不良。在乳腺癌细胞系中,miR-150的表达量增加,促进生长和克隆形成,并减少细胞凋亡[55]。研究结果表明,生殖激素可以通过影响绵羊miR-150启动子活性来调控miR-150的表达,为miR-150调控卵泡发育的机制研究提供新思路[56]。
研究发现,miRNAs通过降解靶mRNA或阻断其翻译来调节与脂质代谢相关的基因表达[57]。同时证实miR-150靶向调节巨噬细胞和脂肪组织中脂质代谢和细胞因子表达的基因的mRNA表达,并且在涉及脂联素受体2(AdipoR2)的过程中改变脂肪细胞中的胆固醇和甘油三酯(TG)积累[58]。Warth等发现miR-150的靶点之一是雷帕霉素(mTOR)的机制,其调节脂肪细胞中瘦素的表达[59]。由于瘦素主要作用是调节食物摄入,miR-150可能在能量平衡和体重测定中发挥作用。miR-150的另一个直接靶点是过氧化物酶体增殖物激活受体γ辅激活物-1a(PGC-1a)[60]。PGC-1a调节脂肪组织中的脂质代谢,并且可以产生无效循环,同时激活TG水解成游离脂肪酸(FFA),并将FFA和甘油再酯化成TG[61]。所以,miR-150与mTOR和PGC-1α有着靶向关系。
在家畜中,也有相应的研究发现miR-150参与成脂分化过程。Liang等在比较1个西方品种(约克夏猪种)与7个中国本地猪品种之间的表达水平,差异表达分析发现脂肪组织和肌肉组织中分别有92和12个差异表达的miRNA,其中ssc-miR-150参与脂肪组织功能[62]。另外,有结果表明miR-150-5p可以直接靶向CYP3A4的3′UTR,有助于FFA诱导的脂肪变性的发展[63]。Zhang等在阉牛和公牛的基因组测序结果中使用IPA 软件筛选,结果仅有9种DE miRNA(bta-let-7i,bta-miR-1296,bta-miR-141,bta-miR-150,bta-miR-151-3p,bta-miR-193a-3p,bta-miR-224,bta-miR-2890和bta-miR-454)和42个DE靶基因与细胞的分化和脂肪组织的代谢相关[64],为我们后续的探究提供了基础和方向。
4 展 望
近年来,人们对脂肪分化的研究取得了很大的进展,找到了许多与脂肪分化相关的调控因子,也找到了许多表观遗传和miRNAs的调控方式,对于这些因子的调控方式、调控时间或参与哪些调控通路的研究也在日臻完善。在哺乳动物模型上的研究为解决更加复杂问题带来了便利。从第一个发现的与成脂调控相关的microRNA开始,在一段时间内成为了人们研究的热点,也因为microRNA自身的高保守性特点,为人们探究不同物种的成脂调控问题带来了灵感和突破点。miR-150在人鼠模型上已被证实与成脂调控有关,但在其他经济动物体内的研究还有待更深的探究。日后,关于白色脂肪与棕色脂肪的转化关系以及棕色脂肪如何转化为氧化供能脂肪等都需要更深入的研究。通过对脂肪细胞的发生、分化、各类脂肪细胞之间的转化机制与miR-150的研究,有望为治疗一些与疾病或经济动物生长过程提供理论支持与依据。

