高产胞外多糖植物乳杆菌筛选及其发酵工艺优化
张文平,赵英杰,罗晟,程新
(江西农业大学 生物科学与工程学院,江西 南昌,330045)
乳酸菌胞外多糖是乳酸菌在生长代谢过程中分泌到细胞壁外的一种糖类高聚物的总称[1-2]。大量研究表明,乳酸菌胞外多糖具有多种生理功能,如抗氧化、抗肿瘤、促进肠道菌群平衡、免疫调节等[3],此外,乳酸菌胞外多糖可以作为一种天然的食品添加剂,改善食品黏稠度、质地和风味等[4],因此被广泛应用于食品、医药等领域[5-7]。
目前,乳酸菌胞外多糖的产量普遍偏低,这也是制约着其大规模工业化生产的主要原因之一[8-9]。基于此,近年来,大多数研究都集中在如何进一步优化乳酸菌胞外多糖产量[10-12]。叶广彬等[13]采用响应面法优化柠檬明串珠菌TD1产胞外多糖条件,优化后产量是优化前的1.76倍。WANG等[14]对LactobacillusplantarumKX041合成胞外多糖的发酵条件进行响应面法优化,优化后,最大胞外多糖产量达到599.52 mg/L,是优化前的3倍。因此,优化菌株营养和培养条件是提高乳酸菌胞外多糖产量的重要途径。
本实验以提高胞外多糖产量为出发点,从课题组保藏的20株乳酸菌中筛选高产胞外多糖的乳酸菌,采用形态学、生理生化和分子生物学手段对菌株进行鉴定,同时,采用单因素和响应面实验进行优化,确定最佳发酵工艺条件,为乳酸菌胞外多糖的工业化生产提供一定的理论基础和技术手段。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
乳酸菌,江西农业大学微生物资源开发与利用实验室保藏。
1.1.2 培养基
MRS培养基:蛋白胨10.0 g/L,牛肉膏10.0 g/L,酵母膏5.0 g/L,葡萄糖20.0 g/L,柠檬酸氢二铵2.0 g/L,无水乙酸钠5.0 g/L,MgSO40.2 g/L,MnSO4·H2O 0.05 g/L,吐温-80 1.0 mL/L,pH 6.2~6.4,121 ℃高压灭菌,15 min。
改良MRS培养基:用蔗糖代替葡萄糖,其他同MRS培养基。
1.1.3 仪器与设备
JW-3022HR高速冷冻离心机,安徽嘉文仪器装备有限公司;721可见分光光度计,上海佑科仪器仪表有限公司;LRH-250-C培养箱,韶关市泰宏医疗器械有限公司; FEI Quanta 250型扫描电子显微镜,美国FEI。
1.2 实验方法
1.2.1 高产胞外多糖乳酸菌的筛选
将保藏于-80 ℃的20株乳酸菌接种于MRS培养基中进行活化,采取平板划线法将活化好的乳酸菌接种于改良的MRS固体培养基中,37 ℃培养24 h,观察菌落形态,选取菌落表面黏稠且可拉丝的单菌落[15],保藏于MRS培养基斜面,置于4 ℃冰箱保存。
将初筛获得的菌株接种于改良的MRS液体培养基中,37 ℃静置发酵24 h。取发酵液于10 000 r/min,4 ℃条件下离心15 min,取上清液加三氯乙酸至终质量分数4%,4 ℃反应12 h后,10 000 r/min,4 ℃条件下离心15 min,收集上清液,于上清液中加入3倍体积95%(体积分数)的乙醇溶液于4 ℃浸提12 h后在10 000 r/min,4 ℃条件下离心15 min,收集沉淀,用无水乙醇洗涤沉淀后,将沉淀用去离子水溶解定容,溶液用去离子水透析(8 000~14 000 Da)3 d,每8 h换一次水,透析结束后减压真空浓缩至原体积即为粗多糖溶液[16]。
采用硫酸-苯酚法[17]测定胞外多糖含量。从而确定高产胞外多糖的乳酸菌菌株。
1.2.2 高产胞外多糖乳酸菌的鉴定
菌株形态学鉴定、扫描电镜、生理生化特性分析、16S rDNA鉴定分别参考文献[18-21]进行。
1.2.3 单因素优化乳酸菌产胞外多糖条件
在MRS培养基的基础上,分别研究碳源(葡萄糖、果糖、蔗糖、乳糖、麦芽糖)、最佳碳源浓度(10、20、30、40、50 g/L)、氮源(酪蛋白、胰蛋白胨、大豆蛋白胨、蛋白胨、硫酸铵)、最佳氮源浓度(5、10、15、20、25 g/L)、发酵时间(18、24、30、36、42 h)、发酵温度(20、25、30、35、40 ℃)、发酵初始pH值(5.0、5.5、6.0、6.5、7.0)、接种量(2%、4%、6%、8%、10%(体积分数))等因素对乳酸菌胞外多糖产量的影响。
1.2.4 Plackett-Burman实验设计筛选发酵工艺条件显著因子
根据单因素的结果,使用Design-expert 8.0软件,选用19因素,20次实验次数的Plackett-Burman设计[22],采用Design-expert 8.0软件分析实验结果,确定显著因子。
1.2.5 响应面实验
根据Plackett-Burman实验设计结果,筛选出对出发菌株产胞外多糖影响显著的3个因子,以胞外多糖产量为响应值,根据中心组合设计原理,采用Design-Expert 8.0软件设计三因素五水平实验并进行显著性分析[23],确定最佳发酵工艺条件。
1.3 数据处理
每个实验重复3次,采用Design Expert 8.0软件进行Plackett-Burman和Central Composite Design实验设计及数据分析,图形绘制采用Origin 8.5软件,数据处理采用DPS 7.5软件;对不同处理间的数据比较采用单因素方差分析,Duncan法进行多重比较,图中不同小写字母表示处理间在P<0.05水平上差异显著。
2 结果与分析
2.1 高产胞外多糖乳酸菌筛选
将保藏的20株乳酸菌在改良的MRS固体培养基上平板划线,观察菌落特征,初筛结果如表1所示,选取其中6株菌落黏稠、有拉丝现象的菌株进行发酵培养,测定其胞外多糖产量进行复筛。复筛结果如图1所示。结果表明,其中1、2、6、10、16号5株菌的胞外多糖的产量基本都在550~800 mg/L之间,而LPC-1的胞外多糖产量可以达到1 060.39 mg/L,故选择LPC-1菌株作为出发菌株进行后续实验。

表1 产胞外多糖乳酸菌初筛结果Table 1 Preliminary screening results of exopolysacch-arides-producing lactic acid bacteria
注:“+”:是;“-”:否。

图1 产胞外多糖乳酸菌复筛结果Fig.1 Re-screening results of exopolysaccharides-producing lactic acid bacteria
2.2 菌株LPC-1的鉴定
2.2.1 形态学观察
菌株LPC-1在改良MRS固体培养基上37 ℃培养24 h后,菌落形态如图2所示,LPC-1菌落呈圆形、乳白色、边缘整齐光滑,表面湿润有光泽、黏稠、中央隆起、不透明。通过光学显微镜及扫描电镜观察显示,LPC-1菌体为革兰氏阳性,杆状,不形成芽孢。菌落形态及菌体照片如图2所示。

图2 LPC-1菌株菌落及菌体形态Fig.2 Colony morphologies and electron micrograph(8 000×) of strain LPC-1
2.2.2 生理生化鉴定
对LPC-1菌株进行生理生化特征分析,以干酪乳杆菌菌株为对照,结果如表2所示,LPC-1菌株过氧化氢酶、H2S实验、硝酸盐还原实验、明胶液化实验、吲哚实验表现为阴性,可以利用葡萄糖、果糖、蔗糖、麦芽糖、纤维二糖、乳糖、棉子糖、甘露糖、阿拉伯糖、蜜二糖等,不能利用鼠李糖,与植物乳杆菌的性质接近。

表2 菌株生理生化鉴定结果Table 2 Physiological and biochemical characters of strains
注:“-”表示阴性,“+”表示阳性。
2.2.3 分子生物学鉴定
对菌株LPC-1的16S rRNA序列进行扩增,获得大小约为1.5 Kb的扩增片段(GenBank登录号为MK722196),将序列提交GenBank做Blast同源性比对分析。结果显示,该序列与多株植物乳杆菌16S rRNA基因序列相似性为99%,绘制系统发育树结果如图3所示,结果发现LPC-1菌株与乳杆菌属在同一个分支,具有极高的同源性。根据形态特征、生理生化等微生物学特性及其遗传特性16S rDNA将菌株LPC-1初步鉴定为Lactobacillusplantarum。

图3 16S rDNA构建的菌株LPC-1系统发育树Fig.3 Phylogenetic tree based on the polygenetic analysisof 16S rDNA sequences showing the position ofstrain LPC-1
2.3 单因素对LPC-1胞外多糖产量的影响
2.3.1 碳源对LPC-1胞外多糖产量的影响
由图4-A所示,L.plantarumLPC-1均可以利用所添加的多种碳源,但胞外多糖产量各异,其中以蔗糖为碳源时,胞外多糖产量最高为1 080.86 mg/L,其次,分别为麦芽糖、葡萄糖和果糖,乳糖最低,因此选择蔗糖作为L.plantarumLPC-1合成胞外多糖的最佳碳源。DESAI等[24]从印度发酵穇子中筛选得到1株L.plantarum,研究发现其产胞外多糖的最佳碳源为乳糖。而姜云芸等[25]对植物乳杆菌K25产胞外多糖影响因素发现,以葡萄糖为碳源时,其胞外多糖产量达到最大,可达235.4 mg/L。以上说明植物乳杆菌产胞外多糖对优势碳源的需求存在一定的菌株差异性。
不同蔗糖浓度对L.plantarumLPC-1产胞外多糖的影响如图4-B所示,随着蔗糖浓度的增加,胞外多糖的产量先增加后降低,当蔗糖质量浓度为30 g/L时,胞外多糖产量达到最大1 268.19 mg/L,所以选择蔗糖质量浓度为30 g/L作为L.plantarumLPC-1产胞外多糖的最佳碳源浓度。

图4 不同碳源和碳源浓度对L. plantarum LPC-1胞外多糖产量的影响Fig.4 Effects of different carbon sources and concentra-tions on the yield of EPS from L. plantarum LPC-1
2.3.2 氮源对LPC-1胞外多糖产量的影响
如图5-A所示,当以大豆蛋白胨为氮源时,胞外多糖产量达到最大为1 302.03 mg/L,所以选择大豆蛋白胨为最佳氮源进行下一步实验。刘晶等[26]从芬兰传统发酵乳制品中分离得到的LactobacillusparacaseiVL8,利用大豆蛋白胨为氮源,其产胞外多糖产量达到最大,与本研究结果相一致。
不同大豆蛋白胨浓度对L.plantarumLPC-1胞外多糖产量的影响如图5-B所示,当大豆蛋白胨为10 g/L时,L.plantarumLPC-1胞外多糖产量最大,为1 309.12 mg/L,过高或过低的碳氮比均会降低胞外多糖的产量,所以选择大豆蛋白胨质量浓度为10 g/L作为L.plantarumLPC-1产胞外多糖的最佳氮源浓度。

图5 不同氮源和氮源浓度对L. plantarum LPC-1胞外多糖产量的影响Fig.5 Effects of different nitrogen sources and concentr-ations on the yield of EPS from L. plantarum LPC-1
2.3.3 发酵时间和温度对LPC-1胞外多糖产量的影响
如图6-A所示,当发酵时间达24 h时,胞外多糖产量达到最大,随着发酵时间的延长,胞外产量逐渐降低,可能是由于发酵后期营养物质消耗和菌体产生降解多糖的酶。廖乾伟等[27]研究发现乳酸菌SR2-2胞外多糖随着时间的延长而增加,在24 h达到最大值463.64 mg/L,随后胞外多糖产量逐渐降低,与本实验的L.plantarumLPC-1发酵条件相符合。
发酵温度对L.plantarumLPC-1胞外多糖产量的影响如图6-B所示,胞外多糖产量随着温度升高而增加,当温度为30 ℃时,胞外多糖产量最高,温度再升高时,胞外多糖产量有所下降。冯小婉等[28]研究发现植物乳杆菌AR307产胞外多糖最佳温度为32 ℃,与本研究结果较为相似。

图6 不同发酵时间和温度对L. plantarum LPC-1胞外多糖产量的影响Fig.6 Effects of different fermentation time and temper-ature on the yield of EPS from L. plantarum LPC-1
2.3.4 初始pH和接种量对L.plantarumLPC-1胞外多糖产量的影响
由图7-A可知,初始pH值对L.plantarumLPC-1合成胞外多糖的影响较大,L.plantarumLPC-1合成胞外多糖的初始pH值为6.5时,即弱酸性条件,L.plantarumLPC-1胞外多糖产量达到最高。王英等[29]对干酪乳杆菌FM10-3的发酵产胞外多糖的pH研究也得到了相同的结论。
接种量对L.plantarumLPC-1胞外多糖产量的影响如图7-B所示,当接种量为4%(体积分数)时,L.plantarumLPC-1胞外多糖达到最高,为1 670.00 mg/L。随着接种量的增加,胞外多糖产量逐渐降低。冯美琴等[22]对植物乳杆菌70810产胞外多糖优化发现,接种量为5%(体积分数)时有利于胞外多糖的合成,与本研究结果略有差异,可能与菌株差异性有关。
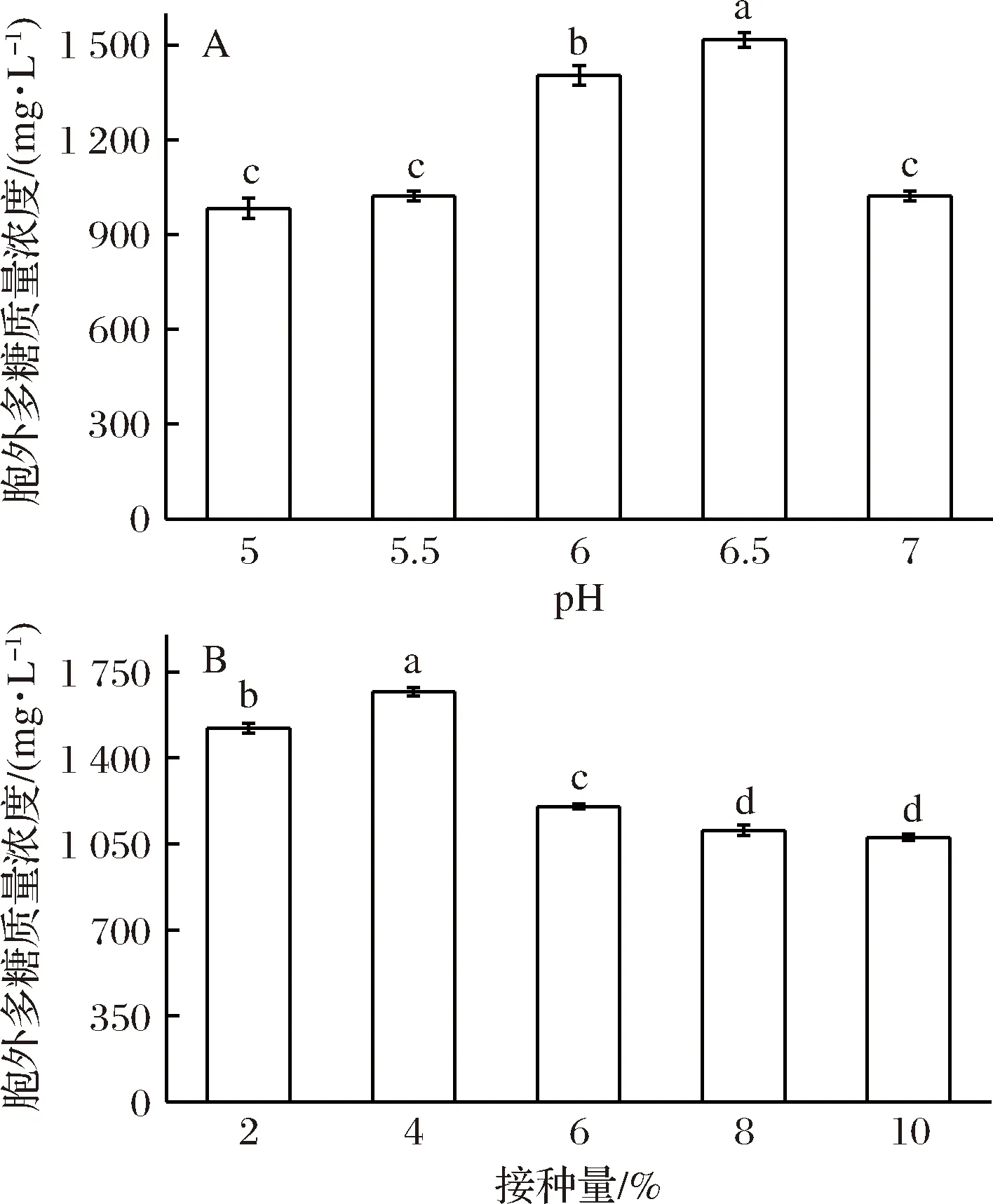
图7 不同pH值和接种量对L. plantarum LPC-1胞外多糖产量的影响Fig.7 Effects of different pH and inoculum concentrationon the yield of EPS from L. plantarum LPC-1
2.4 Plackett-Burman筛选发酵工艺条件显著因子结果
Plackett-Burman实验设计及结果如表3所示,利用Design-expert 8.0软件对结果进行方差分析结果如表4所示,经过分析可以得到胞外多糖产量一阶模型:
Y=1 224.38+19.44X1-33.88X2-46.88X3-56.30X4+14.90X5-26.49X6+140.12X7+9.62X8-43.18X9+17.54X10-3.19X11+180.03X12+165.92X13+4.69X14

2.5 中心组合实验设计结果
根据Plackett-Burman实验筛选出的3个显著因子(温度、pH、柠檬酸氢二铵)进行三因素五水平的中心组合实验考察,测定胞外多糖产量,实验结果如表5所示,采用Design-expert 8.0 软件获得拟合方程:
其中,y为胞外多糖产量,x1、x2、x3分别为温度、pH值、柠檬酸氢二铵的编码值。

表3 Plackett-Burman实验设计与响应值Table 3 Plackett-Burman design matrix and results

表4 Plackett-Burman实验方差分析Table 4 Analysis of variance for the Plackett-Burmandesign

表5 中心组合实验设计与响应值Table 5 Central composite design(CCD) matrix andresults


表6 中心组合试验方差分析Table 6 Analysis of variance for the central compositedesign
通过Design-expert 8.0 软件分析可知,L.plantarumLPC-1合成胞外多糖的最佳发酵工艺条件为:温度31.71 ℃、pH值6.68、柠檬酸氢二铵3.26 g/L,在此条件下发酵所得胞外多糖质量浓度理论值为2 069.18 mg/L,根据实际可行操作情况,将发酵条件修正为温度32 ℃、pH值6.7、柠檬酸氢二铵 3 g/L,采取上述优化条件进行3次重复实验,结果测得胞外多糖平均质量浓度为2 064.69 mg/L,与预测值基本一致。
3 结论
本实验从20株乳酸菌中筛选出1株高产胞外多糖的乳酸菌LPC-1,经鉴定为植物乳杆菌(Lactobacillusplantarum)。本研究从碳源、氮源、发酵时间、温度、pH值、接种量对合成胞外多糖影响的单因素基础上联合Plackett-Burman实验和Central-Composite实验方法,通过显著性分析及响应面分析,得到最优发酵工艺条件为:温度32 ℃、pH值6.7、柠檬酸氢二铵3 g/L,在此条件下发酵测得实际质量浓度为2 064.69 mg/L,与预测值基本吻合,与优化前相比增加了48.64%。
据报道,乳酸菌胞外多糖的产量一般都在50~800 mg/L左右,优化后也很少达到1 000 mg/L,本实验筛选得到的L.plantarumLPC-1优化前胞外多糖质量浓度达到1 060.39 mg/L,最终优化后,其胞外多糖质量浓度达到2 064.69 mg/L,与现如今报道的乳酸菌胞外多糖产量相比,本实验筛选得到的L.plantarumLPC-1胞外多糖产量较高,具有较大的研究价值。

