一种复合微生态制剂发酵条件优化及其对刺参养殖水体水质的影响
王 宇 翕, 芦 士 杰, 肖 珊,2, 刘 冰 南, 王 际 辉,2
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.东莞理工学院 化学工程与能源技术学院, 广东 东莞 523808 )
0 引 言
近年来,随着刺参养殖业的飞速发展,水产养殖密度的不断增加,残余饵料、粪便、代谢产物等给养殖环境带来了巨大压力,造成了刺参的存活率和产量的降低[1]。传统刺参育苗过程中,人们通过频繁换水来改善水质,但其成本高、持续时间短且容易造成刺参的应激反应,会对刺参生长造成影响;而使用抗生素则会使刺参产生抗药性,同时造成抗生素残留,对人体造成危害[2]。因此,绿色健康的养殖模式成为刺参养殖业的当务之急,在养殖中应用微生态制剂越来越受到认可。
水产用微生态制剂可分为单一菌株微生态制剂和复合菌株微生态制剂两大类。目前,在水产养殖中常用的有益微生态制剂主要有芽孢杆菌(Bacillus)、乳酸杆菌(Lactobacillus)、酵母菌(Saccharomyces)、光合细菌(Photosyntheticbacteria)以及硝化细菌(Nitrifyingbacteria)等[3]。研究结果表明,乳酸菌和酵母菌等能提供给水生动物更多养分,芽孢杆菌则能更好地改善水质[4]。
混合发酵一般指两种或两种以上微生物进行发酵的过程。虽然菌体间的相互作用复杂,但对于特定产物的获得非常重要[5]。研究表明,混合发酵能够弥补单一菌株培养时的缺陷,如纯培养过程中稳定生长期过后生物量下降,混合发酵反而能提高菌体生物量。同时,实验结果表明,混合培养过程中菌体间的相互作用能抑制菌体生长,却能提高菌体的代谢能力[6]。
本实验应用3种菌混合发酵制备复合微生态制剂,前期的实验结果表明,该复合微生态制剂的净水效果好于单菌和两种菌混合发酵制备的复合微生态制剂。本实验确定了3种菌混合发酵的最适培养基和培养条件,探究其对刺参养殖水体水质和菌群结构的影响,以期为复合微生态制剂的生产和应用提供理论依据。
1 材料与方法
1.1 主要试剂及仪器
蛋白胨、牛肉膏、酵母膏、酵母浸粉,生化试剂,北京奥博生物技术责任有限公司;黄豆粉,食品级;蛋白胨、胰蛋白胨均为生化试剂,天津科密欧化学试剂有限公司;其他试剂均为分析纯,天津市科密欧化学试剂有限公司。
1.2 菌 种
芽孢杆菌、乳酸菌,均从大连地区海泥中筛选得到;酵母菌,实验室保藏。
1.3 培养基
芽孢杆菌种子液培养基:胰蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠10 g/L,蒸馏水1 L,pH(6.9±0.1)。
乳酸菌种子液培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉膏10 g/L,酵母膏5 g/L,K2HPO42 g/L,MnSO40.05 g/L,乙酸钠0.5 g/L,柠檬酸三铵2 g/L,MgSO40.2 g/L,吐温80 1 mL,蒸馏水1 L,pH 6.2~6.4。
酵母菌种子液培养基:葡萄糖20 g/L,蛋白胨10 g/L,酵母膏10 g/L,自然pH。
1.4 实验方法
1.4.1 培养基组分优化
分别对培养基组分进行碳源、氮源及无机盐优化[7]。将3株乳酸菌、2株芽孢杆菌、1株酵母菌种子液等比例接种到不同初始发酵培养基中(总接种量5%),在30 ℃、180 r/min振荡培养48 h,采用稀释涂布平板法测定活菌数。
1.4.2 培养条件优化
分别对接种量、初始pH、装液量、摇床转速以及温度进行优化[8]。
1.5 刺参养殖实验
实验分空白组和实验组,实验组3组梯度投菌量分别为1、5、10 mL/m3,每组均设5个平行;盐度0.3%,pH 7.5,每缸装海水20 L,每组投放刺参约30头,重约200 g。
养殖海水均为自然海水,盐度0.30%~0.34%,水温15~25 ℃。第一周为预饲养,均不投放菌液,适量投饵,让幼参适应环境。每日下午投饵(17:00),饲料、海泥质量比为1∶2或1∶3,投饵量为刺参质量的2%。充氧时间为每给氧30 min停氧15 min。每日泼洒一次微生态制剂,在泼洒菌剂前取水样,测定水质。每3 d换半缸水,每7 d换一整缸水,实验周期为30 d[9]。
1.6 水质指标
1.6.1 化学需氧量(COD)的测定
取水样100 mL于250 mL锥形瓶中,加入1 mL 氢氧化钠溶液摇匀,加入10 mL高锰酸钾溶液后摇匀;于电热板上加热至沸腾,准确煮沸10 min(从冒出第一个气泡时开始计时),迅速冷却到室温;用定量加液器加入5 mL硫酸溶液,再加入0.5 g碘化钾,摇匀,于暗处放置5 min。不断振荡,用已标定的硫代硫酸钠标准溶液滴定至溶液呈淡黄色,加入1 mL淀粉溶液,继续滴定至蓝色刚褪去,记下滴定数V1。两平行样滴定读数相差不超过0.10 mL;另取100 mL重蒸馏水代替水样,重复上述步骤,根据GB 17378.4—2007分析空白滴定值V2。计算公式为
式中:COD为水样的化学需氧量,mg/L;c为硫代硫酸钠的浓度,mol/L;V2为分析空白值滴定消耗硫代硫酸钠的体积,mL;V1为滴定样品时硫代硫酸钠体积,mL;V为水样体积,mL。
1.6.2 硫化物含量测定
取一定体积现场采集并固定的水样于分液漏斗中(样品应确保硫化物沉淀完全,取样时应充分摇匀),静置,待沉淀于溶液分层后将沉淀部分放入10 mL具塞比色管中,加水至6 mL。取2支10 mL具塞比色管,各加入2 mL乙酸锌-乙酸钠溶液,加入待测样本,沿比色管壁缓慢加入1 mL N,N-二甲基对苯二胺溶液,立即密塞并缓慢倒转一次,加入0.1 mL硫酸铁铵溶液,立即密塞并充分摇匀。放置10 min后,在波长665 nm处测量吸光度。测定的吸光度扣除空白试验的吸光度后,参照GB/T 16489—1996计算硫化物含量。
1.6.3 氨氮含量的测定
取水样8 mL于10 mL比色管中,加入1 mL水杨酸显色剂和2滴亚硝基铁氰化钠,混匀。再滴入2滴次氯酸钠使用液并混匀。显色60 min后,参照HJ 536—2009测定697 nm处吸光度。
1.7 水体菌群的测定
水体菌群采用高通量测序方法[10],主要步骤:DNA提取、PCR扩增、荧光定量、Miseq文库构建、Miseq测序[11],委托北京诺禾致源公司测序。
2 结果与讨论
2.1 培养基组分优化
2.1.1 碳源优化
由图1可以看出,4种常用碳源葡萄糖、可溶性淀粉、乳糖、麦芽糖中,葡萄糖和淀粉为最佳碳源,其活菌数为1.42×109和1.31×109cfu/mL。因此,选择葡萄糖和可溶性淀粉作为最佳碳源。
微课是教学的辅助资源,要充分发挥它的功用,必须根据教学内容,联系教学实际,科学地应用在教学活动中,突出其实用性。以培养学生的平面设计能力为核心目标的微课学习,通过教师精心设计教学过程,突出在教师指导下的学生感悟、探究,可以提升课堂的教学效果,从而形成符合苏州高等职业技术学校实际的、能促进师生共同成长的课堂教学模式[3-4]。
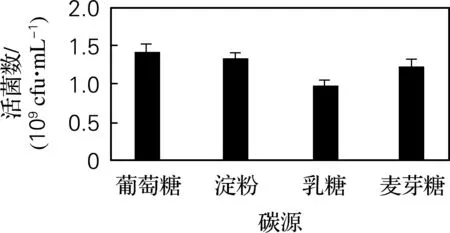
图1 碳源优化结果
2.1.2 氮源优化结果
选择蛋白胨、牛肉膏、黄豆粉、尿素、硫酸铵5种常见氮源,确定3种菌混合发酵的最佳氮源。如图2所示,有机氮源利用率高于无机氮源,这可能是部分菌株产生的蛋白酶,使有机氮源水解为更容易被利用的小分子化合物。以蛋白胨、牛肉膏为氮源的菌液活菌数达1.24×109和1.41×109cfu/mL,高于其他氮源。因而选择蛋白胨和牛肉膏为氮源。
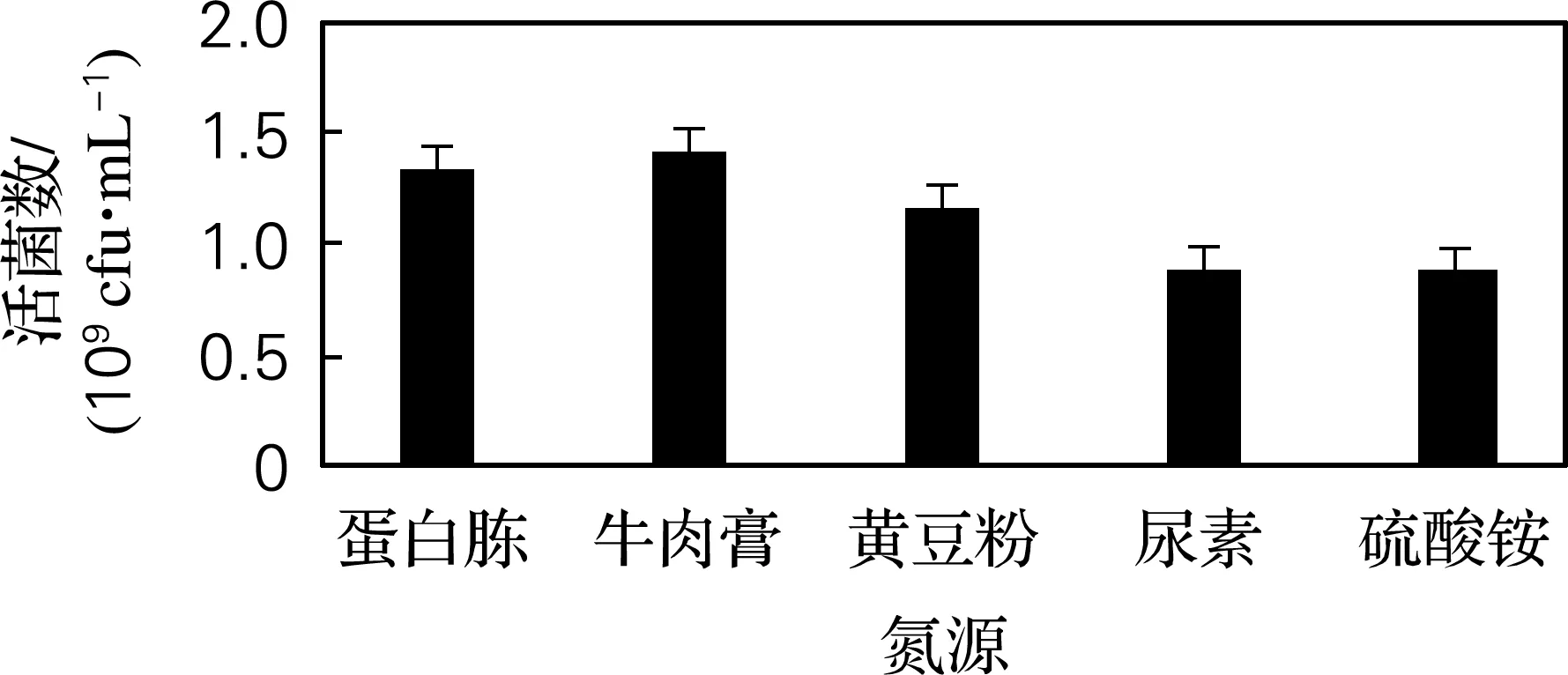
图2 氮源优化结果
2.1.3 无机盐优化结果
无机盐优化结果如图3所示,分别在去除醋酸钠、K2HPO4、MnSO4、MgSO4条件下培养,活菌数仅为对照组的一半,因而,确定这4种无机盐不可缺少。

图3 去无机盐优化结果
2.2 培养条件优化
2.2.1 接种量优化结果
混合菌分别按1%、3%、5%、9%接种,在30 ℃、180 r/min振荡培养48 h,结果如图4所示。当接种量为9%时,活菌数1.6×109cfu/mL最高,因而确定最佳接种量为9%。
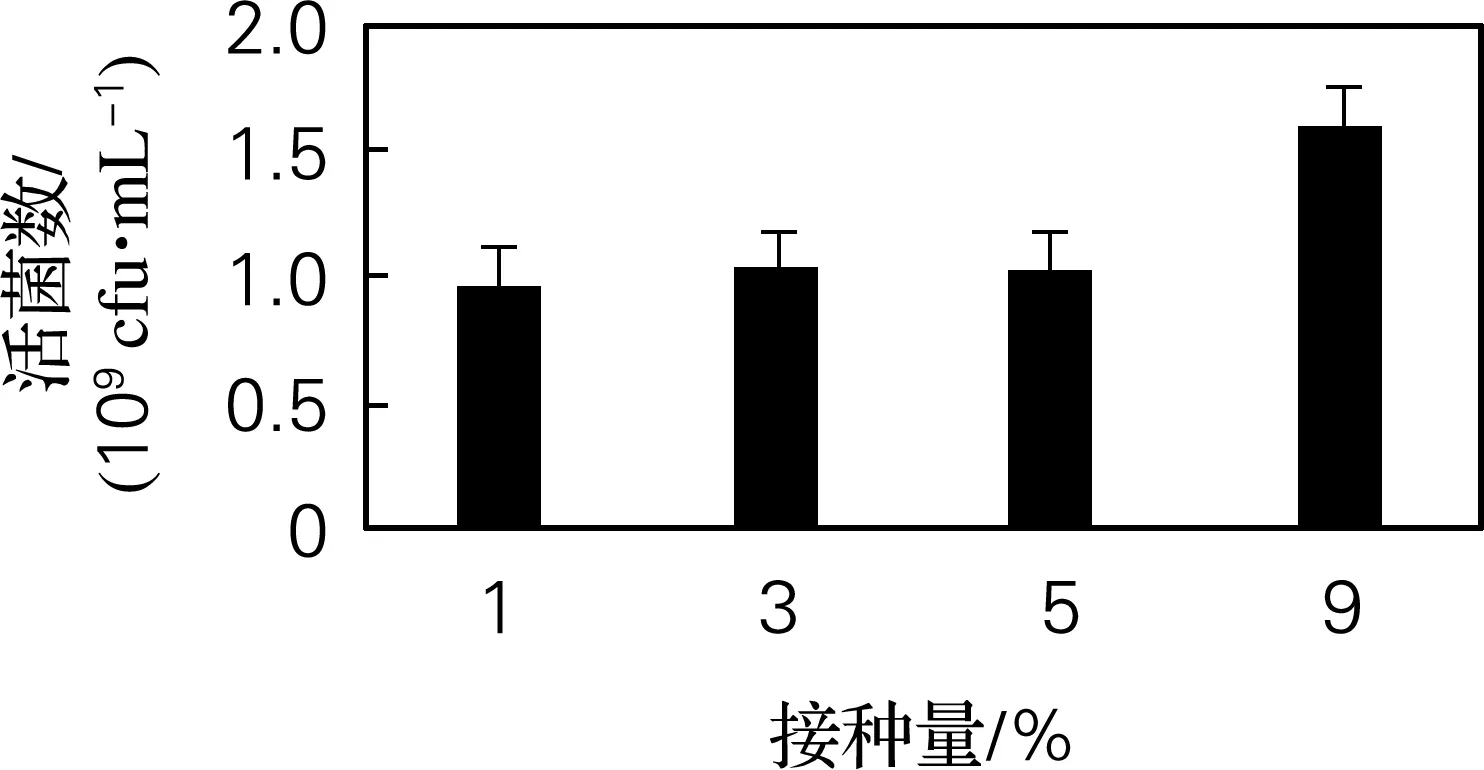
图4 接种量优化结果
2.2.2 初始pH优化结果
2.2.3 装液量优化结果
在250 mL锥形瓶中分别装入混合菌液25、50、75、100 mL,在接种量5%、转速180 r/min、25 ℃ 培养2 d。如图6所示,在装液量为100 mL时,活菌数最高,因而确定每 250 mL装液100 mL 为最佳装液量。
2.2.4 转速优化结果
摇床转速分别设定为100、150、180、200 r/min,
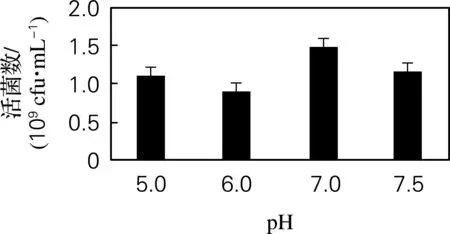
图5 初始pH优化结果
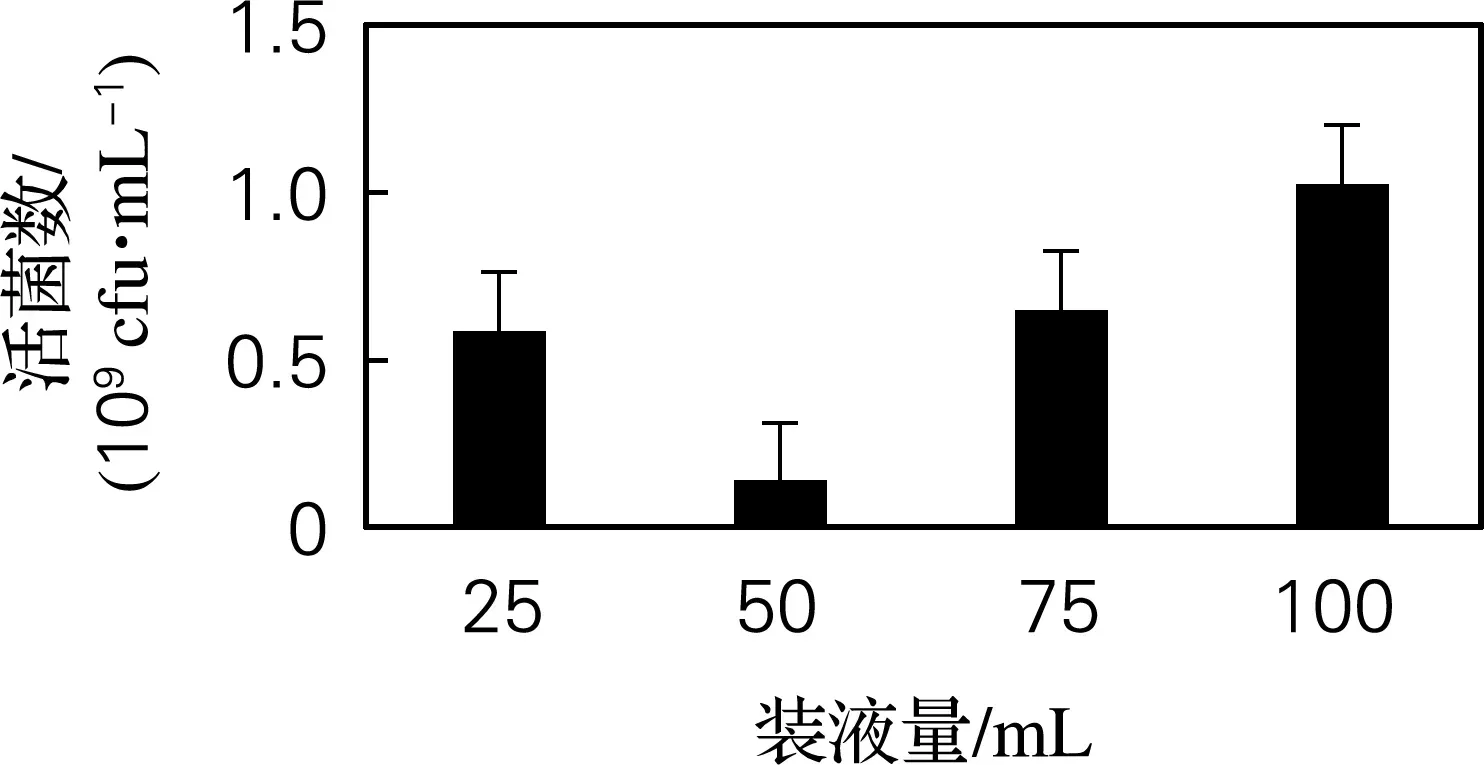
图6 装液量优化结果
在30 ℃振荡培养48 h,采用稀释涂布平板法测定活菌数。由图7可以看出,在200 r/min条件下混合发酵得到的活菌数最高,因而确定200 r/min为最佳转速。
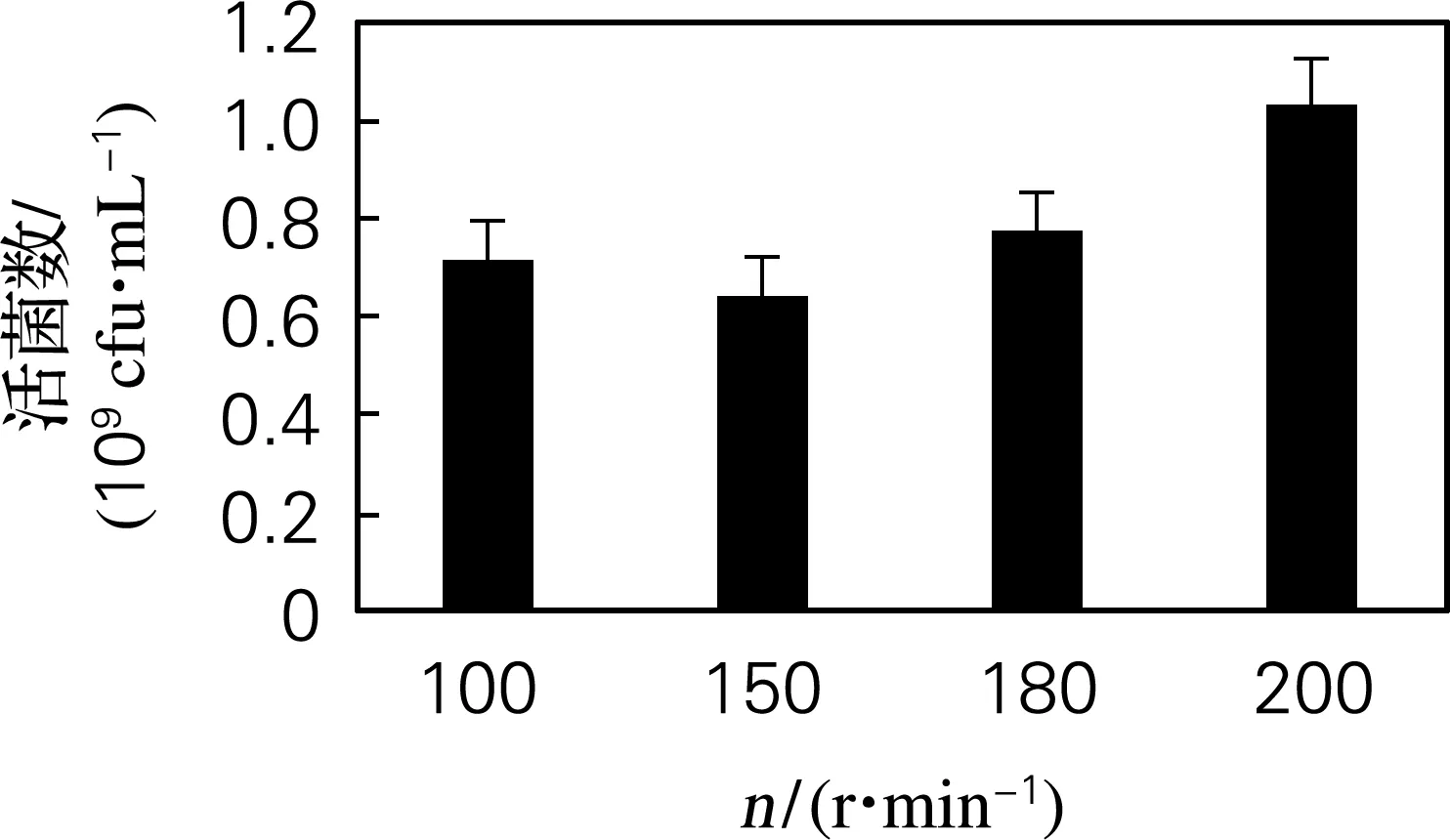
图7 转速优化结果
2.2.5 温度优化结果
混合菌分别在初始温度为20、25、30、35 ℃的发酵培养基中,180 r/min振荡培养48 h,测定其活菌数。由图8可以看出,在发酵温度为25 ℃时,活菌数最高,随着温度的升高,活菌数逐渐下降,因而确定25 ℃为最佳发酵温度。
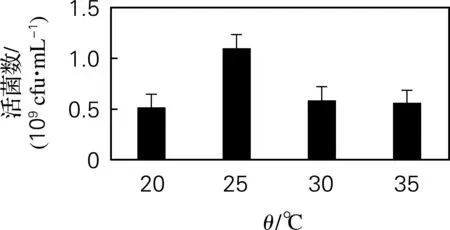
图8 温度优化结果
综上所述,在针对发酵培养基及发酵条件的优化中,确定了葡萄糖15 g,淀粉10 g,蛋白胨5 g,牛肉膏10 g,乙酸钠5 g,柠檬酸三铵2 g,K2HPO40.15 g,MnSO40.05 g,海水1 L,接种量9%,每250 mL装液100 mL,温度25 ℃,初始pH 7.0,摇床转速200 r/min。在此条件下测得活菌数为3.54×109cfu/mL,是优化前的2倍。
2.3 微生态制剂对刺参养殖水体水质的影响
2.3.1 硫化物测定
如表1所示,该微生态制剂对硫化物的清除效果不明显,清除效果最佳的为5 mL/m3投菌量的实验组,清除率也仅达到5.34%。
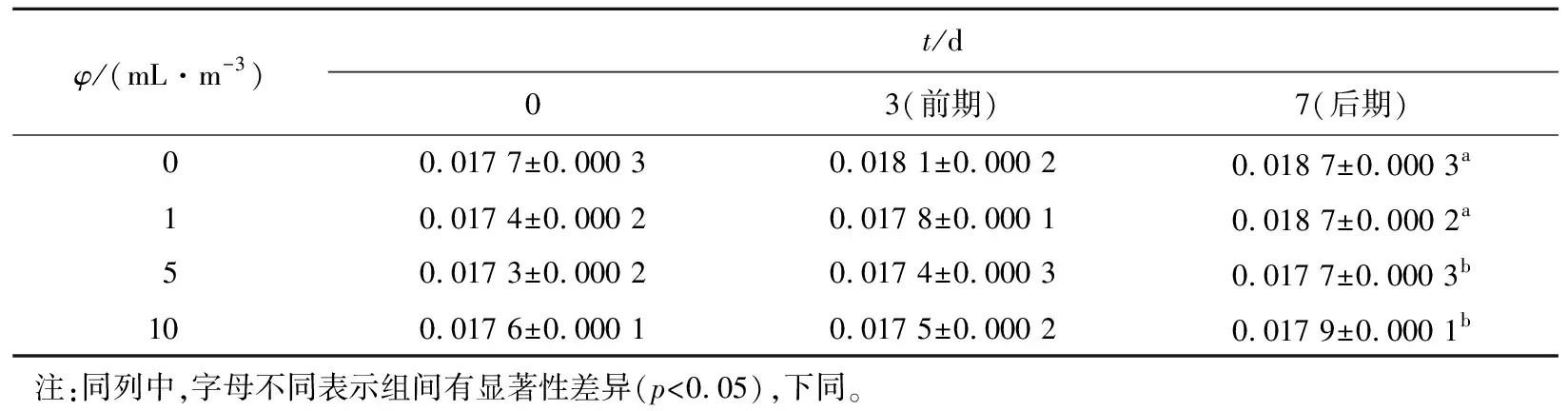
表1 复合微生态制剂对水体中硫化物的影响
2.3.2 氨氮含量的测定
如表2所示,该微生态制剂对于养殖水体有明显的氨氮清除能力。在第3天时,投喂1、5、10 mL/m3复合微生态制剂的清除率分别为31.5%、40.1%、27.9%,第7天清除率分别为30.1%、38.5%、36.0%,可以看出5 mL/m3投菌量的氨氮清除效果最佳。

表2 复合微生态制剂对水体中氨氮的影响
2.3.3 化学需氧量(COD)测定结果
如表3所示,投菌后,实验组的化学需氧量的积累显著低于对照组,且在第7天清除率分别为23.1%、25.0%、18.5%,表明该微生态制剂对COD具有清除能力,且5 mL/m3水体为该复合微生态制剂的最佳投菌量。
2.3.4 水体菌群的测定
如图9所示,在门水平上,前期水体的主要菌群结构包括变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)(图9(a))。其中变形菌门为优势菌群。在养殖后期(图9(b)),水体中变形菌门增长,且有少量的疣微菌门(Verrucomicrobia)出现,疣微菌门是一门被划出不久的菌门,包括少数几个被识别的种类,主要存在于水生和土壤环境[12]。刘兵兵[13]在对水质净化与微生物相互作用关系的研究中发现,变形菌门和拟杆菌门对水质有较好的指示作用。该研究发现变形菌门的微生物比例增多有利于氨氮的清除,拟杆菌门微生物比例增多有利于COD的清除。本实验结果也表明,养殖水体后期变形菌门比例增加,可能导致水体中氨氮浓度的降低。同时,不同投菌浓度下拟杆菌门比例不同程度下降也与COD清除能力由强到弱一致。武鹏等[14]在养殖水体中泼洒3种微生态制剂(包括免疫增强剂、复合芽孢杆菌和EM菌),结果表明芽孢杆菌对水体净水效果明显;此外,盖建军等[15]选择EM菌、光和细菌、乳酸菌和芽孢杆菌作为实验对象,探究在短时间内养殖水质的影响,也证明了芽孢杆菌具有良好的净水能力。前期的实验结果表明,该复合微生态制剂中芽孢杆菌的比例为80%左右(未发表的数据)。因而,本实验中复合微生态制剂具有的净水能力与所含有高浓度的芽孢杆菌有关。
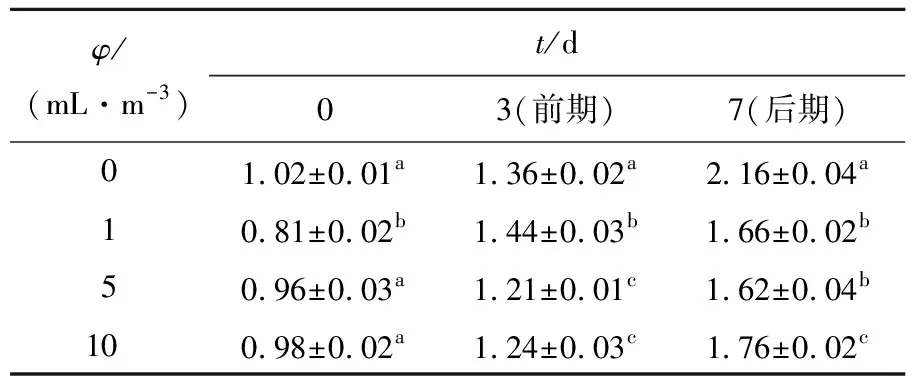
表3 复合微生态制剂对水体中COD的影响

(a) 前期
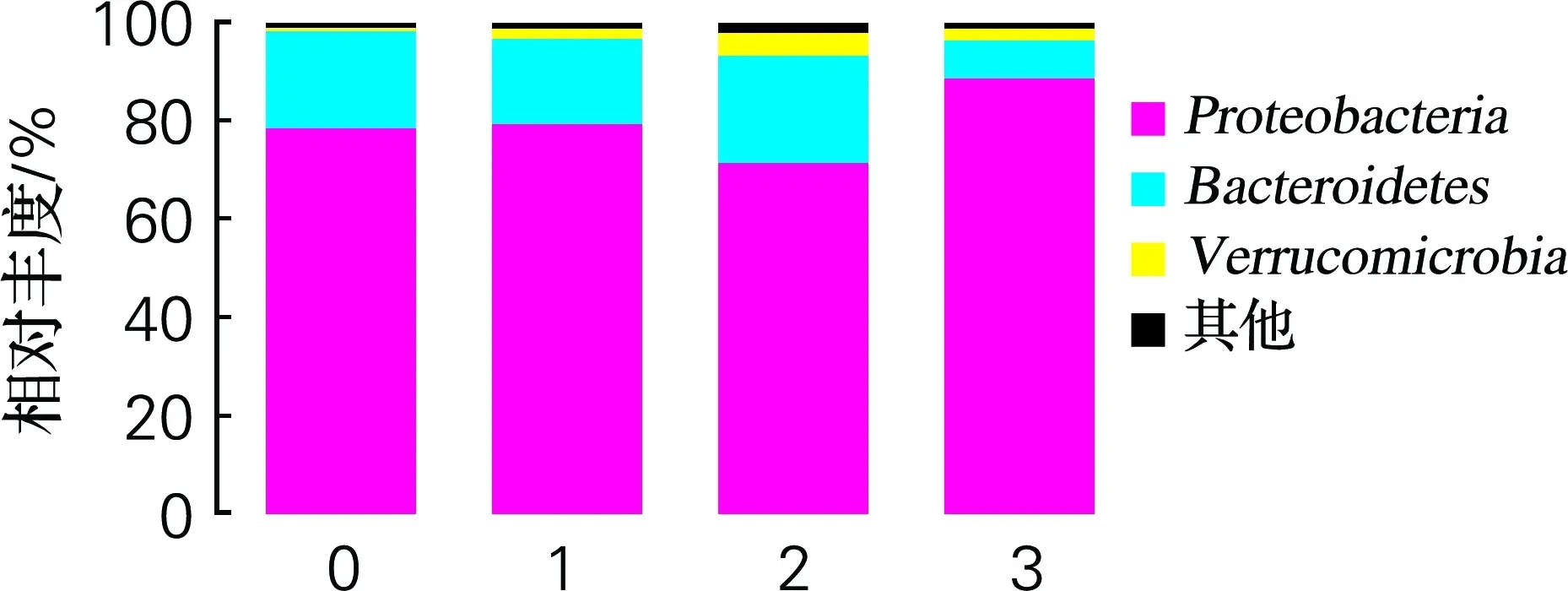
(b) 后期
0,空白组;1,投菌量1 mL/m3;2,投菌量5 mL/m3;3,投菌量10 mL/m3
图9 养殖水体中投喂复合微生物制剂前后期的菌群分析
Fig.9 Community analysis of microflora before and after feeding compound probiotic in aquaculture water
3 结 论
通过单因素实验确定了由6种菌混合培养的复合微生态制剂的最佳培养基配方:葡萄糖15 g/L,可溶性淀粉10 g/L,蛋白胨5 g/L,牛肉膏10 g/L,乙酸钠5 g/L,柠檬酸三铵2 g/L,K2HPO40.15 g/L,MnSO40.05 g/L,蒸馏水1 L。接种量9%(每株菌等比例混合),加液量为每250 mL瓶装液100 mL,温度25 ℃,初始pH 7.0,摇床转速200 r/min。得到活菌数为3.54×109cfu/mL,是优化前的2倍。
对刺参养殖水体的水质(氨氮含量、硫化物含量、COD)、水体菌群进行测定,结果表明该微生态制剂对硫化物的清除作用不显著,而对氨氮含量、COD具有清除作用,清除率最高分别可达到40.1%和25.0%。在投菌量为5 mL/m3时,该复合微生态制剂有显著净水能力。

