miR-132-3p靶向调控Gab2抑制胃癌细胞增殖、迁移及侵袭分子机制的研究
汪根良, 华崇俊, 张向明, 范红娟
汪根良, 华崇俊, 张向明, 范红娟, 金华市中心医院金西院区婺城区第一人民医院内科 浙江省金华市 321075
核心提要: miR-132-3p在胃癌中表达下调, Gab2表达上调,双荧光素酶报告实验证实miR-132-3p能够靶向调控Gab2基因, miR-132-3p过表达可通过干扰Gab2表达从而抑制胃癌细胞增殖、迁移及侵袭.
0 引言
胃癌(gastric cancer, GC)是临床常见恶性肿瘤之一, 近年来, 我国GC发病率逐年上升, 由于GC早期症状较为隐匿导致患者确诊时已处于进展期或晚期导致患者预后不良[1].目前GC发病机制尚未阐明, 因而探究GC发病机制及其相关分子标志物有助于提高治疗效果及改善患者预后.miRNA可通过下调靶基因表达从而参与肿瘤发生及发展过程, 研究表明部分miRNA在GC中异常表达并可能作为GC诊断及治疗的潜在靶点[2-4].miR-132-3p在膀胱癌细胞中呈低表达, 环状RNA DOCK1可通过靶向抑制miR-132-3p表达进而促进膀胱癌进展[5].研究表明miR-132-3p在GC中表达下调并可增加GC发生风险[6,7].但miR-132-3p在GC发生及发展过程中的作用机制尚未阐明.Starbase靶基因预测显示Gab2可能是miR-132-3p的靶基因, 研究表明Gab2在结直肠癌细胞中表达上调并可促进肿瘤细胞增殖、迁移及侵袭[8].但miR-132-3p是否可通过调控Gab2表达从而参与GC发生及发展过程尚未可知.本研究分析miR-132-3p、Gab2在GC中的表达情况, 探究miR-132-3p过表达对GC细胞增殖、迁移及侵袭能力的影响, 通过双荧光素酶报告实验检测miR-132-3p对Gab2的靶向调控作用, 分析miR-132-3p影响GC增殖、迁移及侵袭的可能分子机制.
1 材料和方法
1.1 材料 人正常胃黏膜上皮细胞系GES1与人GC细胞系SGC-7901、MKN45、BGC-823均购自美国ATCC公司.杜氏改良培养基(DMEM)、胎牛血清与胰蛋白酶购自美国Gibco公司; Lipofectamine2000与Trizol购自美国Invitrogen公司; 反转录试剂盒、荧光定量聚合酶链式反应(polymerase chain reaction, PCR)试剂盒购自北京天根生化科技有限公司; miR-132-3p模拟物(mimics)及其阴性对照(miR-NC)、miR-132-3p特异性寡核苷酸抑制剂(anti-miR-132-3p)及其阴性对照(antimiR-NC)购自广州锐博生物科技有限公司; pcDNA3.1购自上海索宝生物科技有限公司; 甲基噻唑基四唑(methylthiazolyl tetrazolium, MTT)购自北京鼎国昌盛生物技术有限责任公司; Transwell小室购自上海宇进生物科技有限公司; Matrigel基质胶购自美国BD公司; RIPA裂解液购自北京全式金生物技术有限公司; 二喹啉甲酸(bicinchoninicacid, BCA)蛋白定量检测试剂盒购自美国Sigma-Aldrich公司; 兔抗人Gab2抗体购自上海士锋生物科技有限公司; 兔抗人细胞周期蛋白1(CyclinD1)、神经型钙黏蛋白(N-cadherin)、P21、上皮型钙黏蛋白(E-cadherin)抗体购自美国Santa Cruz公司; 辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自武汉博士德生物工程有限公司.
1.2 方法
1.2.1 细胞转染及实验分组:人正常胃黏膜上皮细胞系GES1与GC细胞系SGC-7901、MKN45、BGC-823放入含有10%胎牛血清的DMEM培养基培养, 置于37 ℃、5%CO2培养箱培养, 细胞传代培养.取对数生长期BGC-823细胞, 0.25%胰蛋白酶消化后制备细胞悬液, 接种于6孔板, 待细胞生长融合至70%时进行转染, 实验分组:NC组(未进行转染的BGC-823细胞)、miR-NC组(miRNC转染至BGC-823细胞)、miR-132-3p组(miR-132-3p mimics转染至BGC-823细胞)、miR-132-3p+pcDNA组(miR-132-3p mimics与pcDNA共转染至BGC-823细胞)、miR-132-3p+pcDNA-Gab2组(miR-132-3p mimics与pcDNA-Gab2共转染至BGC-823细胞), 严格按照Lipofectamine2000说明书进行转染, 各组细胞转染前2 h更换为不含血清的培养基, 转染6 h后更换为DMEM完全培养基, 继续培养48 h收集细胞.
1.2.2 实时荧光定量PCR检测细胞中miR-132-3p、Gab2mRNA的表达水平:采用Trizol法提取GES1、SGC-7901、MKN45、BGC-823与转染后BGC-823细胞总RNA, 应用Nanodrop2000c超微量分光光度计检测RNA浓度, 选取RNA OD260/OD280处于1.8-2.0之间.根据反转录试剂盒将RNA反转录为cDNA.miR-132-3p正向引物5'-TTAAATGTCACTCCCCGCCT-3', 反向引物5'-TGCCCATTTCTCTTCCTCGT-3'; U6正向引物5'-GCTTCGGCAGCACATATACT-3', 反向引物5'-GTGCAGGGTCCGAGGT ATTC-3';Gab2正向引物5'-GTGGGGGATCTGAATGTTTTTATG-3', 反向引物5'-GCCCCAGGGTAGAATGAAACG-3'; GAPDH正向引物5'-GAAGGTGAAGGTCGGAGTC-3', 反向引物5'-GAAGATGGTGATGGGATTTC-3'.引物由上海生工生物工程股份有限公司设计合成.参照荧光定量PCR试剂盒配置实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)反应体系, 置于ABI 7500荧光定量PCR仪检测miR-132-3p、Gab2mRNA相对表达量, 反应条件:95 ℃2 min, 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40次循环.miR-132-3p以U6为内参, Gab2以GAPDH为内参, 采用2-ΔΔCt法计算miR-132-3p、Gab2mRNA的表达水平.
1.2.3 MTT检测细胞增殖:收集各组转染后的BGC-823细胞接种于96孔板(100 μL/孔), 每组设置3个复孔, 于转染48 h时每孔加入MTT溶液20 μL(质量浓度5 mg/mL),置于37 ℃恒温培养箱培养4 h, 离心5 min(室温条件下,1300 r/min转速)后弃上清, 每孔加入150 μL二甲基亚砜,室温避光孵育5 min, 应用酶标仪检测各孔吸光度值, 计算细胞存活率(%) = (各实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)×100%.实验重复3次.
1.2.4 Transwell实验检测细胞迁移与侵袭:细胞迁移实验:收集各组BGC-823细胞(5×104个/mL)接种于Transwell小室的上室(200 μL/孔), Transwell小室的下室加入含有10%胎牛血清的培养液(600 μL/孔), 置于37 ℃恒温培养箱培养24 h, PBS洗涤, 多聚甲醛固定20 min, PBS洗涤, 0.1%结晶紫染液染色10 min, 显微镜下观察迁移细胞数.细胞侵袭实验:采用培养液(4 ℃)稀释Matrigel基质胶, 取Matrigel基质胶稀释液加入Transwell小室的上室(40 μL/孔), 后续实验步骤同细胞迁移实验,显微镜下观察侵袭细胞数.
1.2.5 双荧光素酶报告基因检测miR-132-3p与Gab2靶向关系:Starbase预测显示Gab2的3'UTR含有miR-132-3p的互补序列, 将含有结合位点的3'UTR区序列插入荧光素酶报告基因载体构建野生型报告基因载体WT-Gab2,利用基因突变技术将结合位点进行突变, 将含有突变位点的3'UTR区序列插入荧光素酶报告基因载体构建突变型报告基因载体MUT-Gab2, 取对数生长期BGC-823细胞, 分别将WT-Gab2、MUT-Gab2与miR-NC、miR-132-3p mimics转染至BGC-823细胞, 置于37 ℃恒温培养箱培养, 转染方法参照Lipofectamine2000转染试剂说明书, 继续培养48 h后收集细胞检测相对荧光素酶活性.取BGC-823细胞分别将miR-NC、miR-132-3p mimics、anti-miR-NC、anti-miR-132-3p转染至BGC-823细胞, 通过蛋白免疫印迹法(Western blot)检测Gab2蛋白相对表达量.
1.2.6 Western blot检测Gab2、CyclinD1、N-cadherin、P21、E-cadherin蛋白表达:收集GES1、SGC-7901、MKN45、BGC-823细胞及转染后各组BGC-823细胞,加入适量RIPA裂解液提取细胞总蛋白, 根据BCA蛋白定量试剂盒检测蛋白浓度.取50 μg蛋白上样量进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳, 电泳产物转移至PVDF膜, 5%脱脂奶粉封闭2 h, 置于一抗稀释液(Gab2 1:800、CyclinD1 1:1000、N-cadherin 1:1000、P21 1:500、E-cadherin 1:1000)孵育24 h(4 ℃), TBST洗涤, 孵育二抗稀释液(1:5000), 室温孵育1 h, TBST洗涤, 滴加ECL显影, 应用ImageJ软件分析各条带灰度值.
统计学处理采用SPSS 21.0统计学软件分析数据,计量资料以(Mean±SD)表示且均符合正态分布, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析, 以P<0.05为差异具有统计学意义.
2 结果
2.1 miR-132-3p与Gab2在GC细胞系及正常胃黏膜上皮细胞系中的表达 qRT-PCR与Western blot检测结果显示,与GES1细胞相比, SGC-7901、MKN45、BGC-823中miR-132-3p的表达水平显著降低(P<0.05),Gab2mRNA及蛋白表达水平显著升高(P<0.05), 其中miR-132-3p在BGC-823细胞中的表达水平低于其他细胞系, 因而选用BGC-823细胞进行后续研究(图1、表1).
2.2 miR-132-3p过表达对BGC-823细胞增殖、迁移及侵袭的影响 qRT-PCR检测结果显示, miR-132-3p组BGC-823细胞中miR-132-3p的表达水平显著高于miR-NC组(P<0.05), 见表2.提示成功上调BGC-823细胞中miR-132-3p的表达.实验结果显示, 与miR-NC组相比, miR-132-3p组细胞存活率显著降低(P<0.05), 迁移细胞数与侵袭细胞数显著减少(P<0.05), CyclinD1、N-cadherin蛋白相对表达量显著降低(P<0.05), P21、E-cadherin蛋白相对表达量显著升高(P<0.05), NC组与miR-NC组各指标间相比差异无统计学意义(P>0.05)(图2、表2、表3).
2.3 miR-132-3p靶向调控Gab2的表达 Starbase预测显示Gab2的3'UTR中含有与miR-132-3p互补的核苷酸序列(图3A).双荧光素酶报告结果显示, 转染克隆有Gab2-3'UTR突变型载体质粒实验中, miR-132-3p组与miR-NC组比较, 荧光素酶活性差异无显著性(P>0.05); 转染克隆有Gab2-3'UTR载体质粒实验中, miR-132-3p组荧光素酶活性明显受到抑制, 与miR-NC组比较, 荧光素酶活性差异具有显著性(P<0.05)(表4).Western blot检测结果显示,与miR-NC组相比, miR-132-3p组BGC-823细胞中Gab2蛋白相对表达量显著降低(P<0.05); 与anti-miR-NC组相比,anti-miR-132-3p组BGC-823细胞中Gab2蛋白相对表达量升高(P<0.05)(图3B、表5).
2.4Gab2过表达可逆转miR-132-3p过表达对BGC-823细胞增殖、迁移及侵袭的抑制作用 实验结果显示, 与miR-132-3p+pcDNA组相比, miR-132-3p+pcDNAGab2组BGC-823细胞中Gab2蛋白相对表达量显著升高(P<0.05), 细胞存活率显著升高(P<0.05), 迁移细胞数与侵袭细胞数显著增多(P<0.05), CyclinD1、N-cadherin蛋白相对表达量显著升高(P<0.05), P21、E-cadherin蛋白相对表达量显著降低(P<0.05)(图4、表6、表7).
3 讨论
GC具有发病率高、治愈率低等特点, 肿瘤细胞迁移及侵袭是促使肿瘤转移的重要原因, 研究表明miRNA可通过体调控靶基因的表达从而影响肿瘤发生及发展,GC发生发展过程涉及多种癌基因或抑癌基因等的异常表达, 部分研究结果显示miRNA可通过靶向调控靶基因表达从而影响GC发生及转移过程[9-11].但仍有部分miRNA在GC中的调控作用尚未阐明.
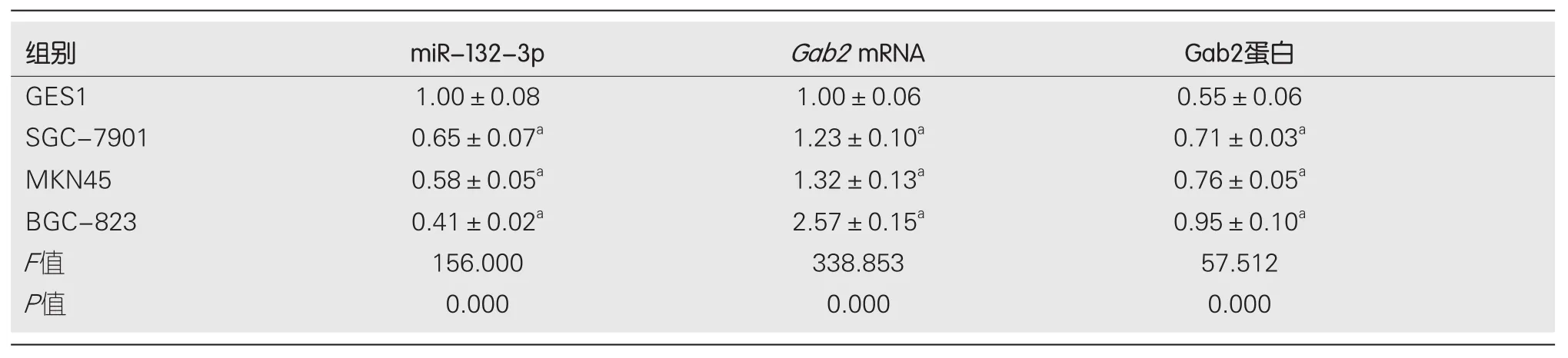
表1 miR-132-3p与Gab2在胃癌细胞系及正常胃黏膜上皮细胞系中的表达(mean±SD, n = 9)
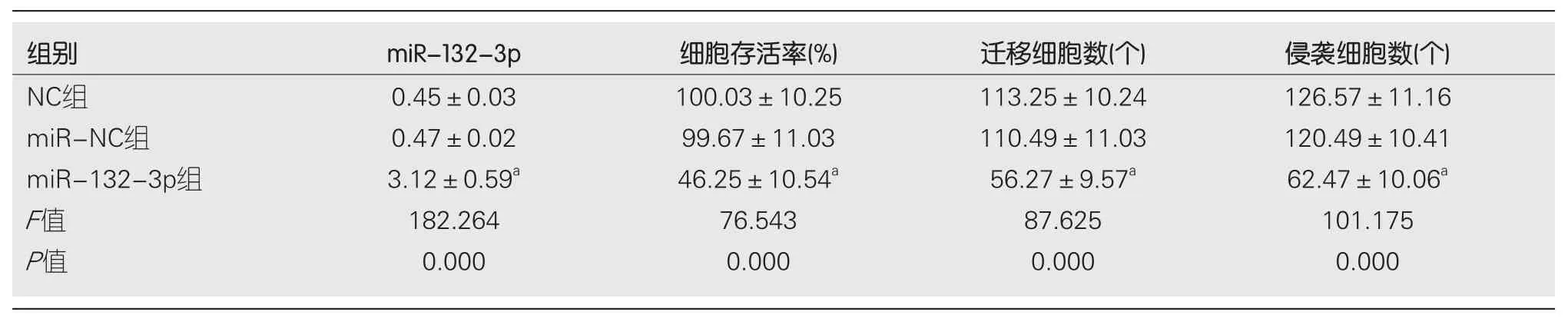
表2 miR-132-3p过表达对胃癌BGC-823细胞增殖、迁移及侵袭的影响(mean±SD, n = 9)
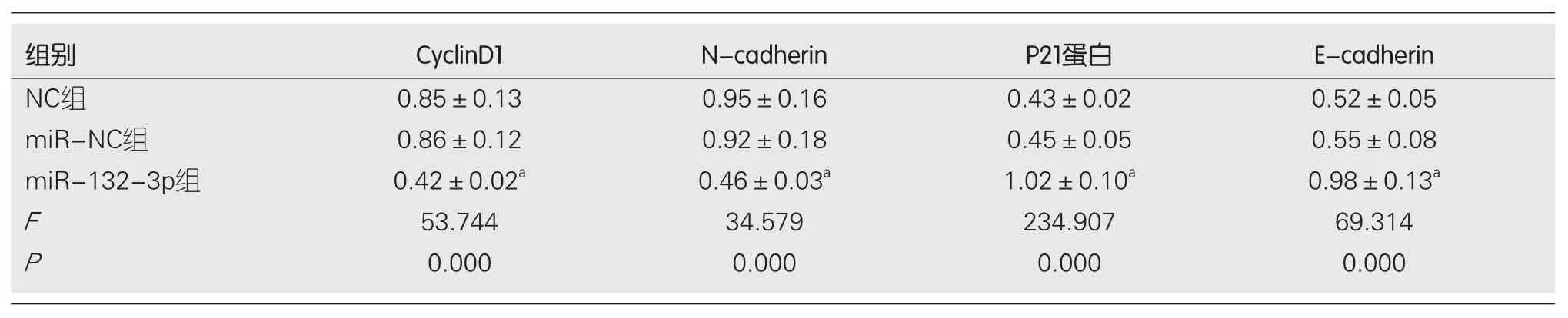
表3 细胞增殖、迁移及侵袭相关蛋白表达量(mean±SD, n = 9)
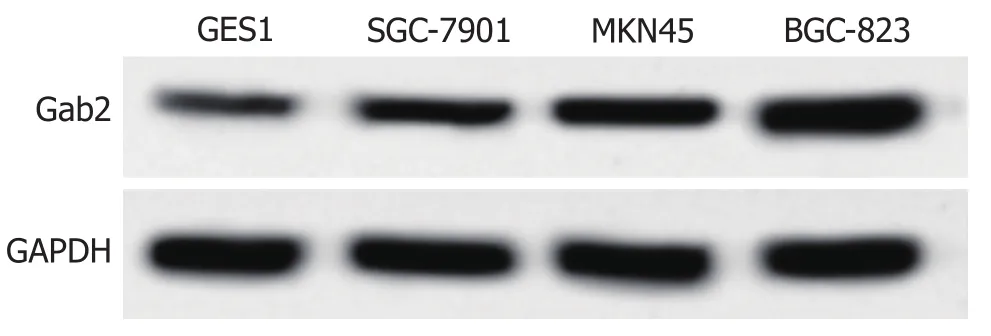
图1 Gab2蛋白免疫印迹图.
miR-132-3p在恶性间皮瘤中呈低表达并可能作为肿瘤诊断生物标志物[12].miR-132-3p在骨肉瘤细胞中的表达水平降低, 长链非编码RNA可能通过靶向抑制miR-132-3p的表达从而促进骨肉瘤发生及发展[13,14].本研究结果显示miR-132-3p在GC细胞中的表达水平显著降低,miR-132-3p过表达可抑制GC细胞增殖, 提示miR-132-3p过表达可减弱GC细胞增殖能力.研究表明CyclinD1可通过与细胞周期依赖蛋白激酶4/6结合形成复合物从而促进细胞周期由G1期进入S期, 促进细胞增殖, P21可负向调控细胞周期, 抑制细胞增殖[15].本研究结果显示miR-132-3p过表达可促进P21表达及抑制CyclinD1表达, 提示miR-132-3p过表达可能通过上调P21表达及下调CyclinD1表达从而抑制GC细胞增殖.研究表明上皮-间质转化(epithelial-mesenchymal transition, EMT)可促进肿瘤细胞迁移及侵袭, E-cadherin是上皮表型标志物,E-cadherin的缺失可促进EMT发生进而促进GC细胞迁移及侵袭, N-cadherin是间质标记物, 其表达量升高可促进GC细胞迁移及侵袭[16].本研究结果显示miR-132-3p过表达可减少GC细胞迁移与侵袭数目, N-cadherin蛋白表达量显著降低, E-cadherin蛋白表达量显著升高, 提示miR-132-3p过表达可能通过上调E-cadherin表达及下调N-cadherin表达而抑制EMT发生进而抑制GC细胞迁移及侵袭.
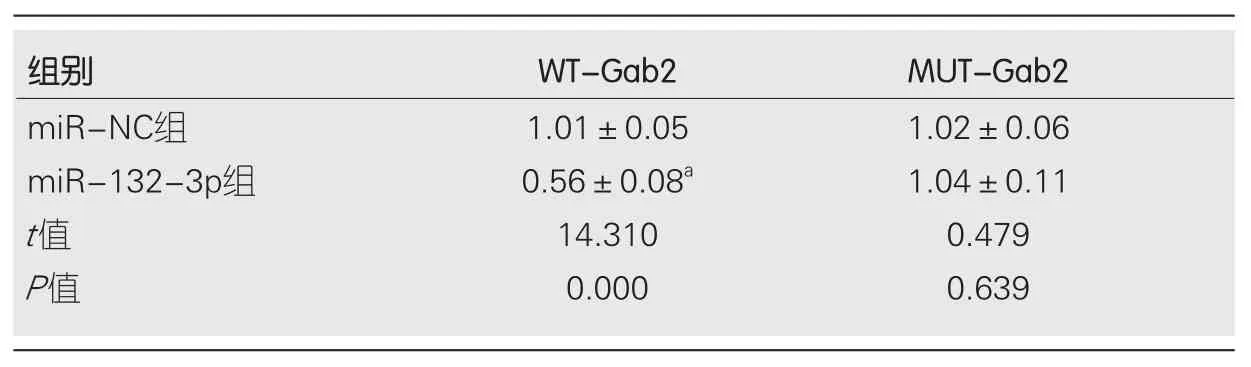
表4 双荧光素酶报告实验(mean±SD, n = 9)
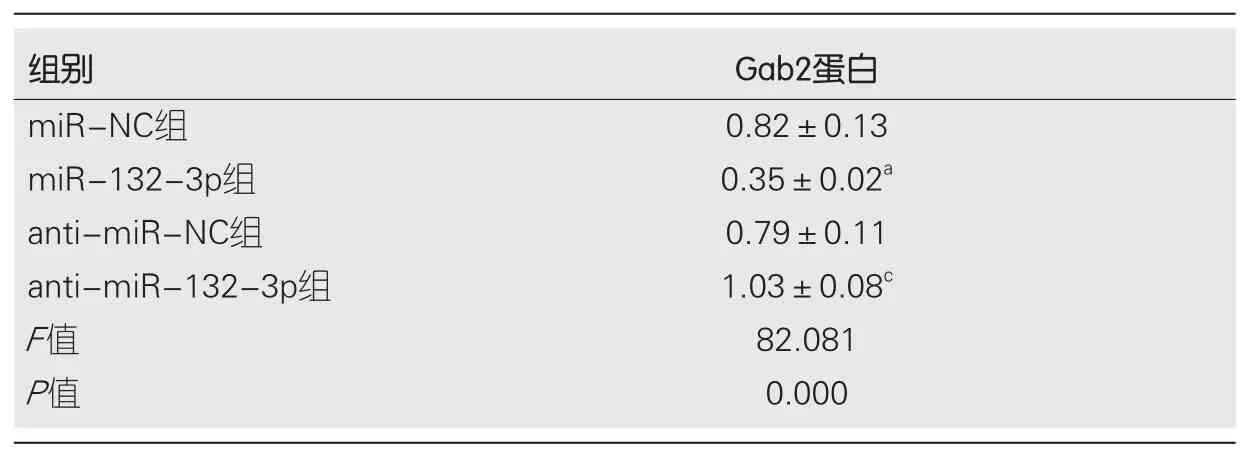
表5 Gab2蛋白相对表达量(mean±SD, n = 9)
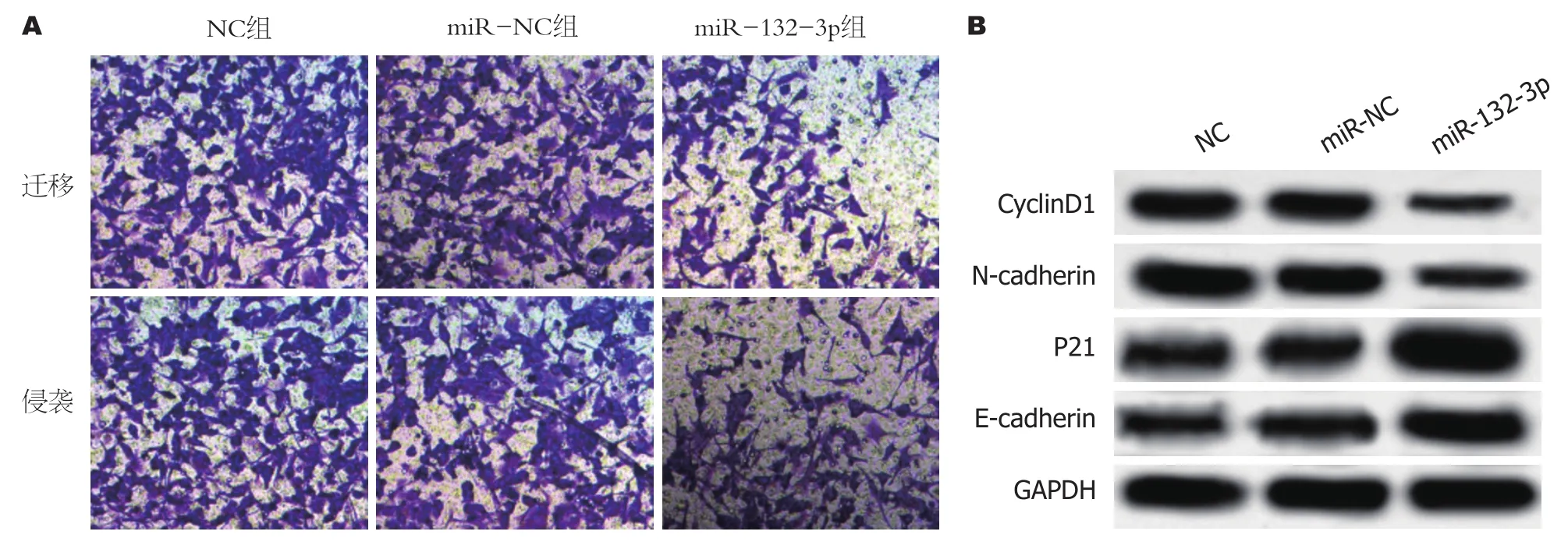
图2 miR-132-3p过表达对胃癌BGC-823细胞迁移及侵袭的影响.A:细胞迁移及侵袭图; B:细胞增殖、迁移及侵袭相关蛋白免疫印迹图.CyclinD1:细胞周期蛋白1; E-cadherin:上皮型钙黏蛋白; N-cadherin:神经型钙黏蛋白.
Gab2在肺癌细胞中表达上调, 抑制Gab2表达可促进细胞凋亡[17].Gab2在结直肠癌组织中高表达并可能促进肿瘤发生及发展过程[18].相关报道指出干扰Gab2表达可抑制骨肉瘤细胞迁移及侵袭[19].本研究结果显示Gab2在GC细胞中的表达水平显著升高, 与相关文献报道相似[20].提示Gab2表达量升高可能促进GC发生及转移.本研究通过双荧光素酶报告实验与Western blot实验结果证实miR-132-3p靶向结合Gab2并可负向调控Gab2的表达, 进一步研究结果显示Gab2过表达联合miR-132-3p过表达后GC细胞存活率显著升高, 迁移细胞数与侵袭细胞数均显著增多, CyclinD1、N-cadherin蛋白表达水平显著升高, P21、E-cadherin蛋白表达水平降低, 说明Gab2过表达可逆转miR-132-3p过表达对BGC-823细胞增殖、迁移及侵袭的抑制作用.提示miR-132-3p过表达可通过下调Gab2表达从而抑制GC细胞增殖、迁移及侵袭.
综上所述, miR-132-3p在GC细胞中表达水平降低从而促进GC细胞增殖、迁移及侵袭, 其作用机制可能与miR-132-3p靶向负调控Gab2表达有关, miR-132-3p过表达可抑制Gab2表达进而减弱GC细胞增殖、迁移及侵袭能力, 可为GC靶向治疗提供潜在靶点.
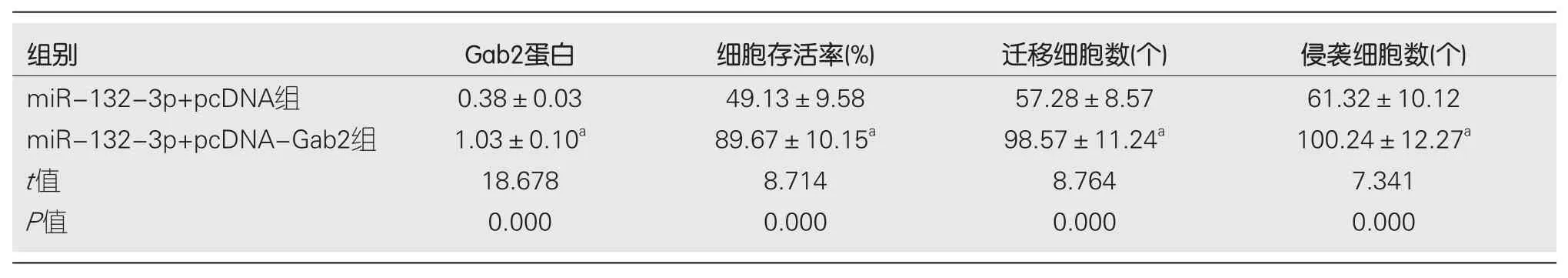
表6 Gab2过表达可逆转miR-132-3p过表达对BGC-823细胞增殖、迁移及侵袭的抑制作用(mean±SD, n = 9)
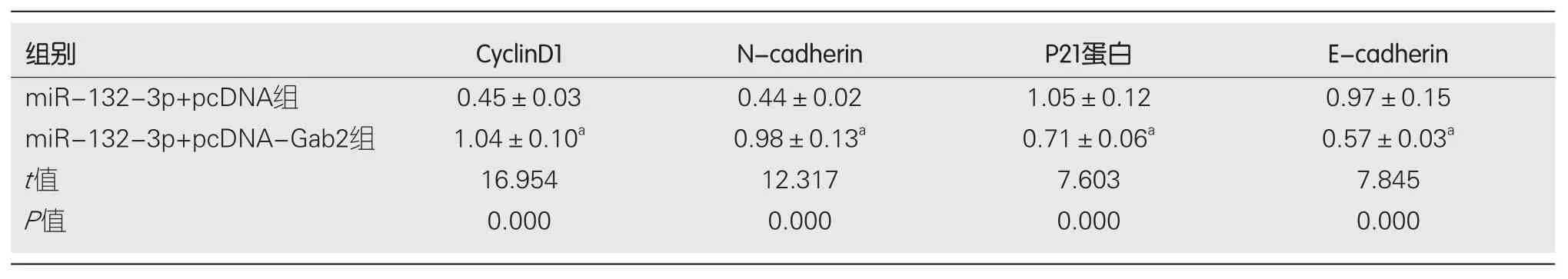
表7 细胞增殖、迁移及侵袭相关蛋白表达量(mean±SD, n = 9)
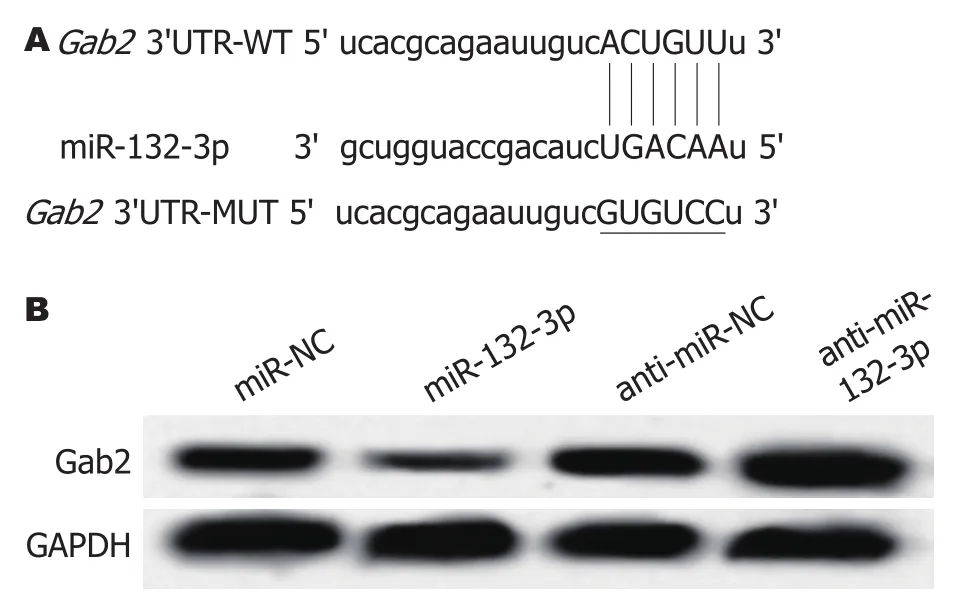
图3 miR-132-3p靶向调控Gab2的表达.A:Gab2的3'UTR中含有与miR-132-3p互补的核苷酸序列; B:Gab2蛋白免疫印迹图.WT:野生型; MUT:突变型.
文章亮点
实验背景
胃癌(gastric cancer, GC)发病率逐年升高, 但GC发生及发展的分子机制尚未阐明, 已有研究报道显示miRNA异常表达可调控GC细胞增殖、迁移及侵袭, 但仍有部分miRNA在GC发生过程中的作用机制尚未可知.
实验动机
miR-132-3p在GC中的表达下调, 但miR-132-3p在GC发生发展过程中的作用机制尚未阐明.既往研究显示miR-132-3p在肿瘤发生过程可能发挥抑癌作用.因而探究miR-132-3p在GC发生及发展中的作用机制对GC诊断及治疗均具有重要意义.
实验目标
miR-132-3p过表达可通过抑制Gab2表达从而抑制GC细胞增殖、迁移及侵袭, 为GC靶向治疗提供潜在靶点.
实验方法
qRT-PCR与Western blot检测GC细胞中miR-132-3p与Gab2的表达, 选用低表达量的BGC-823细胞为研究对象, 分别将miR-132-3p mimics转染至细胞中, MTT法检测细胞增殖能力; Transwell小室实验检测细胞迁移及侵袭能力; 双荧光素酶报告实验验证miR-132-3p与Gab2的靶向调控作用; pcDNA-Gab2与miR-132-3p mimics共转染至BGC-823细胞, 采用MTT法、Transwell小室检测细胞增殖、迁移及侵袭能力; Western blot法检测各组细胞中增殖、迁移及侵袭相关蛋白表达.
实验结果
miR-132-3p在GC细胞系中表达水平降低,Gab2的表达水平升高, miR-132-3p过表达可抑制BGC-823细胞增殖、迁移及侵袭, 抑制CyclinD1、N-cadherin蛋白表达,促进P21、E-cadherin蛋白表达.双荧光素酶报告实验证实miR-132-3p能够靶向结合Gab2, 并可负向调控Gab2的表达.Gab2过表达可逆转miR-132-3p过表达对BGC-823细胞增殖、迁移及侵袭的抑制作用.
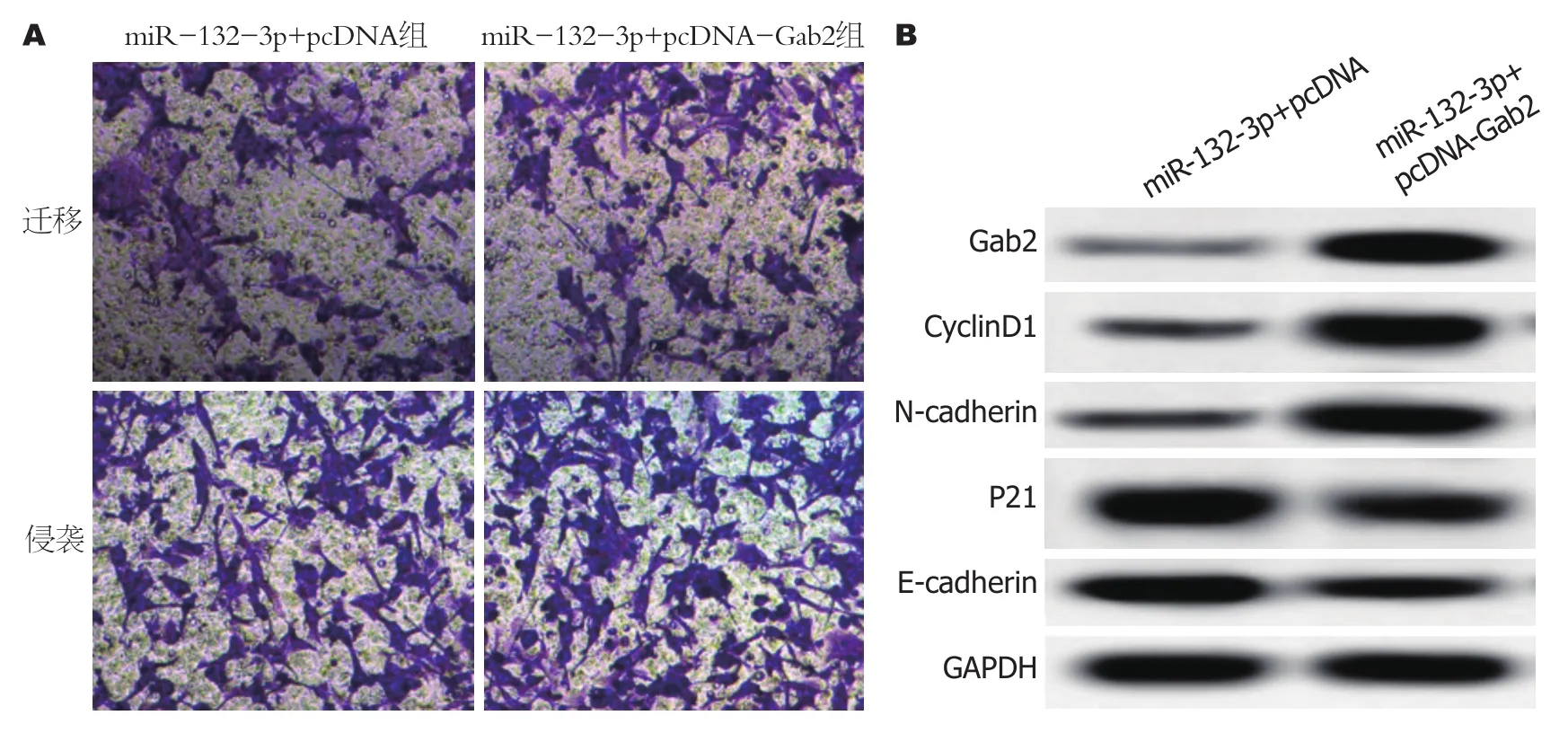
图4 Gab2过表达对细胞迁移与侵袭的影响.A:细胞迁移与侵袭; B:细胞增殖、迁移及侵袭相关蛋白免疫印迹图.CyclinD1:细胞周期蛋白1;E-cadherin:上皮型钙黏蛋白; N-cadherin:神经型钙黏蛋白.
实验结论
miR-132-3p的表达水平显著降低, 上调miR-132-3p表达可靶向干扰Gab2表达从而减弱GC细胞增殖、迁移及侵袭能力.
展望前景
miR-132-3p上游调控基因LncRNA尚未可知, miR-132-3p通过调控Gab2基因表达而发挥作用, 但其是否可通过调控相关信号通路从而发挥作用尚未可知, 还需进行体内移植瘤实验验证miR-132-3p的抗癌作用, miR-132-3p可能作为GC治疗的靶标基因.

