微生态制剂对草鱼生产性能和肠道菌群的影响
王 颖,宋 明,张锦华,周秋白,张正洲,王自蕊,杨竹青
( 江西农业大学 动物科学技术学院,江西 南昌 330045 )
随着水产养殖业养殖强度的日益增加和规模的逐渐扩大,抗生素滥用的情况也愈发严重,导致水源和水产品中抗生素残留量大幅上升,最终危害人类健康。微生态制剂作为一种新型绿色的饲料添加剂,既能调节机体肠道微生态平衡、增强机体免疫力,促进生长,还可改善养殖水体的水质条件,使用方便、健康无药物残留[1-3],广泛应用于水产业。对草鱼(Ctenopharyngodonidellus)[4]、鲤鱼(Cyprinuscarpio)[5]、中华鳖(Pelodiscussinensis)[6]、罗非鱼(Oreochromis)[7]、凡纳滨对虾(Litopenaeusvannamei)[8]等的研究表明,添加微生态活菌制剂能提高水产动物的生产性能,但合理使用微生态制剂还缺乏足够的科学依据,在饲料加工中添加微生态制剂经过膨化制粒后对草鱼生产性能是否有影响还未见相关报道。
芽孢杆菌(Bacillus)、乳酸菌以及酵母菌是水产养殖中应用较为广泛的3类菌种,对水生动物的生长发育等有着积极作用[9-11]。本试验采用该3类菌种复配(8.0×109cfu/g),以麸皮为载体加工制成微生态制剂添加于草鱼膨化饲料中喂养草鱼,分析在饲料中添加微生态制剂对草鱼生长、肠道消化酶、肠道组织学以及肠道菌群的变化情况,本研究还提出一个比较直观,且简单易行的“肠伸展率”指标来判别肠道的质量,旨在为草鱼绿色饲料生产提供参考依据,促进草鱼养殖提质增效。
1 材料与方法
1.1 材料
试验分3组。第1组为基础饲料(对照组),在满足草鱼基本营养需求的前提下,配制基础饲料;试验2、试验3组分别向基础饲料中添加0.5%、2%的微生态制剂。微生态制剂由枯草芽孢杆菌(Bacillussubtilis)、产朊假丝酵母菌(Candidautilis)和乳酸杆菌(Lactobacillus)复配,麸皮为载体,由广东佛山市顺德区健坤生物科技有限公司定制发酵加工而成;试验饲料预混料的单体原料由江西大佑农生物科技有限公司提供;大宗饲料原料由江西格力特水产饲料有限公司提供;草鱼膨化颗粒饲料由江西格力特水产饲料有限公司代加工,饲料粒径2.0 mm。试验饲料组成及营养水平见表1。
试验用草鱼购自九江市水产研究所,为长江四大家鱼原种场原种草鱼F1代。
1.2 方法
采用单因子试验设计,筛选体质好、规格均匀的草鱼1260尾[平均体质量为(110.23±0.43) g],随机分为3组,每组6个平行,每个平行70尾,分别放入18个3.0 m×2.0 m×1.2 m加盖网箱中。试验于江西农业大学水产实验基地进行,养殖水温为自然水温25~30 ℃。养殖时间为60 d。
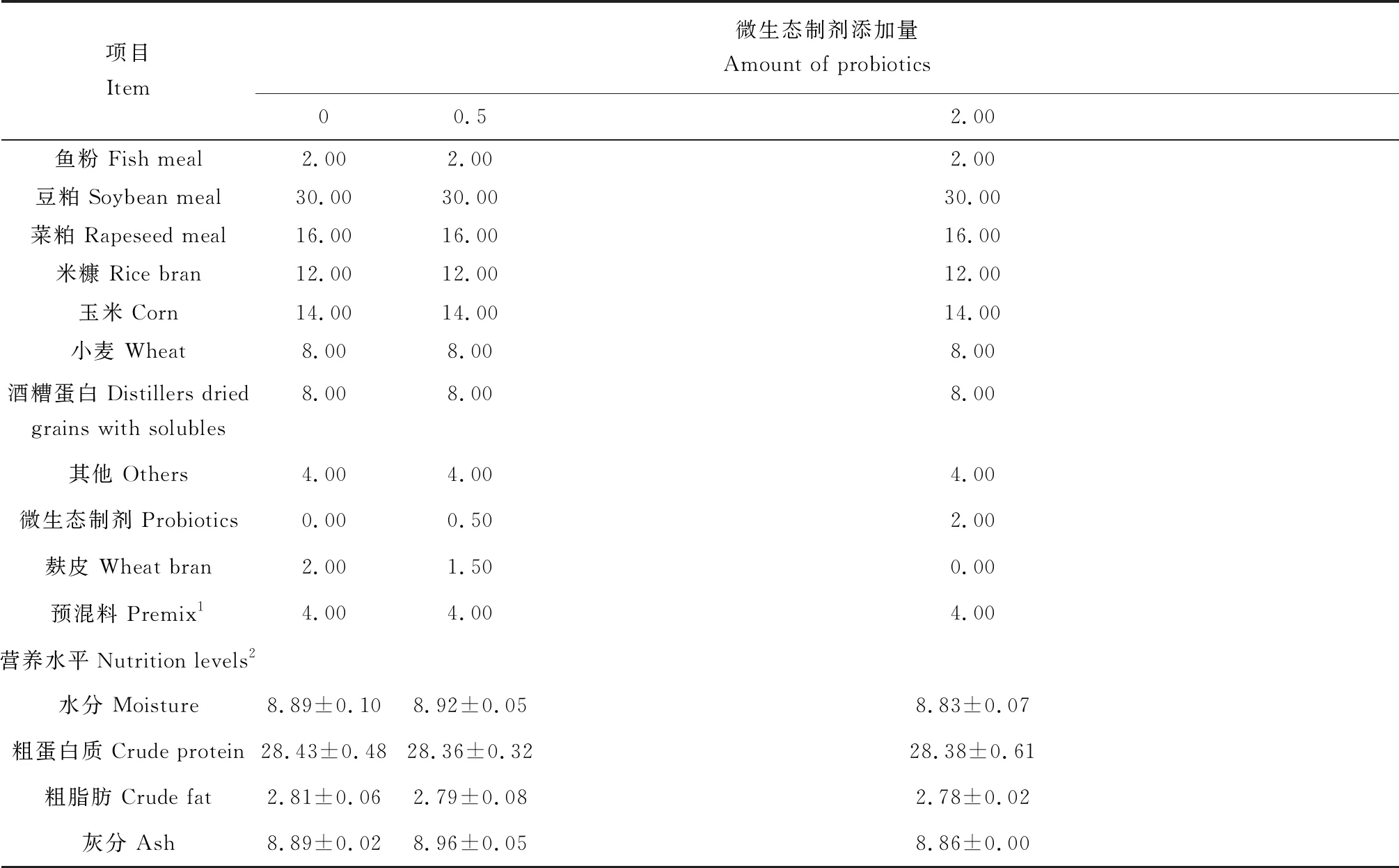
表1 试验饲料组成及营养水平(风干基础) %Tab.1 Ingredients and nutrient level in theexperiment diets (DM basis)
注: 1.预混料为每千克饲料提供The premix provides the followings per kg of diet: 维生素A VA 5 000 IU,维生素B1VB125 mg,维生素B2VB245 mg,维生素B6VB620 mg,维生素B12VB120.1 mg,维生素K3VK310 mg,维生素E VE 200 mg,维生素C VC 200 mg,维生素D3VD32 500 IU,肌醇 inositol 200 mg,泛酸钙Calcium pantothenate 60 mg,烟酸 nicotinic acid 200 mg,叶酸 folic acid 10 mg,生物素 biotin 1.5 mg,氯化胆碱 choline chloride 2 500 mg,亚硒酸钠NaSeO3·5H2O 0.3 mg,氯化钴CoCl2·6H2O 0.4 mg,碘化钾KI 0.8 mg,硫酸铜CuSO4·5H2O 10 mg,硫酸锰MnSO4·4H2O 20 mg,硫酸锌ZnSO4·H2O 50 mg,硫酸亚铁FeSO4·7H2O 150 mg,硫酸镁MgSO4·7H2O 500 mg,氯化钠NaCl 1 000 mg,亚磷酸钙Ca(H2PO3)212 450 mg. 2.实测值 Measured values.
1.3 样本采集与处理
养殖结束饥饿24 h,称量各网箱内草鱼总体质量,计算其终末均质量、质量增加率、特定生长率以及饲料系数等。从每个网箱中取6尾规格接近的试验草鱼,测定其体质量、去内脏质量、肝脏质量、内脏质量、体长、肠长等,计算其肥满度、肝体比、脏体比、空壳率、肠伸展率等。其中3根肠道用于测定肠伸展率(肠伸展率是指肠道拉伸至断裂为止的拉升长度与原始长度的比值。肠伸展率越大,表明肠道发育越好,肌层发达,损伤小)。另3根取其中肠做组织切片,苏木精—伊红染色,观察其消化道形态结构。取草鱼前肠、中肠、后肠测其相应的消化酶活性,采用南京建成生物工程研究所的试剂盒,按照相应的说明书进行测定。
计算公式如下:
特定生长率/%·d-1=(lnmt-lnm0)/t×100%
饲料系数=mf/(mt-m0)
质量增加率/%=(mt-m0)/m0×100%
肥满度=100mt/Lt3
脏体比/%=mv/mt×100%
肝体比/%=mh/mt×100%
空壳率/%=(me/mt)×100%
肠伸展率=Le/LI
式中,mt为终末均质量(g);m0为初始均质量(g);mf为平均饲料摄入量(g);t为饲喂天数(d);mh为肝脏质量(g);mv为内脏质量(g);me为去内脏质量;Lt为体长(cm);Le为肠拉伸长;LI为初始肠长。
肠道菌群样品的采集:投喂试验饲料6 h后,无菌解剖草鱼,取其肠道内容物于无菌的EP管中,放入液氮速冻,后转入-80 ℃超低温冰箱保存。之后每组选取部分样本将其送至上海美吉生物医药科技有限公司进行细菌16S rDNA的V3+V4区高通量测序。
1.4 数据处理与分析
试验数据用平均值±标准误表示,用SPSS 17.0软件进行统计分析,在单因素方差分析的基础上,再用Duncan氏法进行多重比较,菌群分析采用t检验,显著水平为0.05,极显著水平为0.01。
高通量测序所获得的原始数据经过数据过滤,滤除低质量的序列,整理后的剩余高质量的数据进行整理用于后期分析。采用Silva数据库匹配细菌数据库,区分样本后,将样品序列聚类,基于运算分类单元(OTU)在97%相似水平下分析样品的测序深度。利用香农指数、辛普森指数公式计算细菌多样性指数,利用Chao指数公式计算细菌丰富度指数。并在各个水平上统计每组样品的群落组成和差异。通过PICRUSt对运算分类单元丰度表进行标准化,然后通过每个运算分类单元对应的green gene id,获得运算分类单元对应的同源蛋白簇(COG)家族信息并计算各同源蛋白簇的丰度来进行16S功能预测。
2 结 果
2.1 微生态制剂对草鱼生长性能的影响
3个试验组草鱼体质量、特定生长率、质量增加率以及空壳率随着微生态制剂添加量的增加而增加,对照组与0.5%添加组差异不显著(P>0.05),2%添加组显著高于对照组和0.5%添加组(P<0.05);饲料系数随着微生态制剂添加量的增加逐渐降低,2%添加组显著低于对照组和0.5%添加组(P<0.05)。脏体比随着微生态制剂添加量的增加逐渐降低,2%添加组显著低于对照组(P<0.05),0.5%添加组与对照组、2%添加组差异不显著(P>0.05)。肝体比各组之间差异不显著(P>0.05)(表2)。
2.2 微生态制剂对草鱼肠道消化酶活性的影响
0.5%添加组草鱼前肠淀粉酶活性显著高于对照组(P<0.05),2%添加组与对照组、0.5%添加组差异不显著(P>0.05);中肠淀粉酶活性随着微生态制剂添加量的增加逐渐升高,2%添加组显著高于对照组、0.5%添加组(P<0.05),0.5%添加组显著高于对照组(P<0.05)。3组间草鱼后肠淀粉酶活性差异不显著(P>0.05)。前肠脂肪酶活性差异不显著(P>0.05);2%添加组草鱼中肠脂肪酶活性显著高于对照组和0.5%添加组(P<0.05),对照组和0.5%添加组之间差异不显著(P>0.05);后肠脂肪酶活性逐渐升高,2%添加组显著高于对照组(P<0.05),0.5%添加组高于对照组,但和对照组、2%添加组差异不显著(P>0.05)。中肠脂肪酶活性最高,前后肠差异不显著(P>0.05)(表3)。
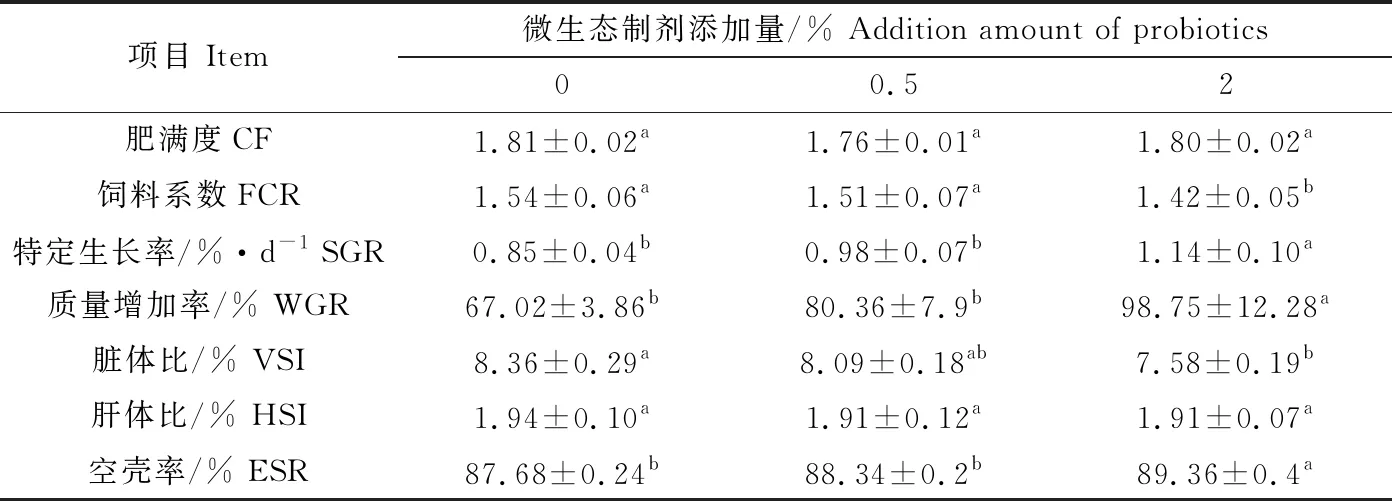
表2 饲料中添加不同比例微生态制剂对草鱼生长的影响(n=6)Tab.2 The effect of different proportions of dietary probiotics on growth in grass carp (n=6)
注:表中数值为平均值±标准误,同一行中上标不同字母的平均值间差异显著(P<0.05),下同.
Note:values are expressed as mean±SE; means with different superscripts in the same line are significantly different(P<0.05); et sequentia.
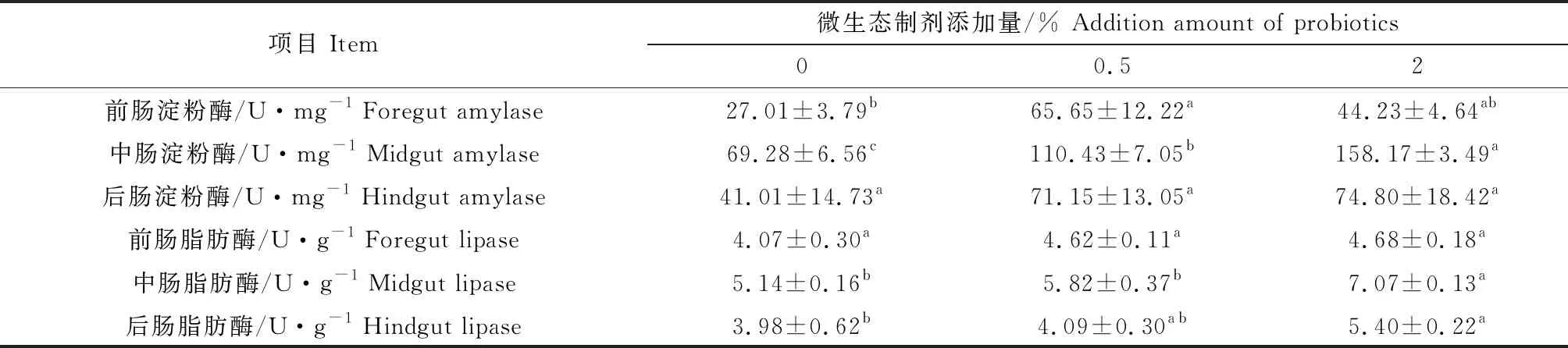
表3 饲料中添加不同比例微生态制剂对草鱼肠道消化酶活性的影响(n=6)Tab.3 The effect of different proportions of dietary probiotics on activities of intestinal digestive enzymes in grass carp (n=6)
2.3 微生态制剂对草鱼肠道组织结构的影响
微生态制剂对草鱼中肠的组织结构影响较为明显。随着微生态制剂添加量的增加,草鱼肠伸展率逐渐升高,2%添加组显著高于对照组(P<0.05),0.5%添加组与对照组、2%添加组差异不显著(P>0.05);草鱼肌层厚度逐渐增加,2%添加组显著高于对照组、0.5%添加组(P<0.05),对照组和0.5%添加组差异不显著;绒毛长度逐渐增加,2%添加组显著高于对照组(P<0.05),0.5%添加组与对照组、2%添加组差异不显著(P>0.05)(表4)。
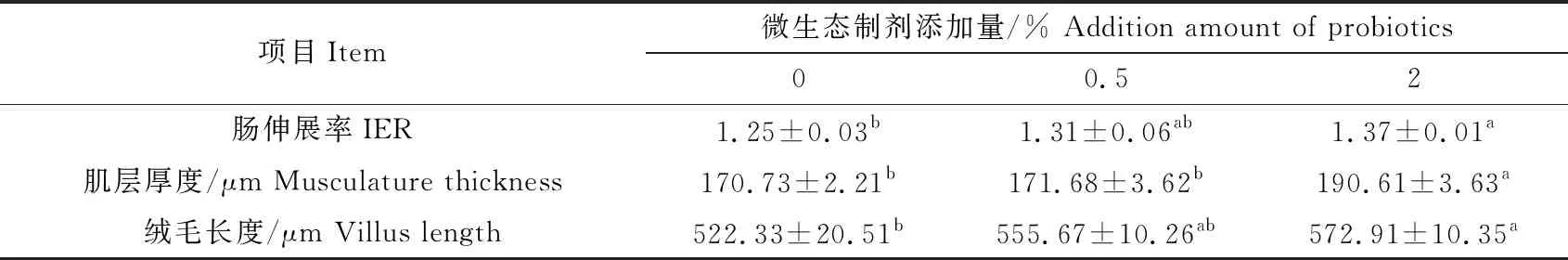
表4 饲料中添加微生态制剂对草鱼肠道结构的影响(n=3)Tab.4 The effect of dietary probiotics on the intestinal structure in grass carp (n=3)
2.4 微生态制剂对草鱼肠道微生物菌群多样性的影响
香农曲线趋于平缓,覆盖率为99.86%~99.92%,说明对草鱼肠道样本微生物群落的检测比率接近饱和,目前的测序量能覆盖样本中的绝大部分物种。对照组、0.5%和2%添加组数据分别可划分为259、395和428个运算分类单元。通过样品测序序列计算各样品的多样性指数,其中2%添加组的香农指数最大,为2.7288,辛普森指数最小,为0.1675。对照组和0.5%添加组的香农指数和辛普森指数差异较小,多样性相似;通过样品测序序列计算各样品的物种丰富度指数Chao,2%添加组的物种丰富度指数最大,物种丰富度最高。2%添加组香农指数、丰富度指数显著高于对照组(P<0.05),0.5%添加组香农指数和丰富度指数与对照组、2%添加组差异都不显著(P>0.05)。2%添加组辛普森指数显著低于对照组(P<0.05),0.5%添加组与对照组、2%添加组差异不显著(P>0.05)。2%添加组的运算分类单元、多样性指数和丰富度指数均最高(表5)。
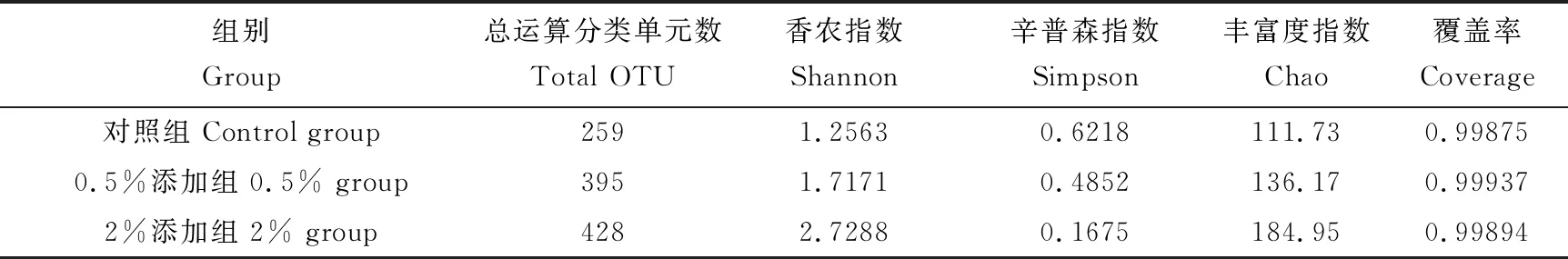
表5 各组微生物菌群和多样性指数(n=3)Tab.5 Bacterial community and diversity index in each group (n=3)
从属水平上进一步分析各个样品中菌群多样性的相互关系,选取3个试验组中每组3个平行样的并集,并构建维恩图(图1)。由图1可知,3组共有属的数量为134,分别占这三组肠道样品全部属的88.16%、70.53%、66.34%。对照组与0.5%添加组共有属较少,而0.5%添加组和2%添加组中共有属较多,分别占全部属数量的22.63%和21.29%。对照组、0.5%添加组和2%添加组其特有属数量分别为4、8和16。
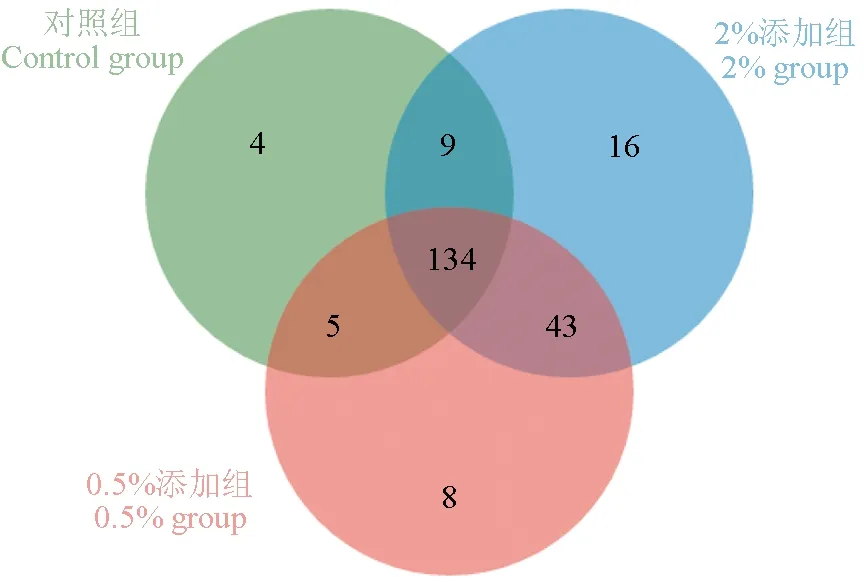
图1 3组肠道微生物在属水平上维恩图Fig.1 Horizontal Venn diagram of the intestinal microorganisms in the three groups at genus level
2.5 微生态制剂对草鱼肠道微生物组成的影响
3种不同处理的草鱼的9个肠道内含物样品微生物菌落主要由17个门组成,合并小于1%的区域,在门水平上对每组样品的菌群结构及分布进行统计分析,结果表明,对照组梭杆菌门和厚壁菌门优势度较高分别占样本所包含物种的总数目的63.56%、32.52%,此外变形菌门和拟杆菌门分别占1.83%、1.45%;0.5%添加组梭杆菌门和厚壁菌门优势度也较高,分别占样本所包含物种的61.82%、20.27%,此外变形菌门、放线菌门和绿弯菌门分别占9.75%、4.21%和2.66%;2%添加组厚壁菌门优势度较高占样本所包含物种的64.20%,此外变形菌门、梭杆菌门、放线菌门、蓝藻菌门、拟杆菌门和绿弯菌门分别占9.94%、3.86%、6.14%、5.12%、4.55%和4.50%(图2)。通过三元相图(图3)分析也可得出,不同组中微生物的组成和分布比例有所不同,2%添加组中厚壁菌门丰度较高,而对照组和0.5%添加组梭杆菌门较高。
从门水平上对其进行多组、两组之间差异性检验分析,发现2%添加组与对照组在梭菌门、变形菌门、放线菌门、蓝藻菌门、衣原体们、螺旋体菌门水平上差异显著(P<0.05)(图4)。对照组与0.5%添加组以及0.5%添加组与2%添加组在各门水平上差异不显著(P>0.05),但在对照组和0.5%添加组之间,变形菌门、放线菌门和绿弯菌门呈现上升趋势,厚壁菌门、拟杆菌门呈现下降趋势;在0.5%添加组和2%添加组之间,厚壁菌门丰度明显升高,由20.27%升至64.20%,而梭杆菌门丰度明显降低,由61.82%降至3.86%。此外,变形菌门丰度基本不变,蓝藻菌门、放线菌门、拟杆菌门和绿弯菌门呈现上升趋势。以上结果表明,在饲料中添加微生态制剂会改变草鱼肠道菌群组成,2%添加组在厚壁菌门、拟杆菌门、放线菌门和绿弯菌门上丰度高于对照组,在梭杆菌门丰度低于对照组;0.5%添加组在变形菌门、放线菌门和绿弯菌门上丰度高于对照组,在厚壁菌门和拟杆菌门丰度低于对照组。
在属水平上对3组样品的菌群结构及分布进行统计分析,合并小于1%的区域(图5),结果表明,对照组和0.5%添加组的优势菌属均为梭杆菌门的鲸杆菌属(Cetobacterium),对应的属各占各组全部属的63.31%、61.79%,2%添加组优势菌属为厚壁菌门的Paeniclostridium、Erysipelatoclostridium分别占该组全部属的25.07%、13.74%,而在2%添加组中鲸杆菌属的丰度较低,仅为3.83%,在对照组和0.5%添加组中Paeniclostridium、Erysipelatoclostridium的占也比较低。厚壁菌门的Dielma在对照组和0.5%添加组分别占9.04%、11.93%而在2%添加组中仅占2.64%,可进一步得出2%添加组的优势菌属与对照组和0.5%添加组存在明显差异。此外,在0.5%添加组和2%添加组中存在大量未分类的其他物种。
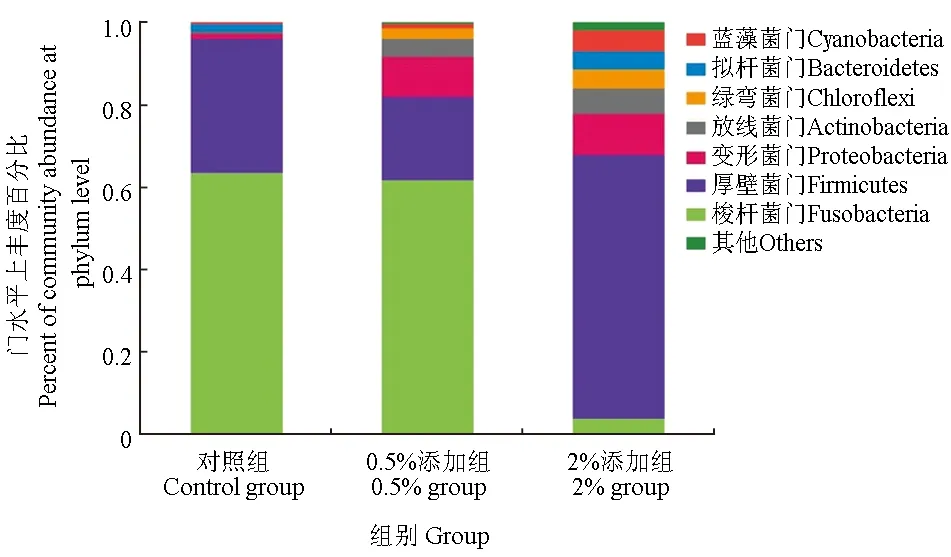
图2 三组肠道微生物在门水平上的丰度Fig.2 Abundance of intestinal microflora in three groups at phylum level
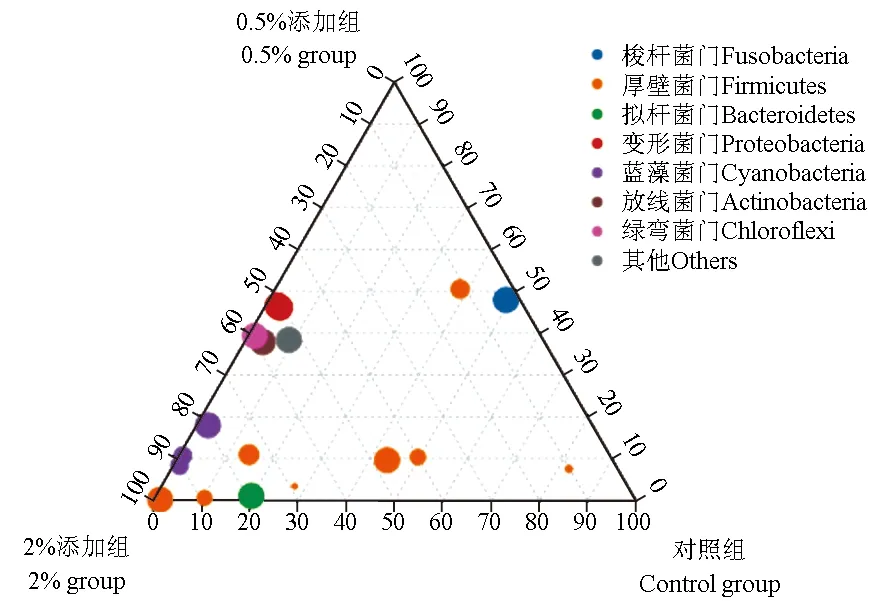
图3 三组肠道微生物门水平上三元相图Fig.3 Ternary phase diagrams of intestinal microflora in three groups at the phylum level 图中相同颜色的圆形代表来自于同一个门,圆形面积的大小代表丰度的大小. The circle of the same color represents the same phylum, and the size of the circle represents the size of abundance.
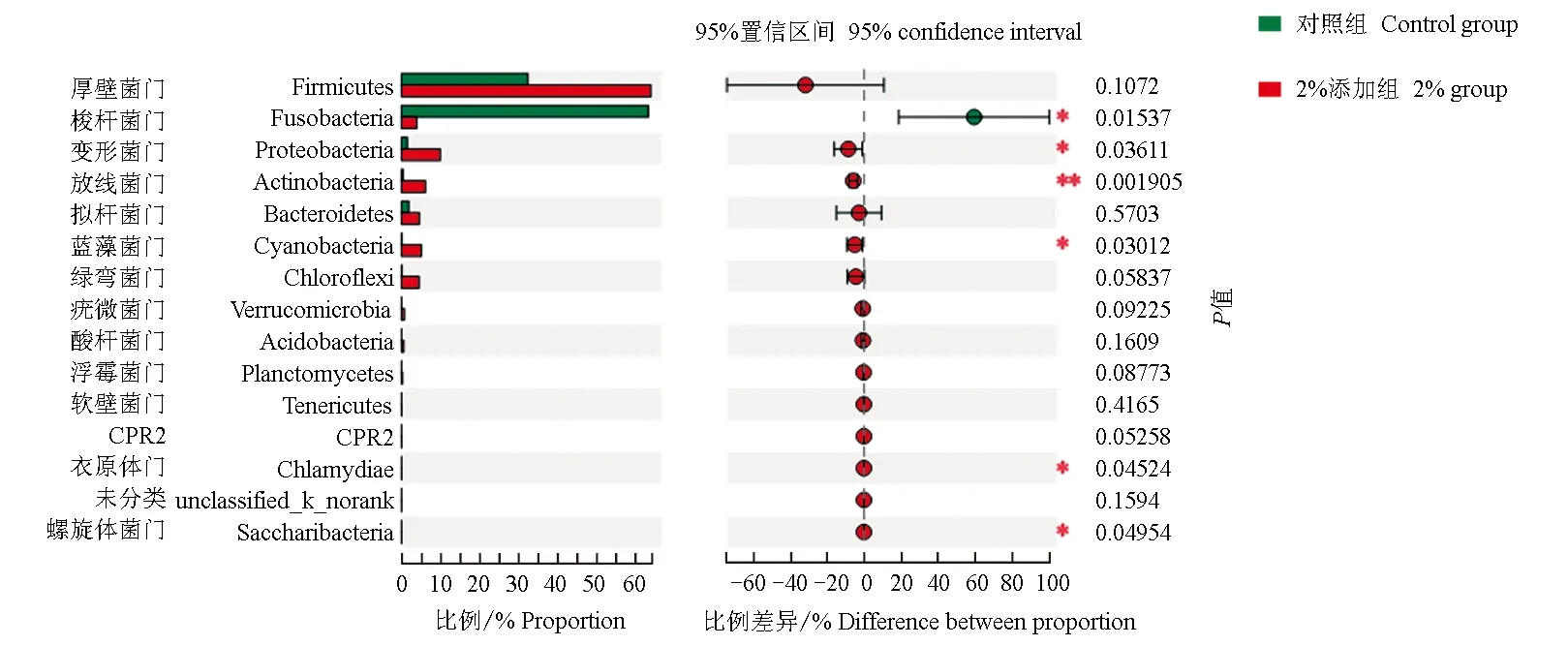
图4 对照组和2%添加组肠道微生物门水平上差异检验Fig.4 The difference test of intestinal microbial between the control group and the 2% group at phylum level 纵坐标表示不同分类水平下的物种名,横坐标表示该样本的某一物种丰度的百分数数值,不同颜色表示不同分组. *,P<0.05,**, P<0.01,***, P<0.001,下同. The ordinate is the species name at different levels of classification, the abscissa is the percent of a species abundance of the sample, and different colors show different groups. *, P<0.05, **, P<0.01, ***, P<0.001, et sequentia.
再从属水平上采用student′st检验对3组样本两两进行差异分析,结果表明,对照组和2%添加组在鲸杆菌属、蓝藻细菌(norank_c__Cyanobacteria)、norank_f__MNG7、分支杆菌(Mycobacterium)、甲基孢囊菌科细菌(unclassified_f__Methylocystaceae)之间差异显著(P<0.05)(图6)。0.5%添加组和2%添加组在Romboutsia、蓝藻细菌(norank_c__Cyanobacteria)之间差异显著(P<0.05)(图7)。而对照组和0.5%添加组之间在各属水平上差异不显著(P>0.05),但各属比例有所差异。2%的微生态制剂使草鱼肠道优势菌属直接发生改变。
并且随着微生态制剂含量的升高,草鱼肠道本身的优势菌属——鲸杆菌属丰度先升高,后大幅下降。
2.6 微生态制剂对草鱼肠道微生物代谢功能的影响
所有样本主要的同源蛋白簇功能有:氨基酸转运与代谢、转录、能量生产与转换、碳水化合物转运与代谢、无机离子转运和代谢、膜转运、复制、修复、辅酶转运和代谢、脂质转运与代谢、蛋白质转换、核苷酸转运和代谢、防御机制、细胞过程和信号传导等功能。该结果表明,草鱼样本中的微生物代谢功能非常丰富(图8)。
与物种组成相比,所有组样本的同源蛋白簇功能组成较为相似,涉及代谢、转运以及细胞修复、信号传导的功能均有一定程度的变化。由图9可知,随着微生态制剂含量的升高,无机离子转运和代谢、碳水化合物转运与代谢、能量生产与转换、氨基酸转运与代谢、膜转运、复制、修复、翻译等功能的丰度越来越高,说明微生态制剂可增加肠道微生物的各种功能的丰度,调节草鱼的生长代谢。
3 讨 论
3.1 微生态制剂对草鱼生产性能的影响
本试验结果表明,在饲料中添加不同比例的微生态制剂对草鱼的生产性能有一定的促进作用,特定生长率、质量增加率以及空壳率均随微生态制剂添加量的增加逐渐升高,0.5%添加组和2%添加组质量增加率分别比对照组提高了13.34%和31.73%。Wang[12]在饲料中添加3种微生态制剂,促进了草鱼鱼种的生长,提高了鱼种成活率。陈玉春等[13]在饲料中添加微生态制剂对草鱼鱼种有明显的促生长作用,并提高鱼种成活率。尹惠霖[14]在饲料中添加纳豆芽孢杆菌(B.natto),促进草鱼幼鱼生长,提高草鱼幼鱼的特定生长率和质量增加率,增加营养物质的吸收利用,并在一定范围内,随纳豆芽孢杆菌添加量增加,草鱼幼鱼质量增加率和特定生长率呈上升趋势。此外,在军曹鱼(Rachycentroncanadum)[15]、仿刺参(Apostichopusjaponicus)[16]、大菱鲆(Scophthalmusmaximus)[17]、淇河鲫(Carassiusauratus)[18]、建鲤(Cyprinuscarpiovar.jian)[19]等其他水产动物的研究上也得出相似结果。但本试验从添加微生态制剂后再膨化制粒的角度去探索其对草鱼生长的影响,仍能得到与直接添加微生态制剂相似的结果。推测微生态制剂的菌种不是影响草鱼生长的唯一原因,菌种在饲料中所产生的发酵产物可能也是影响草鱼生长的关键原因。
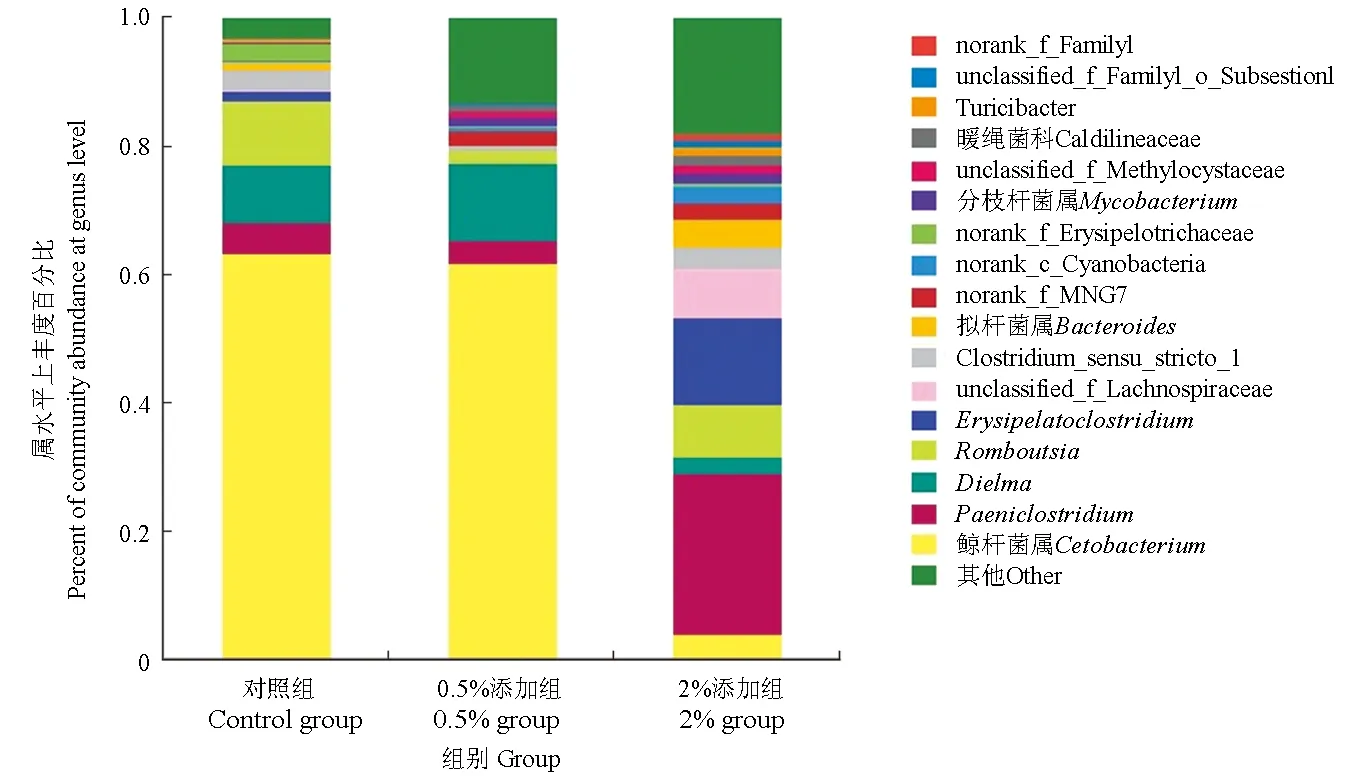
图5 3组肠道微生物在属水平上的丰度Fig.5 Abundance of intestinal flora in 3 groups at genus level
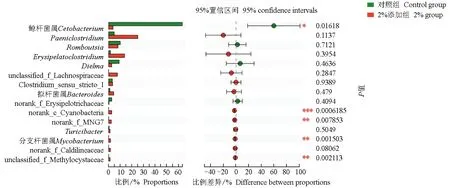
图6 对照组和2%添加组肠道微生物属水平上差异检验Fig.6 The difference test of intestinal microorganism between the control group and the 2% group at genus level
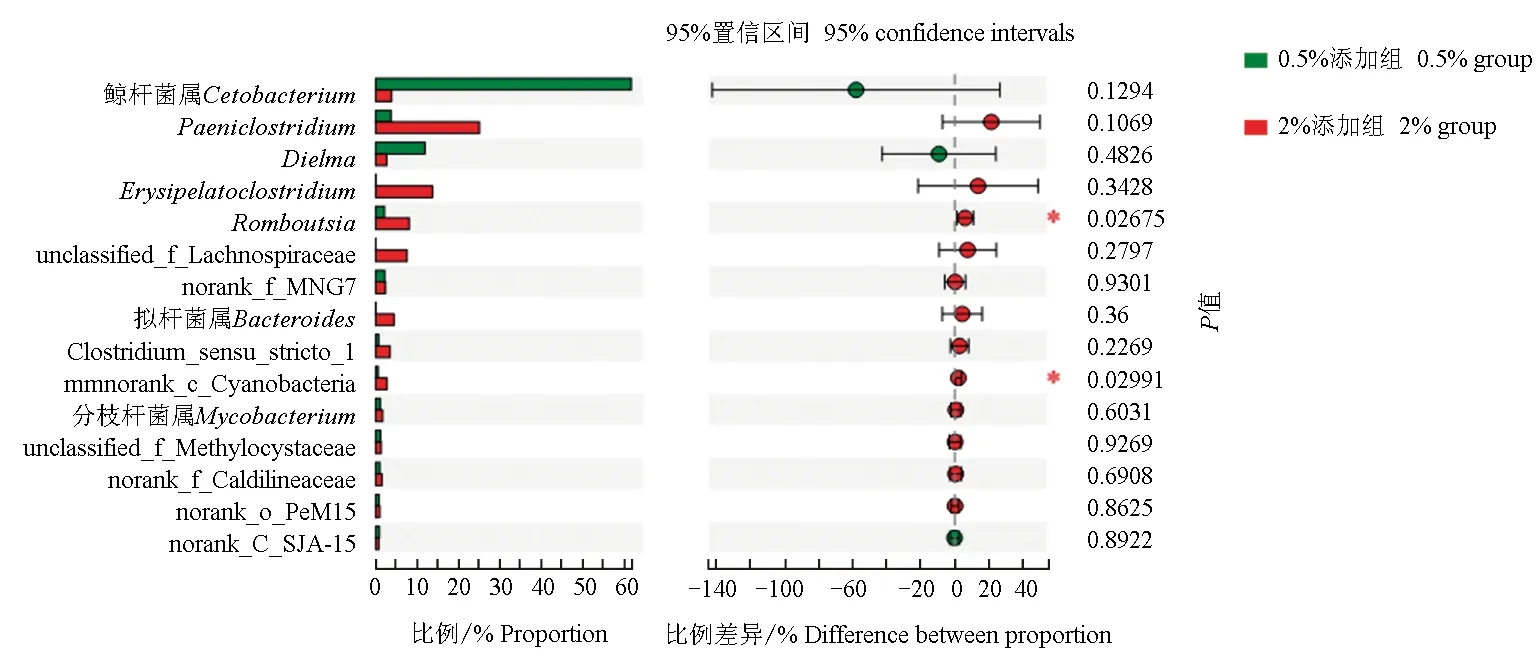
图7 0.5%添加组和2%添加组肠道微生物在属水平上差异检验Fig.7 The difference test of intestinal microorganism between the 0.5% and 2% groups at genus level

图8 3组肠道微生物同源蛋白簇功能分类预测Fig.8 The functional classification prediction of homologous protein clusters of intestinal microorganisms in the three groups
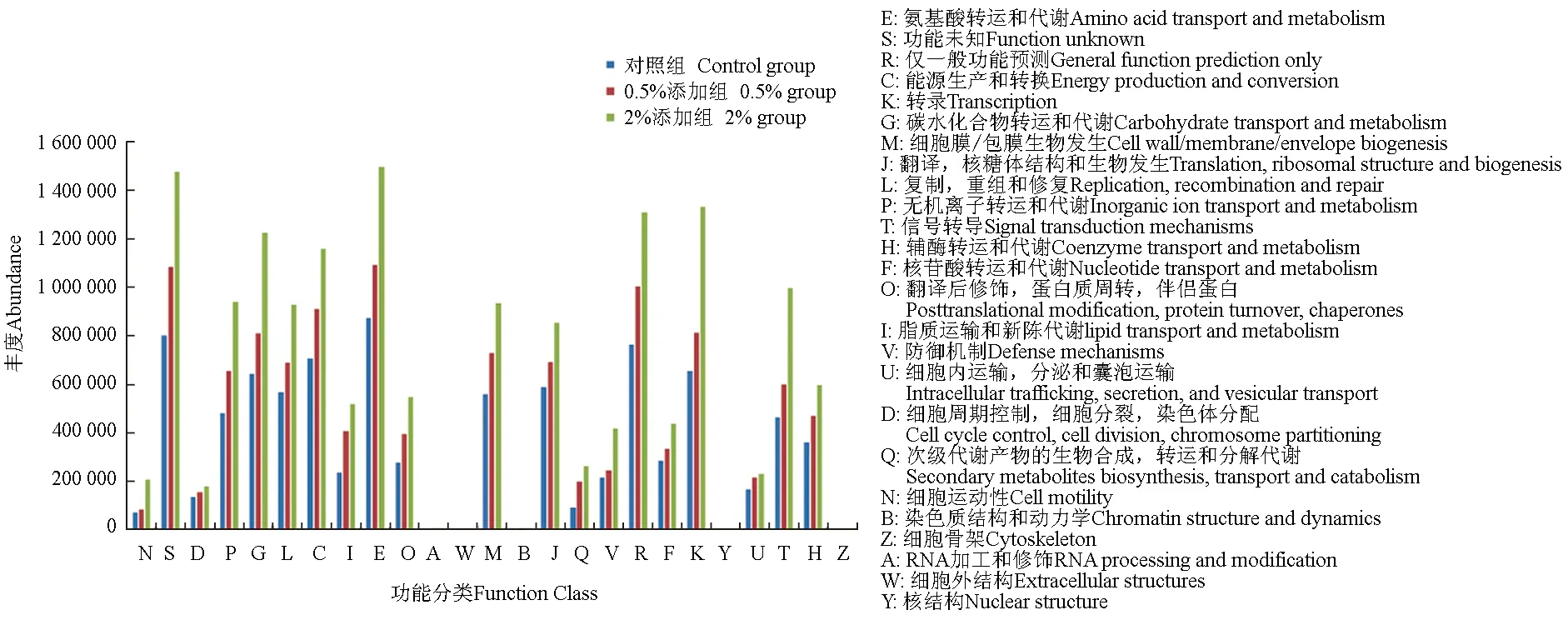
图9 3组肠道微生物同源蛋白簇功能分类柱状图Fig.9 The functional classification histogram of homologous protein clusters of intestinal microorganisms in the three groups
3.2 微生态制剂对草鱼肠道消化酶以及肠道组织的影响
本试验中,随着微生态制剂添加量的增加,肠伸展率、中肠肌层厚度和绒毛长度逐渐增加。肠道是鱼类重要的消化器官,肠道组织学和形态学指数在确定摄食与同化之间功能关系中具有重要作用,肠道绒毛结构的完整与摄食相关[20]。肠绒毛形态变化直接影响绒毛的表面积和对营养物质的吸收能力[21],说明添加微生态制剂扩大草鱼营养物质吸收的有效区域,增加草鱼对营养的吸收效率。黄灿等[22]报道,枯草芽孢杆菌可修复嗜水气单胞菌(Aeromonashydrophila)造成的草鱼肠黏膜结构损伤,对维持肠道的正常形态与功能起到了重要的作用。邱燕[23]研究表明,在草鱼饲料中添加枯草芽孢杆菌或酵母培养物,随添加量的增加,各试验组肌层厚度、微绒毛高度、淀粉酶均高于基础组,这与本试验结果一致。本研究引入一个评价肠道质量的新指标——肠伸展率,添加微生态制剂后肠伸展率有显著的提高,表明草鱼消化道结构更好、厚薄更均匀,肠道更富有弹性,有利于蠕动,进而促进饲料在草鱼肠道中消化吸收。而肠道中消化酶的活性直接关系着动物的消化吸收能力,间接影响了动物的生长。据报道,枯草芽孢杆菌可产生许多消化酶,对多种营养物质的消化均有促进作用[24]。王子彦等[25]用芽孢杆菌饲喂鲤鱼后,肠道淀粉酶活性比对照组提高3.82倍。本试验中草鱼中肠淀粉酶和脂肪酶活力随微生态制剂添加量的增加而升高,2%添加组显著高于对照组和0.5%添加组,这与已有报道一致。
3.3 微生态制剂对草鱼肠道菌群的影响
肠道内正常的微生物菌群能促进鱼类消化吸收营养物质,调节鱼类的免疫功能,维持其机体的健康[26]。机体的饮食影响鱼类肠道菌群的数目和种类[27]。在本试验中2%添加组草鱼肠道菌群丰富度指数、多样性指数以及菌群结构与对照组间存在较大差异。0.5%添加组与对照组差异不显著,其原因可能是0.5%添加量较少,还不足以引起显著差异。维恩图显示,3组草鱼肠道的核心菌群相似。对照组主要由梭杆菌门、厚壁菌门、变形菌门以及拟杆菌门组成,与Wu等[28]研究结果类似。本试验中,随着微生态制剂添加量的增加,梭杆菌门丰度持续下降。Koren等[29]认为,梭杆菌门中的一些成员与低密度脂蛋白胆固醇和总胆固醇的含量呈正相关。推测梭杆菌门相对丰度的降低可能会促进机体对脂类的利用。在属水平上,2%添加组鲸杆菌属丰度由63.31%降至3.83%,李东亮[30]研究得出,易感染肾致病菌草鱼肠道鲸杆菌属丰度增加,这为本研究提供了一个反证,提示鲸杆菌属相对丰度的降低可提高机体免疫力。本研究中,草鱼肠道菌群中厚壁菌门的丰度先降后升,但其中的Paeniclostridium和Erysipelatoclostridium丰度大幅上升。这两个菌属在水产上的相关研究较少,Nguyen等[31]发现,PaeniclostridiumsordelliiATCC9714T能产丁酸。而Erysipelotrichaceae通常被认为是丁酸的产生菌[32]。在饲料中添加适宜量的丁酸钠可提高草鱼特定生长率和饲料效率,使肠道更健康,各种消化酶活力升高[33]。丁酸也可为机体上皮生长提供能量,改善肠道屏障功能以及保护机体免患结肠疾病[34]。Pozuelo等[32]发现,健康人肠道内Erysipelotrichaceae相对丰度更高,而肠道易激综合征患者Erysipelotrichaceae相对丰度减少,可能是由其产生的丁酸含量较少,使上皮的通透性增加。Woting[35]研究表明,Clostridiumramosum的存在与小肠葡萄糖和脂肪转运蛋白相关,且可以改善饲料效率。Yutin等[36]将Clostridiumramosum重新分类到Erysipelotrichaceae科的Erysipelatclostridium属。因此,可推断在本研究中Erysipelatoclostridium相对丰度的增加可能在机体体内丁酸的产生以及葡萄糖和脂肪的转运中起重要作用。2%添加组蓝藻细菌和分支杆菌的相对丰度较高,蓝藻细菌可在一定程度上改善水质,而分支杆菌和鲸杆菌属其具体作用机理在水生动物研究较少,有待进一步研究。本试验使用的复合微生态制剂中的3种菌在草鱼肠道菌群中均未发现,或丰度较低,推测可能是饲料膨化过程中菌均被杀死,主要起作用的是菌的发酵产物。在本试验中,随微生态制剂添加量增加,“能量产生与转换”、“碳水化合物运输与代谢”、“氨基酸运输与代谢”、“脂质运输与代谢”等相关代谢功能的丰度有所增加。Wu等[37]研究结果也显示,在正常草鱼肠道菌群中上述功能相关的肠道微生物占主导地位,并且草鱼的肠道微生物群在碳水化合物的转化和发酵中起作用,可为机体及其自身提供能量。推测本试验微生态制剂的添加可使草鱼肠道菌群朝更健康的方向变化。

