基于高通量测序的山羊卵巢基质、卵泡转录组分析
陆婷婷,邹 娴,杨镇玮,雷 放,陈奕业,柳广斌,孙宝丽,刘德武,李耀坤
(1 华南农业大学 动物科学学院,广东 广州 510642; 2 广东省农业科学院 动物科学研究所/畜禽育种国家重点实验室/广东省畜禽育种与营养研究重点实验室,广东 广州 510640)
山羊Capra hircus繁殖力影响养羊业的经济效应,受遗传、营养、管理水平等因素影响,是复杂的数量性状。母羊的产羔数是山羊繁殖性能之一,由排卵数决定,主要受遗传因素影响,与卵泡发育息息相关[1]。卵泡发育是一个极其复杂的过程,在发育过程中绝大多数卵泡会闭锁,只有少数卵泡能成熟并排卵[2-3]。
目前,关于整个卵巢的研究越来越多[4-5],但卵巢作为一个动态发育的生殖器官,包含不同发育阶段的卵泡,如原始卵泡、生长卵泡、成熟卵泡等。因此,在研究卵巢时,有必要对其细分后再开展研究。Terenina等[6]对猪卵巢健康小卵泡和闭锁小卵泡转录组的研究发现CCDC80、GADD45A、ZNF628等基因在闭锁小卵泡中的表达量超过健康小卵泡5倍,认为可能是卵泡闭锁的标志基因。Zhang等[7]在猪健康卵泡和早期闭锁卵泡的转录组研究中发现450个显著差异表达基因。李鹏飞等[8-9]对牛的优势卵泡和从属卵泡进行转录组测序发现差异显著的PRSS35、PTGRF和ARID4B等基因与卵泡发育相关。Hatzirodos等[10]在牛健康大卵泡和健康小卵泡的转录组研究中发现,在大卵泡中STAT4和XBP1基因表达上调,MGEA5基因下调;而KIT、IHH和MEST基因在小卵泡中最为活跃。吴阳升等[11]通过分析绵羊小卵泡和中卵泡转录组发现,在中卵泡表达上调的基因有IGFBP1、INHBA和TIMP1等,下调的有C-FOS、EGR1、FOSB等。综上,猪、牛和绵羊不同发育阶段卵泡的基因表达模式不同,然而山羊的卵泡转录组研究以及卵巢基质和卵泡之间的基因表达模式鲜见报道。
川中黑山羊是我国优秀的地方山羊品种[12],经过长期的自然和人工选择,繁殖性能突出,遗传性能稳定,母羊平均产羔率为236.78%,羔羊成活率为91%[13]。目前对川中黑山羊繁殖性能的研究较少。转录组包括编码RNA和非编码RNA,指在某一特定条件下细胞或组织内所有转录产物的总和,从整体水平研究基因结构和功能[14]。转录组测序是通过高通量测序技术,对生物体全部基因的测序,反映生命体处于不同环境条件下的不同基因表达水平及调控模式[15]。本研究以发情期的川中黑山羊为研究对象,应用高通量测序技术对卵巢基质、大卵泡和小卵泡进行转录组测序,比较分析三者的转录水平差异,探索卵巢基质、大卵泡和小卵泡间的mRNA表达模式。旨在从转录组水平揭示卵巢不同部位的遗传差异,丰富山羊卵巢基质、大卵泡和小卵泡的转录组数据信息,筛选出的基因可为山羊卵泡发育提供一定的基因资源和新的研究方向。
1 材料与方法
1.1 试验动物和样品采集
选用南方某种羊场10头健康的川中黑山羊母羊,年龄3.5~4.5岁。采用前列腺素1次注射法对每只母羊注射氯前列烯醇0.1 mg,24 h后第1次发情,18 d后确认第2次发情,采用公羊试情法确认母羊是否发情,以母羊摇尾、站立并接受爬跨视为发情[16-19]。发情后24 h内进行屠宰并采集卵巢。
卵巢用PBS缓冲液洗3次,分离小卵泡(Small follicle,SF,d<3 mm)、大卵泡 (Large follicle,LF,d>1 cm)和卵巢基质,各6个重复组,其中1个小卵泡样本包含8~10个小卵泡,1个大卵泡样本仅包含1个大卵泡,连同分离后的卵巢基质放入冻存管,立即置于液氮中,带回实验室于−80 ℃冰箱保存,用于后续试验。试验所得的卵巢基质样品中有少量d<3 mm 的小卵泡,所有d>1 cm 的大卵泡已分离出来。
1.2 总RNA抽提、cDNA文库构建和转录组测序
将卵巢基质、大卵泡和小卵泡完全研磨,用Trizol试剂提取总RNA(Invitrogen,美国)。通过DanoDrop ND-2000 分光度计 (Thermo Science,美国)、10 g/L琼脂糖凝胶分别检测RNA的浓度和纯度、完整性。每个样品取3 μL总RNA,构建cDNA文库,利用Illumina HiSeq测序平台进行双末端测序。整个流程委托上海派森诺生物科技股份公司完成。
1.3 转录组数据分析
对测序数据采用Cutadapt软件去除3′端的接头,去除的部分与接头有至少10 bp重叠(AGATC GGAAG),允许20%碱基错配;去除平均占比低于Q20(碱基识别准确率在99%以上的碱基所占百分比)的Reads。通过Bowtie2软件(GCF_001704415.1_ARS1_genomic;http://www.ensembl.org/)建立参考基因组索引,使用Tophat2软件的microexon-search和library-type=fr-firststrand参数将过滤后的Reads比对到参考基因组上,默认Reads和参考基因组序列的碱基错配在2个之内即为比对成功。采用R语言DESeq程序包对差异基因进行筛选,条件为:|log2表达差异倍数|>1,显著性P<0.05,至少有4个样品的FPKM(每百万Reads中来自某一基因每千碱基长度的 Reads数目,Fragments per kilobase per million of reads)大于 1。通过 R 语言 Pheatmap软件包对所有基因和样品进行双向聚类分析。
1.4 差异基因功能注释
利用Gene ontology(GO)数据库对所有差异基因进行注释,通过 Kyoto encyclopedia of genes and genomes(KEGG)数据库对差异基因进行通路分析,采用超几何分布计算差异基因显著富集的GO条目和KEGG通路,P<0.05为显著富集。
1.5 qRT-PCR验证分析
从差异基因中随机选择5个基因,利用qRTPCR进行转录组表达谱验证分析,PCR反应体系10 μL:5 μL SYBR®Green Master Mix,上下游引物各 0.5 μL,1 μL cDNA 和 3 μL ddH2O。反应条件:95 ℃,1 min;95 ℃,30 s,58 ℃,30 s,72 ℃,1 min,34个循环。引物设计参考NCBI的山羊相关基因序列,β-actin作为内参基因,用Primer 5.0软件设计,并送 Sangon Biotech 合成引物 (表1)。

表1 用于qRT-PCR检测的基因引物Table 1 Gene primers for qRT-PCR detection
1.6 数据统计分析
试验数据用SPSS 22.0统计软件分析,通过独立样本t检验来进行差异显著性分析。
2 结果与分析
2.1 测序数据质控
将本研究所得的测序数据经过质量控制,对Clean reads进行碱基含量分布和碱基质量分布统计,Q30(碱基识别准确率在99.9%以上的碱基所占百分比)在91%以上,测序数据与山羊的数据库序列相似性在83%以上(表2)。综合表明测序数据质量好,满足后续分析的要求。
2.2 差异基因筛选
测序结果分析表明,卵巢基质和大卵泡之间显著差异表达的基因总数为524个,其中显著上调的有238个,显著下调的有286个;卵巢基质和小卵泡之间显著差异表达的基因总数为180个,其中显著上调的有25个,显著下调的有155个;大卵泡和小卵泡之间显著差异表达的基因总数为403个,其中显著上调的有281个,显著下调的有122个。结合近年哺乳动物中与卵泡发育相关的基因的报道[6,20-33],我们发现本试验中15个差异表达的基因可能与卵泡发育相关,包括INHA、INHBA、CYP19A1、MGST1、BEX2、APOA1、APOA2、MMP15、CITED1、PRSS23、LRP8、ADAMTS1、SPARCL1、TNFRSF1B和TNFRSF19。按照P值大小筛选排名前10的差异表达基因,再根据差异倍数从大到小进行排序[34-35],结果如表3所示。通过聚类图(图1)发现,卵巢基质、大卵泡和小卵泡各样本的基因分别聚类在一起,且同一组几个不同样本聚类在同一个簇中。此外,卵巢基质与小卵泡间差异基因的数量最少,且大部分基因表达量相似(图1),推测小卵泡和卵巢基质间的表达模式较为相似。大卵泡与卵巢基质、小卵泡的差异表达基因数量较多,且表达量相差较大,推测大卵泡与卵巢基质、小卵泡的基因表达模式差异较大。

表3 不同卵巢部位间排名前10位的差异表达基因Table 3 Top ten differentially expressed genes among different parts of ovary
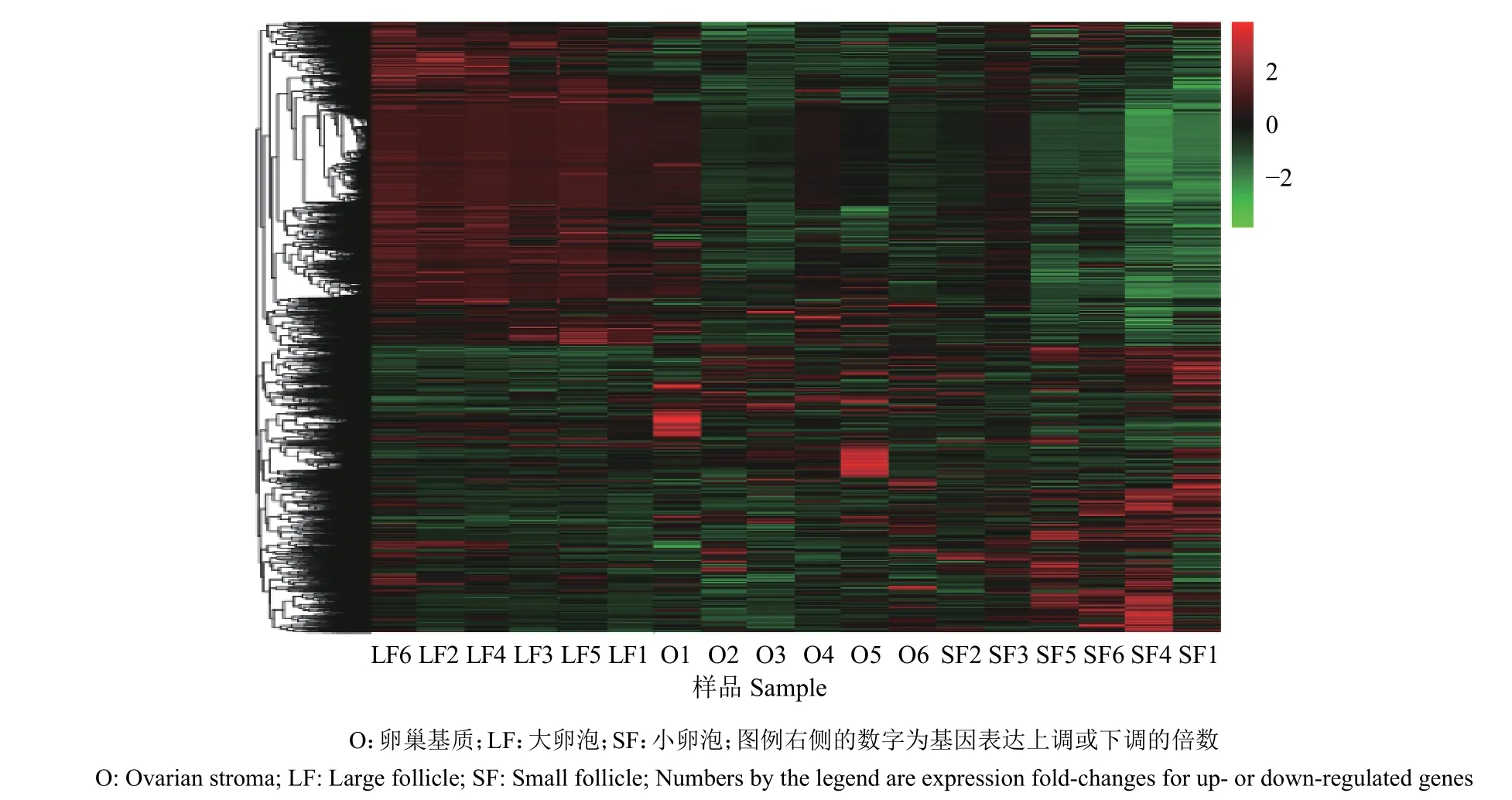
图1 不同卵巢部位间差异表达基因的聚类图Fig. 1 Cluster analysis of differentially expressed genes among different parts of ovary
2.3 共有的差异表达基因
在卵巢基质vs大卵泡、卵巢基质vs小卵泡、小卵泡vs大卵泡这3组中有4个共有的差异表达基因;卵巢基质vs大卵泡、卵巢基质vs小卵泡之间有73个共有的差异表达基因;卵巢基质vs大卵泡、小卵泡vs大卵泡之间有186个共有的差异表达基因;卵巢基质vs小卵泡、小卵泡vs大卵泡之间有29个共有的差异表达基因。
2.4 差异表达基因的生物学功能分析
基于GO数据库,对差异基因进行功能分类,各功能分类下差异前10位的GO条目如表4、表5和表6所示。在卵巢基质vs大卵泡(表4)中有15个GO条目显著富集(P<0.05),包括催化活性、细胞质、细胞膜、细胞内膜结合细胞器、转移酶活性等。在卵巢基质vs小卵泡(表5)中有25个GO条目显著富集(P<0.05),包括小分子结合、碳水化合物衍生物结合、核苷酸结合、磷酸核苷结合、嘌呤核苷三磷酸结合等。在小卵泡vs大卵泡(表6)中有64个GO条目显著富集(P<0.05),包括细胞过程、细胞内部、线粒体部分、嘌呤核苷酸结合等。

表4 卵巢基质vs大卵泡部分差异表达基因的GO功能分类Table 4 GO functional classification of partial differentially expressed genes in ovarian stroma vs large follicle

表5 卵巢基质vs小卵泡部分差异表达基因的GO功能分类Table 5 GO functional classification of partial differentially expressed genes in ovarian stroma vs small follicle
基于KEGG数据库的通路富集分析(各组对比项目中前10位的信号通路见表7),在卵巢基质vs大卵泡中差异表达基因涉及55条通路,显著富集的通路有46个(P<0.05),包括氧化磷酸化、代谢途径、内质网蛋白质加工、柠檬酸循环、类固醇生物合成等。在卵巢基质vs小卵泡中差异表达基因涉及27条通路,显著富集的通路有17个(P<0.05),包括细胞周期、错配修复、DNA复制、卵母细胞减数分裂、RNA转运、孕酮介导的卵母细胞成熟等。在小卵泡vs大卵泡中差异表达基因涉及42条通路,显著富集的通路有30个(P<0.05),包括氧化磷酸化、蛋白酶体、内质网蛋白质加工等。

表6 小卵泡vs大卵泡部分差异表达基因的GO功能分类Table 6 GO functional classification of partial differentially expressed genes in small follicle vs large follicle

表7 卵巢基质、大卵泡和小卵泡部分差异表达基因的KEGG代谢通路Table 7 KEGG metabolic pathway of partial differentially expressed genes in ovarian stroma, large follicle and small follicle
2.5 基因筛选及qRT-PCR验证分析
从3组差异基因中筛选5个基因,分别是CYP19A1和INHBA(卵巢基质vs大卵泡)、GPNMB(卵巢基质vs小卵泡)、KITLG和SFRP1(小卵泡vs大卵泡),进行qRT-PCR验证(图2)。这些基因的表达变化趋势与测序结果基本一致,说明测序结果可靠。
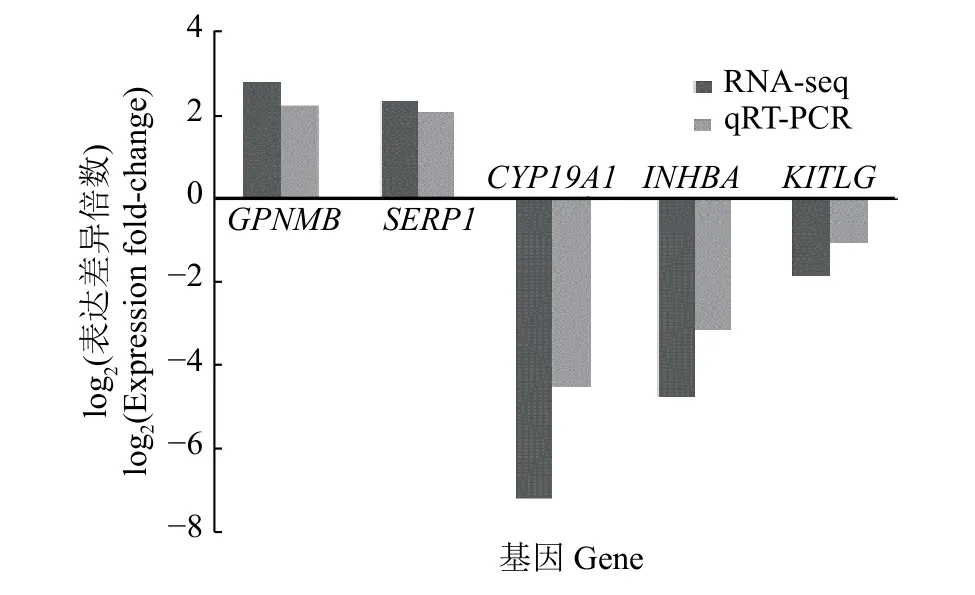
图2 不同卵巢部位间差异表达基因的qRT-PCR验证Fig. 2 Quantitative identification of differentially expressed genes among different parts of ovary by qRT-PCR
3 讨论
山羊性成熟时,以卵泡波的形式募集卵泡,并使卵泡发育至成熟排卵[36]。在形成有腔卵泡之前,卵泡的发育不受生殖激素调控,发育比较缓慢;在形成腔体时,性腺轴会分泌激素,促进卵泡发育或闭锁[37-38]。山羊是单胎或双胎动物[3],与人类相似,研究卵泡不同发育阶段的作用机制,山羊是较好的动物模型。
本研究采用高通量测序技术,首次对川中黑山羊的卵巢基质、大卵泡和小卵泡的mRNA表达量进行研究。结果表明卵巢基质、大卵泡和小卵泡的表达模式不同,其中卵巢基质和小卵泡的表达模式更相近,可能是因为在分离卵泡时,每个卵巢基质中d>1 cm的大卵泡已分离出来,但不可避免的,卵巢基质中含有少量的d<3 mm的小卵泡,从而造成卵巢基质和小卵泡的基因表达模式更相近。
通过差异基因分析,筛选出与其他哺乳动物卵泡发育或闭锁有关的基因,包括在大卵泡上调的抑制素基因家族、细胞色素P450家族19亚家族成员1(CYP19A1)、MGST1、BEX家族、APO家族、MMP家族、CITED家族、PRSS23、LRP8;在大卵泡下调的ADAMTS1、SPARCL1、TNFRSF家族。在猪[6]和牛[8,11]的研究中,抑制素基因家族在闭锁卵泡或小卵泡中低表达,通过负反馈调节抑制垂体分泌促卵泡激素,影响卵泡闭锁。INHA和INHBA在牛大卵泡上调[10],有助于卵泡膜产生雄激素并抑制垂体产生卵泡刺激素。CYP19A1的过表达增加大窦状卵泡类固醇合成[6-8],促进卵泡发育。谷胱甘肽代谢MGST1与细胞的代谢和解毒能力有关,其高表达可能表示健康卵泡的解毒能力更好[39]。BEX家族是X染色体连锁基因家族,BEX2在小卵泡低表达,引起线粒体凋亡,使细胞周期阻滞于G1期,从而调控颗粒细胞增殖和凋亡[9,40-41]。载脂蛋白APOA1在中卵泡中高表达,可能参与了卵泡的选择及发育过程[11]。基质金属蛋白酶 (Matrix metallopeptidase,MMP)家族是一类依赖金属锌离子的蛋白水解酶家族,能有效地降解细胞外基质,可能与卵泡体积的快速增大有关[11]。ADAMTS1基因家族与膜外结构域的分裂有关,在小卵泡中表达上调[9],在经产奶牛排卵前的卵泡中上调[42]。SPARCL1是SPARC家族一员,在小卵泡中高表达,阻滞细胞停留在G1期,抑制细胞增殖[9,43]。但IGFBP5、IGF1、MMP9、PGRMC1等基因的表达量与其他研究报道的不一致。值得注意的是,在本研究中经典颗粒细胞凋亡标志物TNF受体超家族(TNFRSF1B、TNFRSF19)在大卵泡中下调[8],与一些研究报道的无显著差异不同[6-7]。
进一步对差异基因功能分析发现,卵巢基质vs大卵泡、卵巢基质vs小卵泡、小卵泡vs大卵泡三者富集的通路大不相同,其中,卵巢基质vs大卵泡、小卵泡vs大卵泡富集的通路较多,且有大部分是相同的;而卵巢基质vs小卵泡富集的通路较少,与其他2组差异较大。说明可能是大卵泡的生物学功能较为丰富。功能富集表明不同组织表现出不同的富集特征,核苷酸结合和磷酸核苷结合过程在3组中都共同富集,但在卵巢基质vs大卵泡中,特有的GO条目包括RNA加工过程、细胞质、细胞内膜、酶的催化活性等,可能是因为大卵泡阶段代谢过程比较旺盛,大卵泡与卵巢基质之间物质运输比较频繁。在卵巢基质vs小卵泡中特有的GO条目有细胞应激反应、初级代谢过程等,可能是因为小卵泡正处于初级发育阶段。在小卵泡vs大卵泡中特有的GO条目有线粒体和线粒体膜、细胞器内膜等,可能是因为卵泡发育过程主要受到线粒体膜的调控。
与卵巢基质相比,柠檬酸循环和类固醇生物合成信号通路在大卵泡中上调。柠檬酸循环保证机体能量供给和促进物质代谢[44]。类固醇生物合成在卵泡发育中起着重要的作用[45],例如类固醇合成快速调节蛋白 (Steroidogenic acute regulatory protein,STAR)可介导胆固醇进入线粒体内膜,调控孕酮和雌激素的合成[46-48],影响卵泡发育;健康卵泡中CYP19A1的上调,促进孕烯醇酮形成,孕烯醇酮是黄体酮(Progesterone,P4)和雌二醇(Estradiol,E2)的底物,可能是促进卵泡发育的主要因素[7]。
在卵巢基质vs小卵泡中,差异基因富集的信号通路与细胞分裂周期有关。有研究[49-50]报道,在小鼠卵泡发育阶段,细胞周期、DNA复制和减数分裂等多个信号通路被激活,与本试验结果一致,可能在小卵泡阶段,卵母细胞发育上调了与细胞分裂相关的信号通路。
在小卵泡vs大卵泡中,差异基因富集的甲状腺激素信号通路、内质网蛋白质加工、AMPK信号通路、类固醇生物合成和Notch信号通路在猪[7]和牛[10]的卵泡转录组研究中均有报道。内质网蛋白质加工和甲状腺激素信号通路的显著富集,可能是因为随着卵泡发育,颗粒细胞分化成熟,甾体激素合成逐渐增强[51-52],物质代谢也因此增强。在人和大鼠的研究中发现[53],类固醇激素(如孕酮)与不同膜受体结合,抑制颗粒细胞的有丝分裂或凋亡,从而抑制卵泡发育或闭锁,维持卵泡的平衡状态。关于绵羊的研究发现,Notch信号通路调节细胞增殖、分化和凋亡,参与卵巢基质卵泡的发育[54]。
4 结论
卵巢基质、大卵泡、小卵泡的差异mRNA表达模式不相同,其中卵巢基质与小卵泡更相近。就卵泡发育而言,深入研究这些特异性mRNA在卵泡不同发育阶段的作用有着重要意义。本文从生物信息学角度分析卵巢不同组织表达谱,为下一步差异基因的功能验证及其在卵泡发育中的作用提供一定的理论基础。
致谢:感谢练志全帮助分离小卵泡和大卵泡,感谢赵智锋帮助分析转录组测序结果!

