免疫检查点抑制剂联合治疗:从机制到临床
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
以免疫检查点抑制剂(immune checkpoint inhibitor,ICI)为代表的癌症免疫治疗具有与既往传统放化疗和靶向治疗不同的机制,为肿瘤患者带来新的希望。多种ICI已被多国药品管理部门批准用于不同瘤种的治疗。尽管部分患者可获得长期持续应答,但ICI单药的客观缓解率(objective response rate,ORR)并不高,在某些二线及以上治疗的研究中应答率仅10%~20%[1-2]。如何充分利用这一新型治疗手段使更多患者获益是肿瘤学家关注的热点。临床研究显示,联合不同机制的ICI有助于提高疗效[3-7]。目前程序性死亡[蛋白]-1(programmed death-1,PD-1)抑制剂和溶细胞性T淋巴细胞相关抗原4(cytolytic T lymphocyte-associated antigen 4,CTLA-4)抑制剂的联合治疗方案已获美国食品药品管理局(Food and Drug Administration,FDA)批准用于不可切除或转移性黑色素瘤、初治中高危晚期肾细胞癌、经治DNA错配修复缺陷/高度微卫星不稳定(mismatch repair-deficient/microsatellite instability-high,dMMR/MSI-H)型转移性结直肠癌(metastatic colorectal cancer,mCRC)、索拉非尼经治肝细胞癌(hepatocellular carcinoma,HCC),以及初治非小细胞肺癌(non-small cell lung cancer,NSCLC)患者,在胃癌等其他瘤种中也观察到一定疗效。本文旨在对ICI联合治疗的机制、药代动力学及其用于不同瘤种的有效性和安全性进行综述。
1 ICI联合治疗的机制
1.1 抗PD-1和抗CTLA-4单克隆抗体的作用机制
Ipilimumab是最早获批用于癌症治疗的抗CTLA-4单克隆抗体(单抗)类ICI。CTLA-4是表达在调节性T细胞(regulatory T cell,Treg)、活化CD4+T细胞及耗竭样T细胞等表面的免疫抑制分子。抗原提呈细胞(antigen-presenting cell,APC)上的CD80/CD86通过与共刺激受体CD28结合活化免疫反应,而CTLA-4以更强的亲和力与CD28竞争结合CD80/CD86,使CD28从APC上脱落,从而限制其进一步介导免疫激活、诱导免疫耐受并产生耗竭样T细胞[8]。使用抗CTLA-4单抗可以阻断上述抑制作用,恢复由CD28与CD80/CD86结合介导的免疫激活信号,刺激淋巴结中肿瘤特异性T细胞活化和增殖。由于肿瘤微环境中也存在表达CTLA-4的Treg和耗竭样T细胞,因此抗CTLA-4单抗在肿瘤局部也可发挥作用[8-9]。此外,全人源性免疫球蛋白G1(immunoglobulin G1,IgG1)制剂ipilimumab与Treg细胞表面的CTLA-4分子结合还可发挥抗体依赖性细胞介导的细胞毒性(antibody-dependent cell-mediated cytotoxicity,ADCC)作用,诱导肿瘤微环境中的巨噬细胞清除高表达CTLA-4的Treg,保留低表达CTLA-4的CD8+效应T细胞,提高抗肿瘤免疫反应效率[10]。抗CTLA-4单抗还可在适应性免疫应答启动和早期阶段刺激Th1样CD4+T细胞扩增,促进记忆性T细胞的形成以及向肿瘤组织迁移[11]。
另一种免疫抑制分子PD-1通常表达在循环肿瘤特异性T细胞、肿瘤浸润淋巴细胞和肿瘤微环境中其他细胞表面,与表达在肿瘤细胞或肿瘤浸润免疫细胞表面的程序性死亡[蛋白]配体-1(programmed death ligand-1,PD-L1)结合,传递免疫抑制信号。使用抗PD-1或PD-L1单抗可阻断该抑制信号,增强CD8+效应T细胞增殖和肿瘤局部免疫应答。其他类型免疫细胞(如树突状细胞、B细胞)也可受PD-1/PD-L1通路抑制,因此抗PD-1或PD-L1单抗可同时产生非T细胞依赖的抗肿瘤效应[8,12]。
1.2 抗PD-1和抗CTLA-4的协同作用
CTLA-4和PD-1途径在抗肿瘤免疫中均扮演了“刹车”的角色,但两者在作用机制、主要作用部位(淋巴结和肿瘤微环境)和影响的免疫应答阶段(T细胞激活阶段和效应阶段)方面有所区别,因而同时阻断这两条通路极有可能发挥协同效应[1,8,13-14]。动物实验发现,与单独阻断PD-1相比,联合抗CTLA-4单抗可提高小鼠对肿瘤的免疫应答并促进产生记忆T细胞预防肿瘤复发[15],促进肿瘤退缩、减少Treg细胞和增强肿瘤局部淋巴细胞浸润的作用得到累加,耗竭样CD8+T细胞减少,激活的CD8+效应T细胞和Th1样CD4+效应T细胞增多[16]。流式细胞术分析显示,抗PD-1单药仅诱导PD-1+CD8+T细胞增殖,而联合组同时诱导PD-1+和PD-1低表达CD8+T细胞增殖[16]。
2 抗PD-1和抗CTLA-4联合治疗的药代动力学/药效动力学
药代动力学/药效动力学(pharmacokinetics/pharmacodynamics,PK/PD)分析显示,抗PD-1单抗纳武利尤单抗和抗CTLA-4单抗ipilimumab联用不影响ipilimumab的代谢清除[17]。与纳武利尤单抗单药相比,纳武利尤单抗清除率在联用ipilimumab每6周1 mg/kg时升高17%,联用ipilimumab每3周3 mg/kg时升高29%,联用ipilimumab每3周或每12周1 mg/kg时无明显差异[18]。针对不同人群的研究显示,亚洲或中国患者接受纳武利尤单抗、帕博利珠单抗(抗PD-1单抗)或ipilimumab单药治疗的PK/PD与非亚洲患者差异无统计学意义[18-19]。在中国经治实体瘤患者中开展的Ⅰ/Ⅱ期CheckMate-672研究旨在评估纳武利尤单抗3 mg/kg每2周1次联合ipilimumab 1 mg/kg每6周1次(队列A)、纳武利尤单抗3 mg/kg联合ipilimumab 1 mg/kg每3周1次共4次随后纳武利尤单抗240 mg每2周1次(队列B)、纳武利尤单抗1 mg/kg联合ipilimumab 3 mg/kg每3周1次共4次随后纳武利尤单抗240 mg每2周1次(队列C)3种剂量方案用于中国患者的PK/PD特征,初步结果显示,联合治疗中纳武利尤单抗和ipilimumab的PK数据与既往其他Ⅰ期研究中各单药治疗的PK数据相似[20]。
3 ICI联合治疗在多瘤种中的探索
3.1 不同瘤种临床试验中的有效性结果
黑色素瘤ICI联合治疗的优势最早在恶性黑色素瘤中被证实(表1)。全球Ⅲ期临床试验(CheckMate-067)中,初治不可切除或转移性黑色素瘤患者接受纳武利尤单抗联合ipilimumab治疗后,ORR(57.6% vs 19.0%)、主要终点无进展生存时间(progression-free survival,PFS;11.5个月 vs 2.9个月,P<0.001)和长期随访总生存(overall survival,OS;未达到 vs 19.9个月,5年OS率52% vs 26%,P<0.001)均优于ipilimumab单药[3-4,21]。此外,Ⅰb期临床试验中晚期黑色素瘤患者接受帕博利珠单抗联合ipilimumab治疗的耐受性尚可,ORR为61%,估计1年PFS率为69%,1年OS率为89%[22]。
3.1.1 肾细胞癌
全球Ⅲ期临床试验(CheckMate-214)中,初治中高危晚期肾细胞癌患者接受纳武利尤单抗(3 mg/kg)联合ipilimumab(1 mg/kg)治疗的ORR(42% vs 27%,P<0.001)和OS(未达到vs 26.0个月,P<0.001)均优于标准治疗舒尼替尼[23]。长达42个月的随访显示,联合治疗组维持OS获益(47.0个月 vs 26.6个月,P<0.001)[24]。
3.1.2 结直肠癌
dMMR/MSI-H肿瘤能产生大量突变和肿瘤新抗原,对ICI治疗有较好的应答。Ⅱ期临床试验(CheckMate-142)中,伴dMMR/MSI-H的经治mCRC(76%既往至少接受过二线治疗)患者接受纳武利尤单抗(3 mg/kg)联合ipilimumab(1 mg/kg)治疗的ORR为58%,1年PFS和OS率分别为71%和85%[25],同研究中纳武利尤单抗单药治疗队列中分别为32%、50%和73%[26]。联合治疗队列的PFS和OS曲线更平缓,24个月PFS率和OS率高达60%和74%,有效患者的疗效维持时间更长[25]。这些结果提示在阻断PD-1的基础上增加CTLA-4抑制剂有助于改善长期疗效。此外,CheckMate-142一线治疗队列显示纳武利尤单抗(3 mg/kg)每2周1次联合ipilimumab(1 mg/kg)每6周1次方案用于初治dMMR/MSI-H mCRC患者,ORR达到69%(其中6例完全缓解),24个月PFS和OS率分别为74%和79%[27]。NICHE研究还显示,可切除结肠癌患者接受1剂ipilimumab(1 mg/kg,第1天)联合2剂纳武利尤单抗(3 mg/kg,第1、15天)治疗后6周内手术,20例dMMR患者均达到病理学缓解[28],提示这种联合方案有望成为未来dMMR/MSI-H结直肠癌患者的标准新辅助治疗。
近年研究发现DNA错配修复功能完好/微卫星稳定(mismatch repair-proficient/microsatellite stable,pMMR/MSS)型结直肠癌中肿瘤突变负荷(tumor mutational burden,TMB)较高的患者接受ICI联合治疗可能有效。Ⅱ期临床试验CCTG CO.26中,TMB≥28个突变/Mb的难治性mCRC患者(绝大多数为pMMR)接受PD-L1抑制剂度伐利尤单抗联合CTLA-4抑制剂tremelimumab每4周1次治疗4个周期,OS优于最佳支持治疗对照组(5.5个月 vs 3.0个月,P=0.004);而在TMB<28个突变/Mb亚组中,两组OS差异无统计学意义[29]。
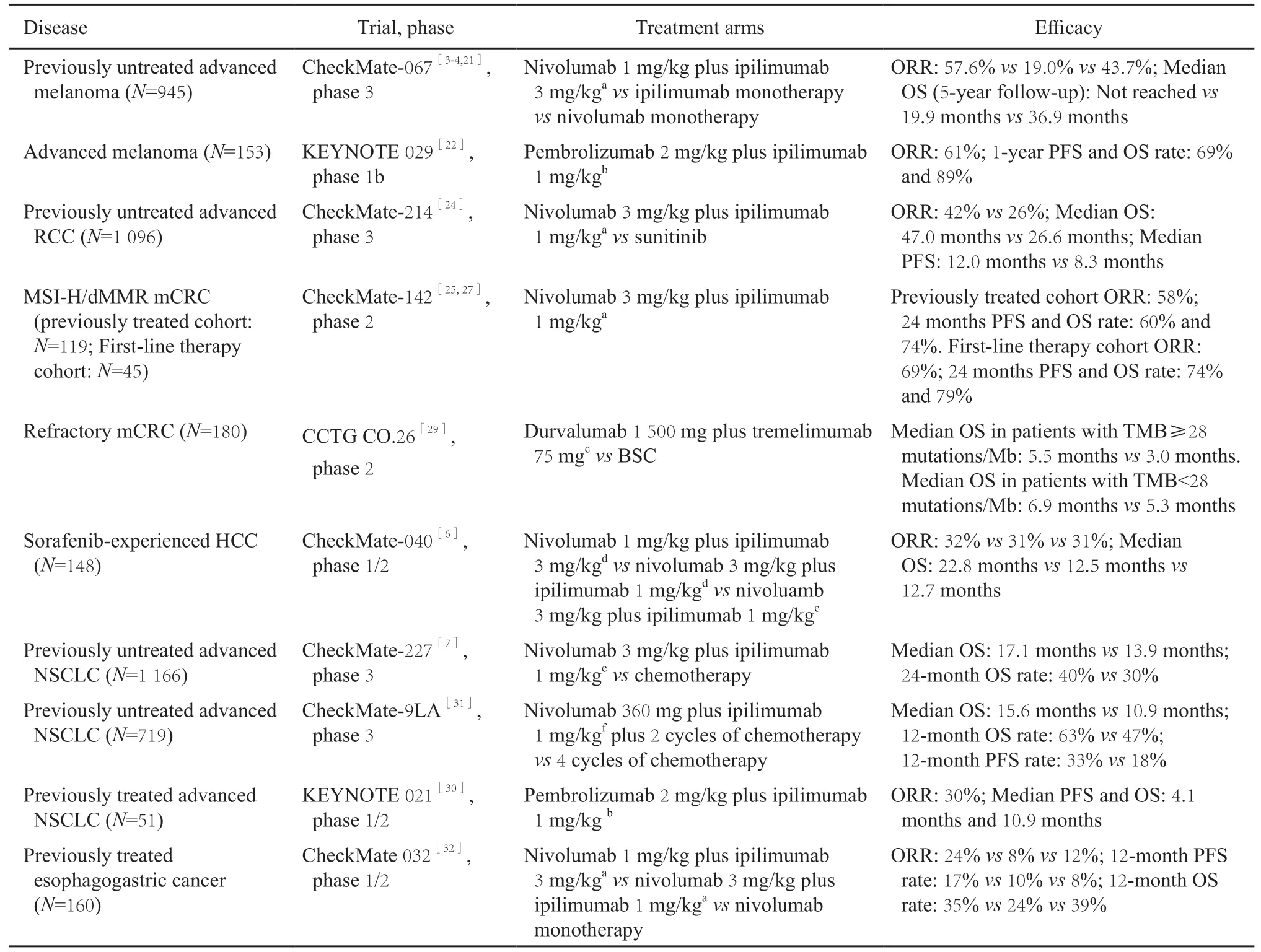
表1 ICI联合治疗在各瘤种中的临床有效性Tab.1 Efficacy of ICI combinations in different types of tumor
3.1.3 肝癌
Ⅰ/Ⅱ期临床试验(CheckMate-040)显示,接受不同剂量纳武利尤单抗联合ipilimumab治疗的索拉非尼经治HCC患者ORR为31%~32%,并且表现出持久应答;而同研究中接受纳武利尤单抗单药治疗的患者为14%~19%。与其他联合治疗剂量方案相比,接受纳武利尤单抗(1 mg/kg)联合ipilimumab(3 mg/kg)每3周1次治疗4个周期,后改为纳武利尤单抗240 mg每2周1次剂量方案治疗的患者中位OS较长[6]。
3.1.4 肺癌
近年来抗PD-1/PD-L1单抗已成为NSCLC的标准治疗之一,ICI联合治疗有望带来进一步获益。Ⅲ期临床试验(CheckMate-227)显示,初治NSCLC患者接受纳武利尤单抗(3 mg/kg每2周1次)联合ipilimumab(1 mg/kg每6周1次)治疗的OS优于化疗组(17.1个月 vs 13.9个月,HR=0.73,95% CI:0.64~0.84)。联合治疗在维持长期缓解方面有一定优势,PD-L1≥1%的患者中,联合治疗和纳武利尤单抗单药治疗组中位缓解维持时间分别为23.2和15.5个月;PD-L1<1%的患者中分别为18.0和8.3个月[7]。另一方面,评估帕博利珠单抗联合ipilimumab用于经治NSCLC患者的Ⅰ/Ⅱ期临床试验(KEYNOTE 021)未达到既定研究目标(ORR为30%,与ORR>20%的目标相比差异无统计学意义,P=0.085 8)[30]。此外,Ⅲ期临床试验(CheckMate-9LA)显示,另一种ICI双药联合2个周期化疗方案可有效地用于Ⅳ期NSCLC患者的一线治疗,与标准4个周期化疗相比,接受纳武利尤单抗、ipilimumab联合2个周期含铂双药化疗的患者OS明显延长,在中期分析时达到主要终点(HR=0.69,P=0.000 6),且获益不受患者PD-L1水平的影响[31]。
3.1.5 胃癌及食管癌
ICI联合治疗用于胃癌及食管癌患者的研究尚处于早期阶段,当前数据显示联合治疗获益并不明显。Ⅰ/Ⅱ期临床试验(CheckMate-032)显示,纳武利尤单抗单药、纳武利尤单抗1 mg/kg联合ipilimumab 3 mg/kg,以及纳武利尤单抗3 mg/kg联合ipilimumab 1 mg/kg治疗的化疗难治性胃、食管或食管胃交界处癌患者,ORR分别为12%、24%和8%,12个月OS率分别为39%、35%和24%[32]。
由于空气-水冷却器要座落在电机顶部,电机顶部必须加接口和开孔,所以初轧和精轧预先制订了安装工序,如图3所示,以保障现场改装的顺利进行。安装工序制订后,与港陆厂有关技术人员商讨,并取得一致意见。
3.2 瘤种和剂量对联合治疗有效性的潜在影响
不同瘤种患者在肿瘤微环境中导致免疫抑制的机制、TMB、新抗原形成、抗原释放、免疫原性水平等方面均存在一定的潜在差异,可能影响T细胞激活和抗肿瘤免疫应答[14,33],由此可导致不同瘤种患者治疗有效性的差异。不同ICI联合治疗剂量方案对疗效的影响可能源于IgG1分子ipilimumab的ADCC作用。大多数抗PD-1/PD-L1制剂无ADCC作用,在机体中表现为纯拮抗作用,超过一定剂量后不提高疗效,而ipilimumab的剂量与疗效和安全性均有明显相关性[34-35]。已获美国FDA批准的剂量方案见表2。
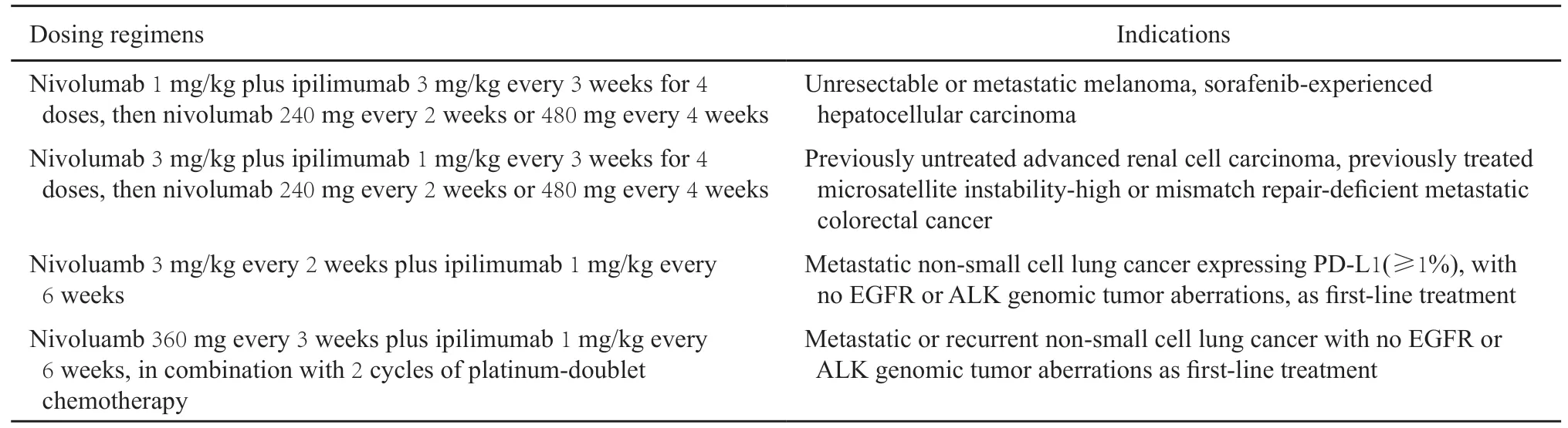
表2 已获美国FDA批准的ICI联合治疗用药方案Tab.2 Dosing regimens of ICI combinations approved by U.S.Food and Drug Administration
此外,一些研究显示,ICI的疗效可受患者体质量指数(body mass index,BMI)的影响,其原因可能与高BMI患者的免疫抑制表型和慢性炎症患病率较高有关[36-37]。Donnelly等[38]报告超重(BMI 25~30 kg/m2)和肥胖(BMI≥30 kg/m2)恶性黑色素瘤患者联合治疗后的PFS获益明显优于体质量正常的患者;Naik等[39]报告此类获益仅限于轻度肥胖(BMI 25~35 kg/m2)患者。体质量因素对其他瘤种患者ICI联合治疗效果的影响有待进一步评估。
3.3 ICI联合治疗的安全性
接受ICI联合治疗的患者不良事件发生率总体高于单药治疗组。上述多项临床试验中,接受纳武利尤单抗联合ipilimumab方案治疗患者≥3级的治疗相关不良事件(treatment-related adverse event,TRAE)发生率为20%~55%,而纳武利尤单抗单药治疗对照组中为12.9%~18.9%[3,5,7,23,27,30,32]。联合治疗中TRAE发生率与CTLA-4单抗剂量相关。例如近期研究中接受纳武利尤单抗3 mg/kg联合ipilimumab 1 mg/kg方案治疗的患者≥3级TRAE发生率可控制在30%左右,低于较早研究中使用ipilimumab 3 mg/kg的方案(>50%,表3)。
尽管ICI联合治疗的TRAE发生率高于ICI单药,但可能仍低于其他传统治疗(化疗或靶向治疗),或与之相似。CheckMate-214研究中,纳武利尤单抗联合ipilimumab和舒尼替尼对照组≥3级TRAE发生率分别为46%和63%[23];CheckMate-227研究中,纳武利尤单抗联合ipilimumab组和化疗对照组该比例分别为32.8%和36.0%[7]。
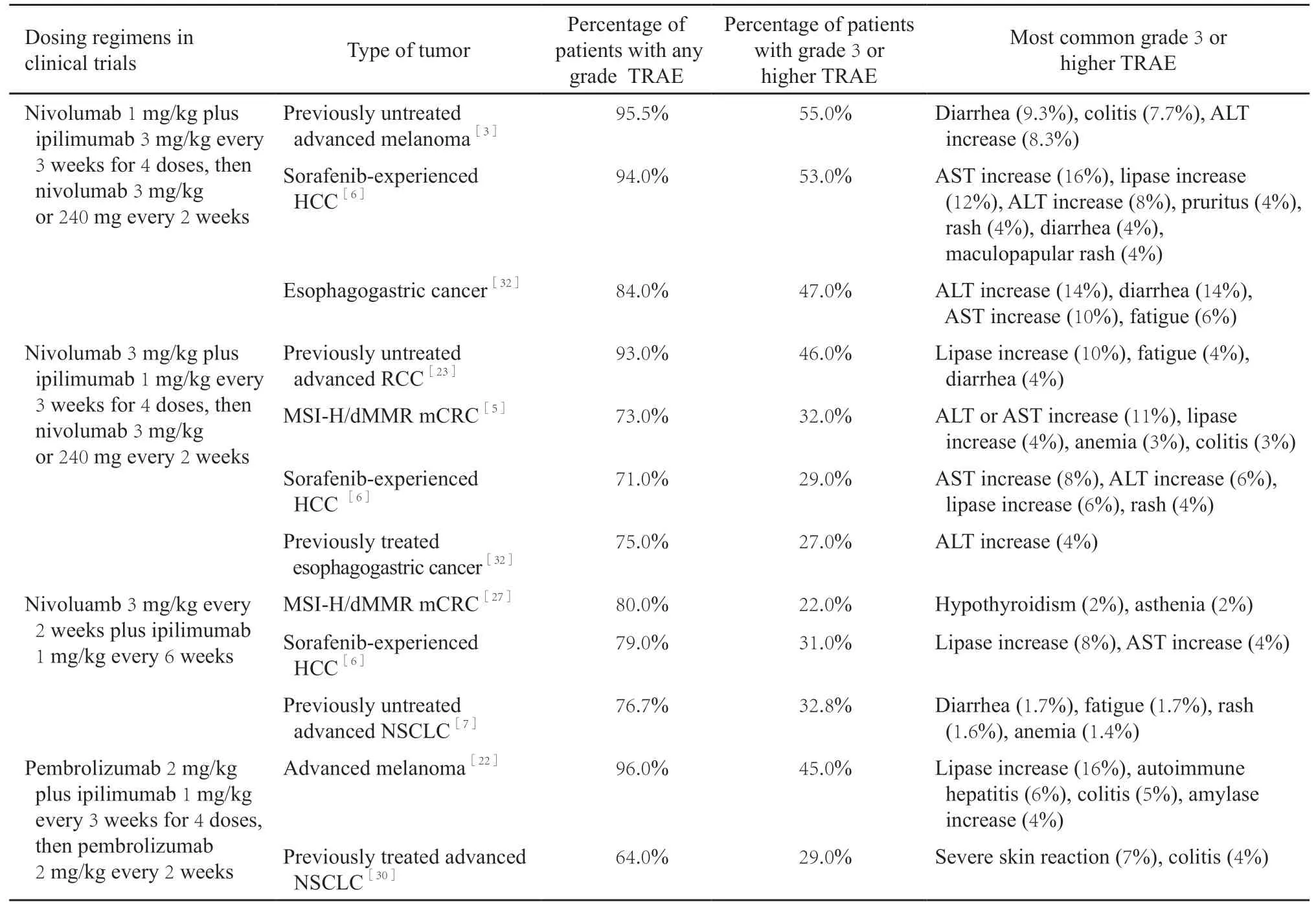
表3 ICI联合治疗的剂量方案与安全性Tab.3 Safety of ICI combinations in different dosing regimens
ICI相关不良事件具有一定的特征性。与抗PD-1/PD-L1单抗单药相比,ICI联合治疗中发生消化系统(腹泻和结肠炎)、内分泌(垂体炎、甲状腺功能障碍)和肝脏(肝酶升高)免疫治疗相关不良反应(immune-related adverse event,irAE)的风险较高,临床用药时应尤其关注[40]。Meta分析结果显示,接受抗PD-1/PD-L1单抗联合抗CTLA-4单抗治疗患者的irAE死亡发生率为1.23%,死亡风险较高的irAE包括结肠炎和心肌炎[41],但该研究未考虑治疗剂量的影响,不同剂量联合治疗方案的irAE死亡风险有待进一步评估。在接受ICI联合治疗的结直肠癌患者中,无一例患者发生irAE死亡[5,27]。
4 结语
对于符合适应证的肿瘤患者,应用不同机制的ICI联合治疗具有强效和持久的抗肿瘤疗效。近期获批和目前在临床试验中常用的抗PD-1单抗联合抗CTLA-4单抗剂量方案的不良事件发生风险较低、安全性可管理,为晚期肿瘤患者提供了一种新的治疗选择。
如何在更好发挥ICI联合治疗优势的同时减少其不良反应是近阶段研究者关注的热点。近期动物实验显示,预防性使用肿瘤坏死因子(tumor necrosis factor,TNF)抑制剂可改善抗PD-1单抗联合抗CTLA-4单抗治疗产生的相关结肠炎,并提高抗肿瘤效果[44],相关Ⅰ期临床试验正在进行中。IDO-1抑制剂、OX-40抑制剂、CSF1R抑制剂等正在开发中的新型免疫药物能否与现有ICI产生协同作用并在安全性可控的前提下提高抗肿瘤作用也有待进一步观察。此外,许多患者可能在开始免疫联合治疗之初疗效较好,但最终仍发生进展,因此ICI单药和联合治疗的潜在耐药机制,包括基因JAK1/JAK2突变导致干扰素γ信号失活、抗原提呈蛋白β2微球蛋白截短突变导致Ⅰ类主要组织相容性复合体抗原表达下降[45],以及T细胞活化的抑制受体(V-domain immunoglobulin-containing suppressor of T cell activation,VISTA)上调[46]等也值得进一步研究。除上述几点以外,今后还有必要在更多临床试验中探索对于不同瘤种和不同疾病特征的患者人群最为合适的免疫联合治疗药物和剂量方案,也需要寻找更为精确的生物标志物来选择可能有更多获益的人群。

