电催化内炔烃的卤磺酰化反应
黎奕斌 黄志星

摘 要:烯基砜类化合物是良好的有机合成中间体,而炔烃的卤磺酰化是合成烯基砜类化合物的最佳方法之一。然而,内炔烃的卤磺酰化报道较少。该研究电催化磺酸钠、炔烃和碘化钾3个组分反应,高效、绿色地实现了内炔烃的卤磺酰化反应。为了优化反应条件,我们同时探索了电解质/卤源、溶剂、电极、电压和温度等对该反应进度的影响。
关键词:电催化 内炔烃 卤磺酰化反应 高效绿色
中图分类号:O621.251 文献标识码:A文章编号:1672-3791(2020)12(c)-0034-04
Electrocatalytic Halosulfonylation of Internal Alkynes
LI Yibin1 HUANG Zhixing2
(1.School of Pharmaceutical Sciences, Southern Medical University, Guangzhou, Guangdong Province, 510515 China; 2.School of Pharmacy, Guangzhou Medical University, Guangzhou,
Guangdong Province, 510000 China)
Abstract: Alkenyl sulfone compounds are good intermediates for organic synthesis. Sulfonylation of alkynes is one of the best methods available for their smooth access. However, the halosulfonylation of internal alkynes is rarely reported. This research electrocatalyzes the three-component reaction of sodium sulfonate, alkyne and potassium iodide, and realizes the halogen sulfonylation reaction of internal alkyne with high efficiency and green. In order to optimize the reaction conditions, we also explored the effect of electrolyte/ halogen source, solvent, electrode, voltage and temperature on the reaction progress.
Key Words: Electrocatalysis; Internal alkynes; Halosulfonylation reaction; Efficient and green
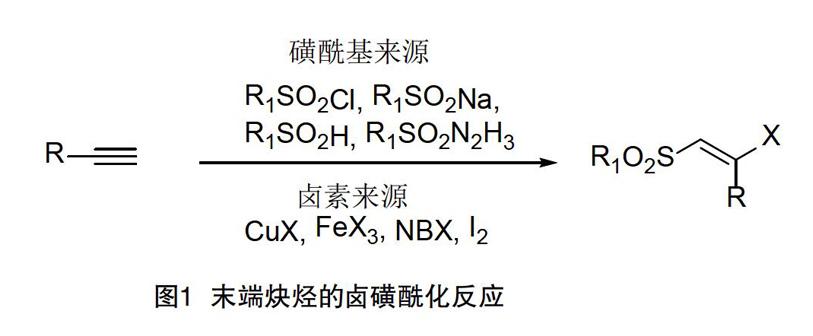
炔烴官能化在植物体内和生物活性分子中普遍存在,是有机合成中的重要反应[1]。多取代烯烃的合成是一项艰巨的任务,特别是四取代烯烃的合成给化学家提出了严峻的挑战[2]。其中,烯基砜类化合物是合成活性药物、性能材料的关键中间体,因此,在医药和光电材料等领域得到广泛的应用[3-4]。炔烃的卤磺酰化是合成烯基砜类化合物的最佳方法之一。炔烃的卤磺酰化还串联引入了另一个官能团(卤素),除了自身的重要性外,还可以通过化学转换衍生出结构多样的化合物[10-11]。化学家已成功实现了末端炔烃的卤磺酰化(见图1),但是对内部炔烃的卤磺酰化报道较少。内炔烃的空间位阻和电子区域选择是导致内炔烃的磺酰化难以实现主要原因[12]。2017年,Ravi等研究者利用丁基过氧化氢作为氧化剂,以磺酸钠、炔烃和碘为原料实现了内炔烃的卤磺酰化(图2a)。2018年,Ma和Wang等研究者同样在高温和双氧水氧化剂的催化下,以磺酸阱、炔烃和碘化钾为原料可控性的合成了(E)-β-碘乙烯基砜(图2b)。目前,内炔烃的卤磺酰化的方法仍需要使用有毒或危险氧化剂。
电化学方法进行碳碳键的生成和官能团的加成、取代、裂解、消去、偶合、氧化、还原以及利用媒质的间接电合成等反应,因此,引起了合成化学家的极大关注。在反应过程中,通过调节电流的传导电极或电极电位,使电子转移得到控制,从而避免有毒或危险氧化剂或还原剂。为寻找高效绿色的内炔烃的卤磺酰化反应,该研究基于电化学性质,电催化替代氧化剂催化,以磺酸钠、炔烃和碘化钾为原料,高效绿色的实现了内炔烃的卤磺酰化(图2c)。
1 实验部分
1.1 所用试剂与仪器
试剂:CDCl3(内标为TMS)、乙酸乙酯(分析纯)、石油醚(分析纯)、四氢呋喃(分析纯)、丙酮(分析纯)。
仪器:德国Bruker公司AVANCE Ⅲ 400MHz核磁共振仪、质谱仪(Bruker microTOF-QⅡ型)、熔点测定仪(XT-5型)、红外光谱仪(FTIRTensor 27型)、上海暗箱紫外分析仪(ZF-20D型)。
1.2 内炔烃的卤磺酰化反应
在配有两个铂金板作为阴极阳极的10 mL电解池中,加入1,6-烯炔1(0.2 mmol),对甲苯磺酰酸钠(0.6 mmol),KI(0.4 mmol),然后加入4 mL H2O溶解。70 ℃下以10 mA的恒定电流电解4.0 h。反应完毕后,电极用丙酮洗涤。用乙酸乙酯(3×10 mL)萃取,并用水洗涤,合并有机层,用无水硫酸钠干燥。过滤得有机相,减压浓缩除去乙酸乙酯。粗产物通过快速色谱纯化(石油醚/乙酸乙酯=10/1),得到产物。
2 结果与讨论
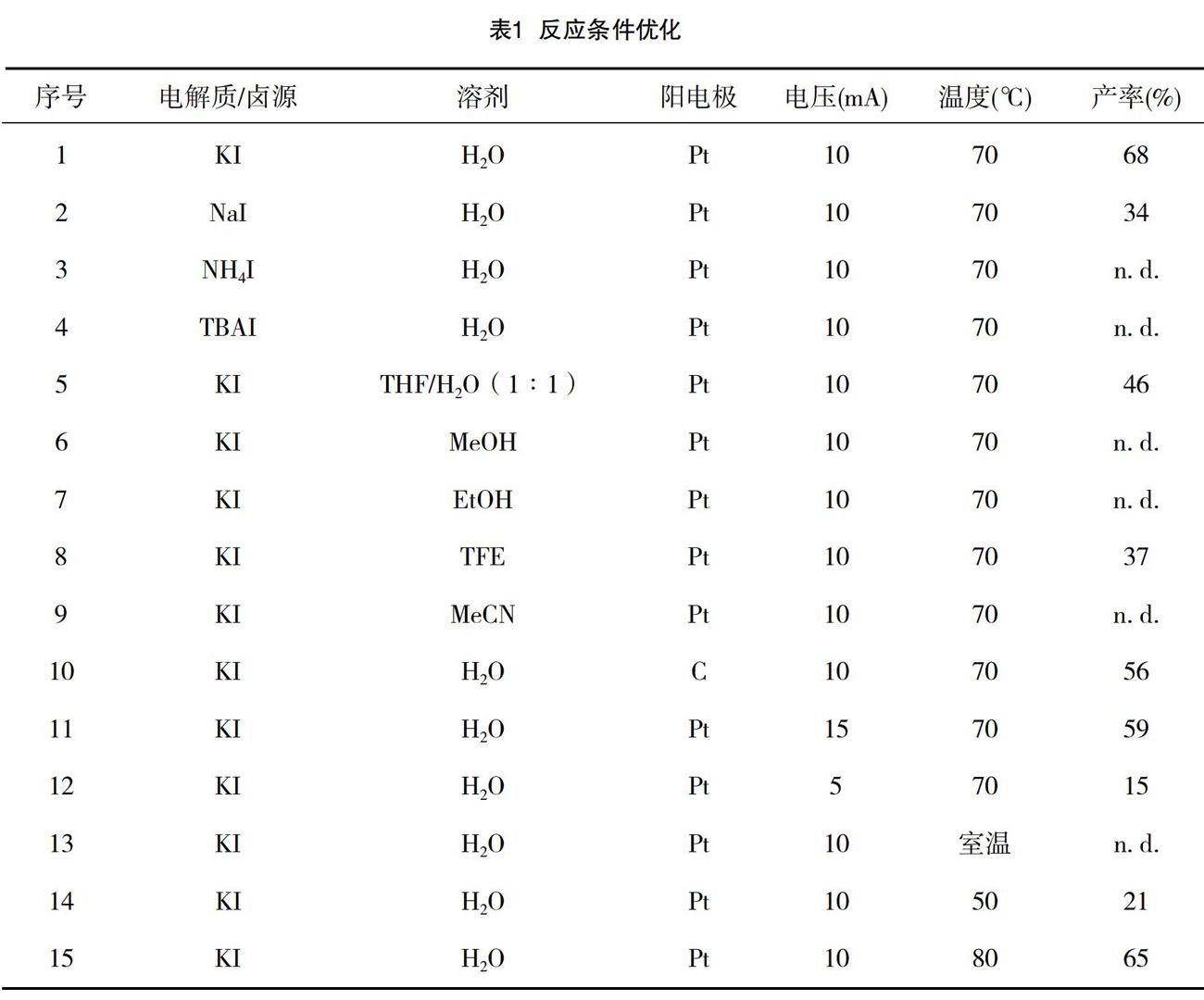
关于反应条件优化,按照图3化学式,我们选用对甲苯磺酸钠、苯乙炔烃、作为模型底物来探索该反应的最优条件(见表1)。我们在10 mL电解池中,加入1,6-烯炔(0.2 mmol),对甲苯磺酰酸钠(0.6 mmol),KI(0.4 mmol),然后加入4 mL H2O溶解。70 ℃下以10 mA的恒定電流电解4.0 h,得到目标产物,分离产率达68%(序号1)。第一步我们筛选电解质/碘源(1-4)使用,TBAI,NH4I时,基本没有目标产物生产,而使用NaI时,产率只有34%。第二步对溶剂进行筛选(序号5-9),使用MeOH、EtOH、MeCN时,基本没有目标产物生产。使用THF/H2O(1∶1)和TFE时,目标产物的产率分别是46%、37%。为了获得更好的反应结果,我们分别对阳电极,电压和温度等条件进行了筛选(序号10-15)。阳极用C替换Pt(序号10),产率为56%。使用15 mA、5 mA时(序号11-12),产率分别是59%、15%。在室温条件下(序号13),基本没有目标产物生产。使用50 ℃、80 ℃时(序号14-15),产率分别是21%、65%。综合考虑,在KI作为电解质/卤源,H2O做溶剂,Pt做阳极,70 ℃下以10 mA的恒定电流电解4.0 h为最佳条件。
3 结语
我们发展了一种电催化内炔烃的卤磺酰化反应的方法。通过一系列的条件筛选,进一步优化了反应条件,从而实现高效绿色的内炔烃的卤磺酰化。为四取代烯烃的合成,尤其是烯基砜类化合物的合成提供一种高效绿色的合成策略。
参考文献
[1] M.G. Organ, J.T. Cooper, L.R. Rogers, et al. Synthesis of Stereodefined Polysubstituted Olefins. 1. Sequential Intermolecular Reactions Involving Selective, Stepwise Insertion of Pd(0) into Allylic and Vinylic Halide Bonds. The Stereoselective Synthesis of Disubstituted Olefins[J]. The Journal of Organic Chemistry,2000,65(13):7959-7970.
[2] li yibiao,liv xiaohang,ma deyun,et al.Silver-Assisted Difunctionalization of Terminal Alkynes: Highly Regio-and Stereoselective Synthesis of Bromofluoroalkenes[J].Advanced Synthesis & Ca-talysis,2012,44(12):2683-2688.
[3] seo yean woo, ji hyun kim,mi kyeong moon,et al. Discovery of Vinyl Sulfones as a Novel Class of Neuroprotective Agents toward Parkinson's Disease Therapy[J].Journal of Medicinal Chemistry,2014,57(4):1473-1487.
[4] W. Doherty, J. James, P. Evans, et al. Preparation, anti-trypanosomal activity and localisation of a series of dipeptide-based vinyl sulfones[J].Organic & Biomolecular Chemistry,2014,12(38):7561-7571.
[5] Y. Fang, Z. Luo, X. Xu.Recent advances in the synthesis of vinyl sulfones[J].RSC Advances,2016, 6,(64):59661-59676.
[6] wan jieping, hu deping, bai teiching, et al, Stereoselective Z-halosulfonylation of terminal alkynes using sulfonohydrazides and CuX (X=Cl, Br, I) [J]. RSC Advances,2016,6(77):73132-73135.
[7] W.Wei,J.Wen,D.Yang,et al. Direct difunctionalization of alkynes with sulfinic acids and molecular iodine: a simple and convenient approach to (E)-β-iodovinyl sulfones[J].RSC Advances. 2015,5(6):4416-4419.
[8] Sawangphon,praewpan Katrun,kortua Chaisiwamongkhol,et al.An Improved Synthesis of Vinyl- and β-Iodovinyl Sulfones by a Molecular Iodine-Mediated One-Pot Iodosulfonation-Dehydroiodination Reaction[J].synthetic commu- nications,2013,43(12):1692-1707.
[9] Kumar R,Dwivedi V,Sridhar Reddy M.Metal-Free Iodosulfonylation of Internal Alkynes: Stereodefined Access to Tetrasubstituted Olefins[J].Advanced Synthesis & Catalysis,2017(359):2847-2856.
[10] ma yue,wang kun,zhang dony, et al. Solvent Controlled Transformation between Sulfonyl Hydrazides and Alkynes: Divergent Synthesis of Benzo[b]thiophene‐1,1‐dioxides and (E)‐β‐iodo Vinylsulfones[j/ol].[2018-11-11].https:www.doi,org/io.1002/adsc.201801258.
[11] yan ming,yu kawamata,philm s.baran.Synthetic Organic Electrochemical Methods Since 2000: On the Verge of a Renaissance[J].Chemical Reviews, 2017,117(21):13230-13319.
[12] nicolas Sauermann,tgark hannes Meyer,qiu youai,et al.Electrocatalytic C-H Activation[J].ACS Catalysis,2018,8(8):7086-7103.

