水稻藤仓镰孢菌对氰烯菌酯的抗药性分析
张智慧,金 倩,王夏雯,王飞飞,王信海
(江苏省农业科学院宿迁农科所,江苏宿迁 223800)
水稻恶苗病又被称为徒长病,是由藤仓镰孢菌(Fusarium fujikuroi)侵染水稻引起的一种真菌种传病害[1],1828年日本首次报道,几乎世界各水稻种植区均有发生。该病菌主要以带菌种子及带菌稻草越冬,在干燥条件下可存活2~3年。病谷长出的幼苗均为感病株,重者枯死,轻者菌丝体可扩展到整株,刺激茎叶徒长。田间病株产生分生孢子,经风雨传播,从伤口侵入引起再侵染。抽穗扬花期,分生孢子传播至花器上,侵入颖片和胚乳,造成秕谷或畸形,使种子带菌,同时病菌还会产生付马毒素等有毒代谢产物,影响种子质量,严重的还可能造成食品安全问题。该病害在水稻秧苗期到抽穗期均可发生,一般导致水稻减产5%~20%,严重时可减产50%以上[2]。近年来,随着稻草还田技术的推广,田间菌源增多,同时由于缺乏抗病水稻品种,导致水稻恶苗病连年重发,严重影响水稻产量及质量。
目前,通过化学药剂对种子进行处理是防治水稻恶苗病的主要方式[3-4]。自20 世纪70年代以来,苯并咪唑类杀菌剂多菌灵开始在我国广泛用于防治水稻恶苗病,具有较好防效。由于多菌灵作用位点单一,长期单一用药极易使病菌产生抗药性,已有报道表明,江苏省藤仓镰孢菌对多菌灵的抗药性频率高达92.3%[5]。20 世纪90年代中期,咪鲜胺用于替代多菌灵成为防治水稻恶苗病的主要药剂[6],同样长期用药易导致抗药性发展迅速。已有报道表明,江苏省藤仓镰孢菌对咪鲜胺的抗性频率达100%,江苏省藤仓镰孢菌对多菌灵及咪鲜胺具有双重抗性的菌株所占比例高达58.42%[7-9]。目前,国内登记用于防治水稻恶苗病的药剂制剂中,85%的制剂有效成分为多菌灵、咪鲜胺或者咯菌腈。为有效治理藤仓镰孢菌的抗药性,新型杀菌剂氰烯菌酯替代多菌灵被用于防治水稻恶苗病。氰烯菌酯是由江苏省农药研究所于1998年自主研发、具有自主知识产权的新型杀菌剂。该药剂属于2-氰基丙烯酸酯类杀菌剂,具有专化性强、杀菌活性高的特点,同时具有保护和治疗作用,可通过植物根部吸收,在叶片上有向上输导性。
已有研究表明,氰烯菌酯作用于藤仓镰孢菌肌球蛋白基因myosin5[10-11]。肌球蛋白(myosin)是一种马达蛋白(motor protein),最早发现于肌肉组织,可作用于肌动蛋白丝(F-actin),把储存于ATP的化学能转变为机械能。肌球蛋白也广泛存在于非肌细胞中,是细胞骨架的成分,参与细胞的吞噬、运动、受精和吸收等生理过程,充当非肌细胞生命活动不同层次的调节者,从简单的细胞间的信号传递到指导向化性迁移和细胞形状的改变等较高级的调节。在藤仓镰孢菌(F.fujikuroi)中,myosin5基因(FFUJ_01615)位于第一条核染色体上,开放阅读框(ORF)全长3 802 bp,编码1 267 aa,含有4个内含子。
本研究以江苏省宿迁地区水稻藤仓镰孢菌为菌株,检测对氰烯菌酯的抗药性,明确其抗药性基因型,为抗药性治理及科学用药提供参考。
1 材料和方法
1.1 供试菌株
供试藤仓镰孢菌(F.fujikuroi)是2018—2019年从江苏省宿迁市采集的水稻恶苗病株上分离纯化后得到的单孢菌株,共计86株,编号Sq1~Sq86。保存于江苏省农业科学院宿迁农科所分子实验室。
1.2 供试药剂与培养基
PDA 培养基:200 g 土豆去皮均匀切成块,煮沸10 min后过滤取汁。加入16 g 琼脂粉,加热至完全熔化。加入20 g 葡萄糖,用纯水定容至1 L。125℃下湿热灭菌25 min,常温保存。
绿豆汤培养基(MBB 培养基):30 g 绿豆煮到液体微红,用纯水定容至1 L,125℃下湿热灭菌25 min,常温保存。
95%氰烯菌酯原药(phenamacril,由国家南方农药创制中心江苏基地提供)用甲醇配制成1×104μg/mL母液。
1.3 接种方法
将供试菌株分别接种到PDA 培养基,放入25℃恒温培养箱培养,待其生长5 d 左右进行转接。
1.4 供试菌株对多菌灵及氰烯菌酯最小抑制浓度(MIC)测定
分别测定86株藤仓镰孢菌对氰烯菌酯的最小抑制浓度(MIC)。用直径5 mm的打孔器在新鲜的供试菌株菌落边缘打制菌饼。将供试药剂母液与PDA培养基均匀混合,倾入直径为90 mm 培养皿,将菌饼菌丝面朝上,均匀放置于含药的PDA 平板上,每皿接种7个菌饼。25℃避光培养,5 d后测量菌落增长直径。
1.5 氰烯菌酯对藤仓镰孢菌生长的影响
采用菌丝生长速率测定法[12],将供试菌株在PDA平板上于25℃预培养5 d后,用直径为5 mm的打孔器在菌落边缘打制菌饼。将氰烯菌酯母液与PDA培养基均匀混合,氰烯菌酯浓度为0、0.05、0.10、0.15、0.20、0.25、0.50、1.00、2.00 μg/mL,制成直径为90 mm 平板,将菌饼菌丝面朝上放置于含系列浓度氰烯菌酯的平板中央,每皿接种一个菌饼,每处理3次重复。25℃黑暗培养,以无药培养基为对照,5 d后,用十字交叉法测量菌落增长直径。由菌落直径平均值(mm)计算生长抑制率。
菌丝生长抑制率/%=[1-(药剂处理的菌落直径-5)(/对照菌落直径-5)]×100
将菌丝生长抑制率转换成概率值,药剂浓度转换成浓度对数,运用DPS软件处理数据,计算出药剂对各病原菌的毒力回归方程Y=a+bX,有效抑制中浓度(EC50),相关系数(r)。
1.6 藤仓镰孢菌生物学特性
菌丝生长速率测定:在无菌条件下,将活化后的供试菌株分别沿菌落边缘外周1/3 处打成直径为5 mm的菌饼,将菌饼置于PDA 平板中心位置,每皿接种一个菌饼,每处理重复3次。25℃避光培养5 d后,十字交叉法测量菌落直径。
产孢能力测定:在无菌条件下,将活化后的供试菌株分别沿菌落边缘,用直径为5 mm的打孔器打制菌饼,放入装有100 mL MBB 培养瓶。每瓶接种5个菌饼,25℃150 r/min 培养5 d。用血球计数板在显微镜下计算孢子数量,每处理3次重复。
1.7 藤仓镰孢菌(F.fujikuroi)myosin5基因的克隆及序列分析
提取DNA:取适量待测菌株菌丝分别装入1.5 mL离心管,加入700 μL的CTAB 提取缓冲液,加入石英砂,用研磨棒充分研磨后,60℃水浴加热30 min。以12 000 r/min 离心10 min,取600 μL 上清液至1.5 mL 离心管中,加入等体积的氯仿,剧烈摇晃混匀30 s后,以12 000 r/min 离心10 min;取450 μL上清液,加入900 μL 无水乙醇,-20℃沉淀1 h,12 000 r/min 离心10 min;倒掉上清液,加入200 μL 70%乙醇,12 000 r/min 离心10 min;倒掉上清液,室温下干燥5~15 min,溶于30 μL ddH2O,4℃冷藏备用[13]。
以测序菌株F.fujikuroi IMI58289 核基因组的myosin5基因(FFUJ_01615)序列为参考序列,进行myosin5基因的克隆。myosin5基因扩增引物序列(5′→3′)f1:ATCTTCTGATGCCCGTAT;f2:CAGTCGT CTCCAGCCACA。采用25 μL的PCR 扩增体系(表1)。PCR 反应温度参数为:95℃预变性3 min;95℃变性15 s,56℃退火15 s,72℃延伸(每1 kb DNA 链长对应0.5 min),共30个循环;72℃延伸15 min。采用1.0%琼脂糖凝胶电泳对PCR 产物进行观察,回收产物送南京擎科生物科技有限公司测序。采用Bioedit 软件进行序列比对分析。

表1 藤仓镰孢菌(F.fujikuroi)myosin5基因扩增反应体系
2 结果与分析
2.1 供试菌株对氰烯菌酯最小抑制浓度(MIC)
为明确宿迁地区藤仓镰孢菌对氰烯菌酯的抗药性,分别测定了86株菌对氰烯菌酯的最小抑制浓度,结果表明,27株藤仓镰孢菌(32%)对氰烯菌酯MIC=1 g/mL,59株藤仓镰孢菌(68%)对氰烯菌酯MIC>5 g/mL(表2)。选取两株抗药性菌株(Sq6、Sq12)和两株敏感菌株(Sq15、Sq20)供进一步研究。
2.2 氰烯菌酯对藤仓镰孢菌的毒力
根据MIC 测定结果,选取供试菌株:Sq6、Sq12、Sq15 和Sq20,采用菌丝速率法,分别测定氰烯菌酯对其毒力。由表3可知,氰烯菌酯对Sq6 和Sq12的有效中浓度(EC50)分别为0.389 7 g/mL 和0.396 5 g/mL,显著高于Sq15 和Sq20(0.169 7 g/mL,0.190 6 g/mL)。结合MIC 及EC50,表明菌株Sq6(MIC>5 g/mL,EC50=0.389 7 g/mL) 和Sq12(MIC>5 g/mL,EC50=0.396 5 g/mL)对氰烯菌酯具有抗药性。

表2 供试藤仓镰孢菌对氰烯菌酯的最小抑制浓度
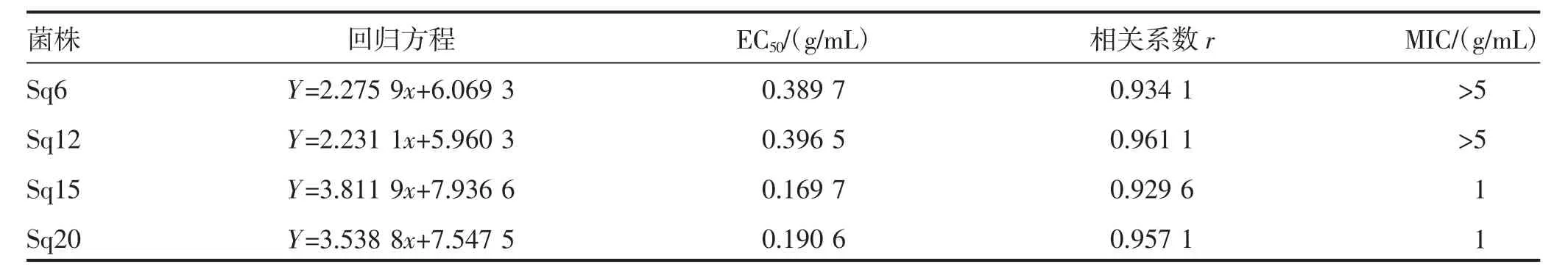
表3 不同浓度氰烯菌酯对供试藤仓镰孢菌的毒力
2.3 氰烯菌酯抗性菌株菌丝生长速率及产孢量测定
2.3.1 菌落生长速率 分别检测氰烯菌酯抗性菌株(Sq6、Sq12)及敏感菌株(Sq15、Sq20)的菌落生长速率,结果表明,菌株Sq12 气生菌丝贴近平板生长,菌落呈紫芋色。4株供试菌株间菌丝生长速率无显著差异(表4、图1)。

表4 藤仓镰孢菌(F.fujikuroi)生长速率差异
2.3.2 产孢能力测定 采用MBB 培养基摇床培养方法对氰烯菌酯抗性菌株(Sq6、Sq12)及敏感菌株(Sq15、Sq20)分生孢子产生能力进行测定。结果表明,菌株Sq12 和Sq20 产分生孢子能力分别为(37.36±2.11)×104个/mL,(39.50±1.86)×104个/mL,显著高于Sq6[(31.26±0.86)×104个/mL]和Sq15[(30.06±0.91)×104个/mL](表5)。

表5 供试藤仓镰孢菌(F.fujikuroi)产分生孢子能力差异
2.4 藤仓镰孢菌(F.fujikuroi)myosin5基因序列分析
为明确供试菌株抗性基因型,分别对供试氰烯菌酯抗性菌株(Sq6、Sq12)及敏感菌株(Sq15、Sq20)的myosin5基因进行测序,以测序菌株F.fujikuroi IMI58289为对照,比对分析表明,供试菌株Sq6 和Sq12 myosin5 第326位密码子发生点突变,从AGG(精氨酸)→AGT(丝氨酸);菌株Sq15 和Sq20 与对照相同,第326位密码子未发生点突变(表6)。
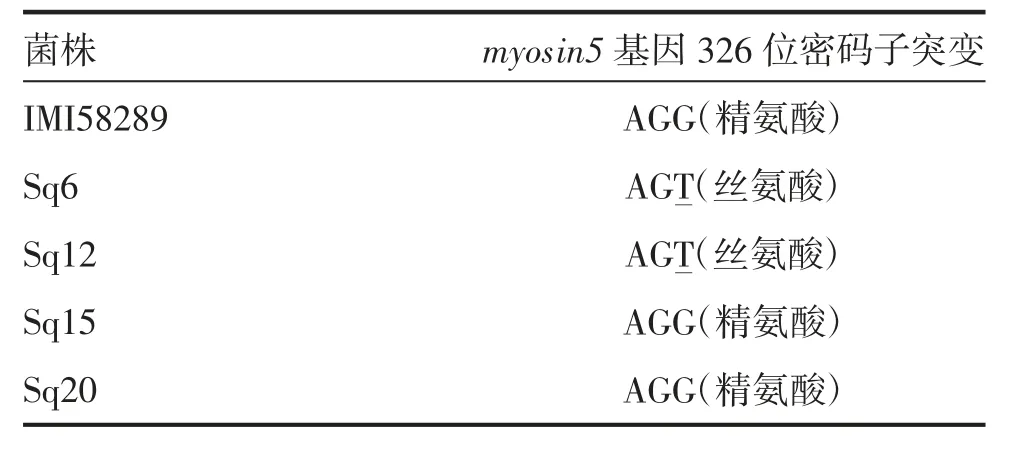
表6 供试藤仓镰孢菌(F.fujikuroi)myosin5基因的密码子比对分析
3 讨论与结论
藤仓镰孢菌(F.fujikuroi)是一种种传病害,但是其新形成的分生孢子能够在同一个生长期引起更加严重的再侵染循环,因此,对于该病防控种子处理是关键措施。通过对86株野生供试菌株进行最小抑制浓度的测定,结果表明,宿迁地区32%藤仓镰孢菌对氰烯菌酯MIC=1 g/mL,68%藤仓镰孢菌对氰烯菌酯MIC>5 g/mL。从其中选取4株菌(Sq6、Sq12、Sq15、Sq20),测定氰烯菌酯对其有效中浓度(EC50),从而明确菌株Sq6、Sq12为氰烯菌酯抗性菌株,菌株Sq15、Sq20为氰烯菌酯敏感菌株。比较4株菌菌丝生长速率及产孢量,结果表明,氰烯菌酯抗性菌株与敏感菌株间菌丝生长速率不存在显著差异,菌株Sq12 与Sq20 产孢量显著高于Sq6 和Sq15。通过对myosin5基因序列比对分析,进一步明确氰烯菌酯抗性菌株(Sq6、Sq12)在326位密码子由精氨酸突变为丝氨酸(R326S)。
许多含有杂环的氰基丙烯酸酯类药物对杂草[14]、昆虫、病原真菌[15]、病毒[16]和癌症[17]等具有优异的抑制活性。在病原真菌中,禾谷镰孢菌(F.graminearum)对氰烯菌酯抗药性研究较为透彻。在禾谷镰刀菌(F.graminearum)中,共有3个基因编码肌球蛋白,分别为:myosin5(FGSG_01410),myo2(FGSG_08719),myosin2B(FGSG_07469)。其中myosin5(FGSG_01410)点突变会使禾谷镰刀菌对氰烯菌酯产生抗药性:共涉及5个密码子,分别为第216位、第217位、第418位、第420位和第786位密码子[11]。
本研究中藤仓镰孢菌(F.fujikuroi)对氰烯菌酯抗药性表现基因型为:myosin5基因的第326位密码子发生点突变,从AGG(精氨酸)→AGT(丝氨酸),发生在myosin5的马达结构域。已有研究报道,浙江省藤仓镰孢菌对氰烯菌酯的抗药性基因型为myosin5基因的第219位密码子发生点突变,从TCA(丝氨酸)→CCA(脯氨酸)[10]。相比于宿迁地区采取稻麦轮作的耕作方式,浙江省采取一年两熟的水稻生产方式,用药频次及累积用药量高于宿迁地区。结合本研究结果,表明在不同的选择压(用药频次和用药量)下,可导致不同的抗药性突变基因型。因此,使用氰烯菌酯进行种子处理,需建立一个科学用药方法,减少或者延缓田间抗药性的产生。为延长氰烯菌酯使用寿命,是否可通过将其与不同作用机制的杀菌剂进行复配防治水稻恶苗病,有待进一步研究。

