结缔组织病相关肺动脉高压的遗传学
师悦,李慕聪,赵久良,王迁,赵秀丽,李梦涛
结缔组织病(connective tissue disease, CTD) 相关肺动脉高压 (pulmonary arterial hypertension, PAH)是一类由基因和环境共同作用导致的疾病,确切发病机制目前尚不明确。因其临床表现隐匿、早期诊断困难以及治疗措施和疗效有限,成为CTD患者死亡的重要因素之一[1]。CTD包括系统性红斑狼疮(systemic lupus erythematosus, SLE)、系统性硬化症(systemic sclerosis, SSc)、原发性干燥综合征(primary Sjögren’s syndrome, pSS)、类风湿性关节炎(rheumatoid arthritis, RA)和未分化结缔组织病(undifferentiated CTD, UCTD)等多种自身免疫性疾病[2]。CTD是一类多基因遗传性疾病,随着基因检测技术的不断进步,研究发现了越来越多的强关联基因位点[3]。PAH是CTD的严重并发症,主要特征为肺血管病变所致肺动脉阻力的进行性升高,最终发展为右心衰竭[4]。世界卫生组织(WHO)根据病因将肺循环高压患者分为5型,PAH属于第Ⅰ型,包括特发性PAH(idiopathic PAH, IPAH)、遗传性PAH(heritable PAH, HPAH)和CTD-PAH等[5]。针对PAH的遗传学研究主要围绕IPAH和HPAH展开:其中IPAH患者可能存在对肺血管疾病的基础遗传易感性,而HPAH患者的病因主要是由于遗传性基因突变。目前针对CTD-PAH的遗传学研究主要集中在SSc-PAH、SLE-PAH和pSS-PAH,现有针对CTD-PAH的全基因组关联分析(genome-wide association analysis, GWAS)研究显示该类疾病具有一定的基因易感性,TGF-β受体信号通路及炎症信号通路一些相关基因突变均可能增加CTD患者并发PAH的风险。本文对SSc-PAH、SLE-PAH、pSS-PAH的遗传学研究进展作一综述;通过参考IPAH、HPAH的大量遗传学研究结论,对比总结CTD-PAH的易感基因及可能的作用机理,从而有望发现CTD-PAH的风险基因与早期检测生物标志物,以期改善CTD-PAH的诊治现状。
1 PAH遗传学研究进展
骨形态发生蛋白2型受体(BMPR2)属于转化生长因子β(TGF-β)家族的信号分子,是PAH最常见的遗传性突变基因,可分别解释53%~86%的HPAH发病和14%~35%的IPAH发病[6]。BMPR2突变以常染色体显性方式遗传,通过影响骨形态发生蛋白(BMP)信号通路和TGF-β信号通路的正常表达参与肺动脉血管重塑[7],外显率不完全且表现度因人而异[8]。TGF-β家族一些其他基因的突变也被证实与PAH发病相关。通过对于遗传性出血性毛细血管扩张症与PAH并发的家系研究,Harrison等[9]发现TGF-β家族的激活素样激酶基因(ALK1)和内皮素糖蛋白基因(ENG)中存在PAH的致病突变;后续研究在大规模PAH患者中进一步确认了ALK1在PAH早期发病中的作用[10]。基于欧亚人群的队列研究以及功能学实验证实,SMAD1、SMAD4、SMAD5、SMAD9突变通过改变BMP信号通路水平导致PAH发生[11]。此外,一些参与BMP通路调控的基因,如:陷窝蛋白1(CAV1)、钾通道亚家族K成员3(KCNK3)等,其突变也与PAH发病相关[12-14]。
基于欧洲人群的大规模队列[15]以及GWAS[16-17]等多个研究,也分别发现在TBX4、ATP13A3、AQP1、SOX17、GDF2、与整合应激通路相关的EIF2AK4等基因中存在罕见突变,可以导致PAH发病。后续的功能学研究也证实了这些突变基因在PAH发病过程中的可能作用机制[17-19]。
2 CTD-PAH遗传学研究进展
针对CTD-PAH的GWAS研究显示,CTD-PAH患者中存在的突变基因与固有免疫、适应性免疫、炎症通路、血管重构等多个生理过程有关。基因突变和免疫紊乱的共同作用造成肺血管内皮细胞、平滑肌细胞和免疫细胞的功能障碍,最终造成肺血管的重构以及PAH的发生发展。目前尚未发现针对CTD-PAH整体疾病谱有区别于IPAH、HPAH相对共性的突变,相关遗传学研究主要涉及SSc-PAH、SLE-PAH和pSS-PAH 3个方向,已报道的CTD-PAH突变基因及位点见表1。
2.1 SSc-PAH
在美国[20]和欧洲[21]开展的CTD-PAH队列研究中,在SSc患者中经右心导管试验确诊合并PAH的比例约为10%~12%,在所有类型的CTD中为最多,所以目前针对CTD-PAH的遗传学机制探讨大部分围绕SSc-PAH。
作为在IPAH和HPAH患者中最常见的BMPR2基因突变,有研究显示在SSc-PAH患者的肺组织和小鼠模型中观察到了BMPR2蛋白含量的降低和TGF-β受体活性的改变[22],但是在两个样本量较小的人群验证研究中BMPR2基因与SSc-PAH的相关性不显著[23-24]。除BMPR2以外,在部分HPAH患者中也发现了TGF-β受体信号通路相关的ALK1[25]和ENG[26]的突变。其中ENG基因参与编码的内皮素是一种主要存在于人血管内皮细胞的同二聚膜糖蛋白,是TGF-β受体复合物的一部分。在29名SSc-PAH患者和140名SSc不合并PAH患者中,ENG基因第七个内含子的插入突变(6bINS)频率存在显著差异[27],而ENG基因多态性在SSc患者中的功能意义以及在更大规模人群中的检测意义尚待确定。然而Koumakis等[28]的人群验证研究并没有在BMPR2、ALK1、TGFBR2和ENG 4个TGF-β受体信号通路相关的候选基因中发现有统计学意义的单核苷酸多态性位点。在与PAH基因调控相关的BMP信号通路中,SMAD基因家族被证明存在显著的致病意义[11],但是在SSc-PAH患者中这些结果还有待验证。
另外Manetti等[29]的研究发现,趋化因子基质细胞衍生因子1(SDF-1/CXCL12)的等位基因突变与SSc患者发生PAH等微血管病变显著相关,这可能是由于SDF-1/CXCL12及其受体CXCR4在血管生成和胚胎的心脑血管发育过程中有重要的调节作用[30]。Takagi等[31]则将兴趣点放在了缺氧诱导因子(HIF)1α相关基因位点上:HIF1α在缺氧状态下由内皮细胞产生,可能参与到SSc患者的肺血管损伤过程当中[32],HIF1α基因rs12434438位点的AA基因型可能会增加SSc患者的PAH发病风险。
除上述举例外,过往的回顾性队列研究还发现了一些与SSc-PAH发病机制和不良结局相关的基因位点(表1),但其致病机理尚未确定。对于SSc-PAH遗传相关性的研究和相关联区域的精确定位仍需更多高质量和大规模的患者队列研究来提高统计分析效力。
2.2 SLE-PAH
在东亚人群中,SLE-PAH是CTD-PAH的主要类型:在中国人群中,占比最高的CTD-PAH为SLE-PAH(58.4%),其次为SSc-PAH(26.3%)和pSS-PAH(15.3%)[33];在韩国人群中,SLE-PAH、SSc-PAH、类风湿关节炎相关PAH、混合性结缔组织病相关PAH分别占35%、29%、13%和6%[34];在日本人群中,占比最高的CTD-PAH为混合性结缔组织病相关PAH(43%),SLE-PAH、SSc-PAH分别占29%和19%[35]。然而针对SLE-PAH和pSS-PAH的遗传相关性的研究较为匮乏。
大型GWAS研究中已经报道了TNIP1、PRDM1、JAZF1、UHRF1BP1和IL-10等基因变异位点与SLE的易感性相关[36]。CBLN2基因位于染色体18q22.3,其转录产物mRNA在PAH患者的肺组织中表达显著高于正常人的肺组织,其编码产物小脑肽2由肺内皮细胞产生,作用于肺血管的平滑肌细胞,并且在GWAS中发现该基因与PAH相关[37]。Huang等[38]2018年在一项基于中国人群的回顾性队列研究中,针对CBLN2、BMPR2、ALK1、ENG、SMAD9等已知IPAH和HPAH致病基因的一些突变位点,对87例SLE-PAH患者与166例SLE不合并PAH患者进行单核苷酸多态性(single nucleotide polymorphism, SNP)测序发现,仅有CBLN2(rs2217560)的单核苷酸多态性与PAH的发病显著相关。然而,Pousada等[39]在3例西班牙SLE-PAH患者中检测到了BMPR2、ALK1、ENG等的一些突变位点,可能为PAH潜在致病因素(表1)。2项研究结论不同,可能是由于Pousada等[39]的研究SLE-PAH样本数量过少,或是由于2项研究人群存在一定的种族和地域差异。
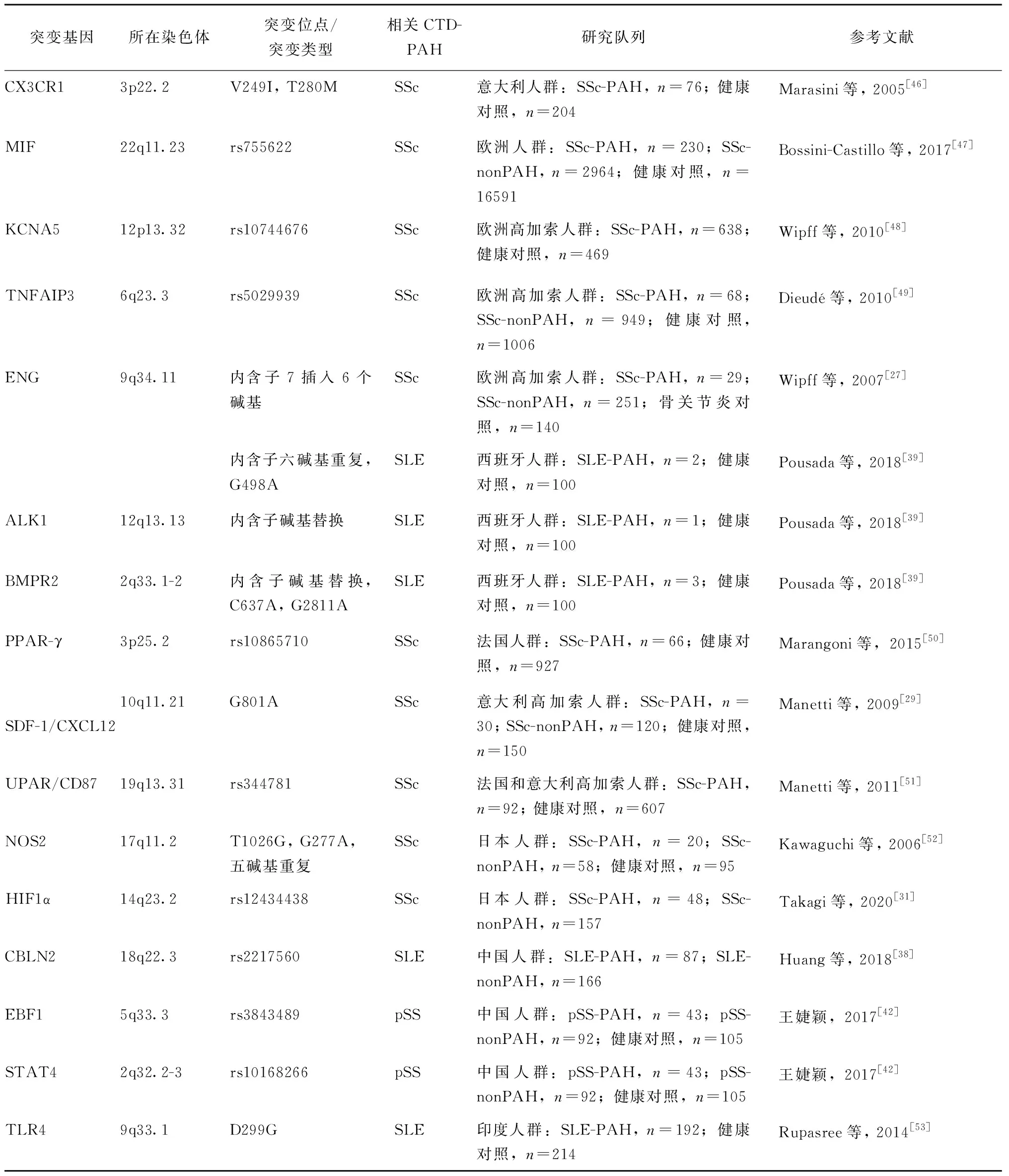
表1 研究中报道的CTD-PAH突变基因及位点Table 1 CTD-PAH associated mutant gene loci in previous studies
2.3 pSS-PAH
在中国汉族人群针对pSS的GWAS研究中发现,除了在欧洲人群中证实的STAT4、TNFAIP3 和主要组织相容性复合体(MHC)基因以外,GTF21和RBMS3也被发现和中国人群对pSS的易感性相关[40-41]。针对pSS-PAH的遗传学研究目前国际上尚无报道。国内王婕颖等[42]研究发现,和pSS不合并PAH的患者相比,在pSS-PAH中EBF1(rs3843489)和STAT4(rs10168266)基因型频率均存在显著差异。EBF1基因主要参与早期B细胞的发展,包括染色质谱系的特异性变化、基因VDJ的重排、抗原驱动后的B细胞活化和终末分化等过程[43]。STAT4基因主要在T细胞和自然杀伤(NK)细胞中表达,在多种CTD和自身免疫性心包包炎中被发现与细胞因子IL-12介导的干扰素通路异常活化相关[44-45]。
综上,CTD-PAH患者早期诊断困难、预后极差,为CTD患者重要的死亡原因之一。尽管现有研究发现TGF-β家族的ENG可能与多种CTD-PAH的发病过程相关,但不同CTD-PAH患者的突变基因谱差异较大。目前针对CTD-PAH的遗传学研究主要集中在欧美人群发病率较高的SSc-PAH,并且由于人种差异导致的SNP位点频率差别较大,因此中国人群的相关研究亟待开展。CTD-PAH的遗传学背景与IPAH和HPAH差别较大,除TGF-β(如:BMPR2、ALK1、ENG)和BMP等PAH相关信号通路外,NF-κB和干扰素(如:TNFAIP3、TLR4)等炎症信号通路相关基因也应受到重视。后续研究应着眼于建立不同种族人群CTD-PAH致病基因突变谱,通过基因筛查帮助患者早诊早治,以期在临床上提高患者的预后。

