基于内源乳化法和喷雾干燥优化制备 花色苷微胶囊及其稳定性分析
毛 莹,帅晓艳,王惠玲,周 兰,李 佳,李 漫,杨 宁,何静仁,2,
(1.武汉轻工大学食品科学与工程学院,湖北 武汉 430023;2.湖北省农产品加工与转化重点实验室,湖北 武汉 430023)
花色苷是一类水溶性天然着色剂,具有一定的抗氧化、抗炎症等多种生物活性[1],在食品等领域有巨大的应用潜力[2],但易受温度、光照等因影响导致其稳定性较差,因采用胶囊化技术提高花色苷的稳定性,扩展适用范围[3]。目前花色苷的微胶囊化常用方法有喷雾干燥法、脂质体法和凝聚法等,其中喷雾干燥在食品工业中是最常用的封装技术。喷雾干燥过程中,溶剂快速蒸发,活性成分瞬间被保留[4]从而形成非晶态的固体分散体[5],法工艺简单、成本较低,适用于对温度敏感的活性物质[6]。喷雾干燥法已被证实能有效保护多酚化合物[7],但其高温条件在一定程度上可能会降解热敏性的花色苷。
内源乳化法是近年来兴起的新型海藻酸盐微胶囊制备方法,是将海藻酸钠溶液、水不溶性钙盐及包埋物共混后分散到油相中形成W/O型乳化液,加入酸引发钙盐中Ca2的解离,促使Ca2在乳液液滴内部与海藻酸钠作用生成海藻酸钙凝胶珠。内源乳化法采用无毒试剂,因而可应用于生物、食品、医药等行业中包埋生物 活性物质[8-9]。
本实验以葡萄皮提取物中的花色苷为芯材,以海藻酸钠为壁材[10],采用内源乳化法制备湿态花色苷微胶囊,再考察喷雾干燥工艺对微胶囊化湿态花色苷的影响,比较分析花色苷微胶囊化前后对其光照、温度、肠消化稳定性的影响,旨在为提高花色苷类功能性食品的稳定性研究开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
YC-3000喷雾干燥机 上海雅程仪器设备有限 公司;Evolution220紫外-可见分光光度计 美国Thermo Fisher公司;MS3000LVAeros激光粒度仪 上海思百吉仪器系统有限公司武汉分公司;CM-24圆形水浴氮吹仪 瑞士万通中国有限公司;S-3000N扫描式电子显微镜(scanning electron microscope,SEM) 日本 日立公司;XD30倒置显微镜 宁波舜宇仪器有限公司; UV-4802紫外全扫描分光光度计 武汉利天科技仪器有限公司。
1.3 方法
1.3.1 葡萄皮花色苷的制备及含量测定[11-12]
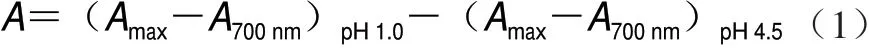

式中:A为pH 1.0、4.5时花色苷在λmax波长处的吸光度差值;V为提取液总体积;n为稀释倍数;M为cy-3-glu的摩尔质量(449.4 g/mol);ε为cy-3-glu的消光系数(26 900 L/(molg cm));m为花色苷纯化物质量。
根据pH 示差法测得的葡萄皮花色苷含量为 102.99 g/mg。
1.3.2 花色苷微胶囊的制备
根据内源乳化法的原理,以海藻酸钠为壁材[13-15]:海藻酸钠、碳酸钙溶于20 mL水中,溶胀1~2 h后与10 mL花色苷溶液充分混匀待用;Span80与大豆油按一定比例混匀后加入制备好的水相,磁力搅拌进行乳化得到W/O乳浊液,再加20 mL含有乙酸的大豆油(降低体系pH值),最后加入200 mL含有NaCl的磷酸盐缓冲液(0.1 mol/L,pH 7.0),静置1~2 h,采用分液漏斗分离油水相得到湿态花色苷微胶囊,在一定条件下喷雾 干燥[16-17]制备花色苷微胶囊。
通过Plackett-Burman试验设计、最陡爬坡试验及Box-Behnken设计试验得出内源乳化法制备花色苷微胶囊的最佳工艺条件为:海藻酸钠与CaCO3质量比为3∶1,壁材与芯材质量比为15∶1,酸钙质量比为3∶1,NaCl质量浓度为900 mg/mL。经验证,该条件下的微胶囊包埋率为75.12%,平均粒径为120 μm。
式中:A1为包埋前花色苷的吸光度;A2为包埋后花色苷的吸光度。
1.3.4 微胶囊形态观察及粒径的测定
马尔文激光粒度仪测定花色苷微胶囊的平均粒径和粒径分布:取少量干燥的花色苷微胶囊用纯水溶解,按一定比例稀释,用激光粒度仪测定花色苷微胶囊的平均粒径和粒径分布。
称取一定质量的花色苷微胶囊溶于无水乙醇,采用超声波振荡破碎释放花色苷,微孔滤膜过滤后在300~800 nm波长范围内进行紫外全扫描,对照组仅将花色苷微胶囊溶解在无水乙醇中后进行紫外全扫描。
1.3.6 花色苷微胶囊的光照稳定性
实验组:微胶囊预先采用1% DMSO充分溶解,再以pH 2.0柠檬酸-磷酸氢钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
将两组溶液密封静置于50 W日光灯下考察0、1、2、3、4、5 h花色苷的光照稳定性。采用紫外分光光度计测定吸光度,由下式计品花色苷保存率:
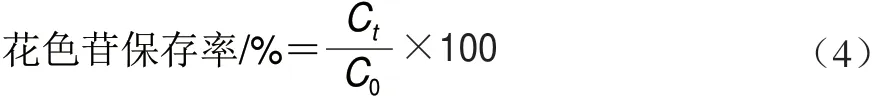
1.3.3 包埋率的测定

对花色苷微胶囊和花色苷光降解动力学分析,符合一级反应动力学方程:

式中:C0为花色苷溶液初始吸光度;Ct为受光照t小时后的溶液吸光度;t1/2为花色苷受光降解半衰期;k为降解反应速率常数/h1。
1.3.7 花色苷微胶囊的热稳定性
实验组:微胶囊预先采用1% DMSO充分溶解,再以pH 2.0柠檬酸-磷酸氢钠缓冲液为溶剂配制0.05 mg/mL的花色苷溶液。
将两组溶液密封置于试管架,于50、60、70、80、90 ℃条件下避光水浴,每半小时取测定其在2.5 h内吸光度变化。按式(4)计花色苷保存率;对花色苷微胶囊和花色苷光降解动力学分析,符合一级反应动力学方 程(5),并按方程(6)计花色苷温度降解半衰期。
1.3.8.2 人工模拟肠消化
取0.3 1 3 g 胰蛋白酶和1.8 8 g 猪胆盐混合溶于50 mL 0.1 mol/L NaHCO3缓冲液,配制成模拟肠溶液。将经过2 h消化品于4 ℃放置2 h,于3 000 r/min离心15 min去除蛋白酶,取上清液加入2 mL胰蛋白酶和猪胆盐混合溶液,用0.1 mol/L NaHCO3缓冲溶液调至pH 6.8,置于37 ℃水浴振荡,转速为100 r/min,测定0、0.5、1、1.5、2 h模拟肠液中品吸光度的变化。在反应期间,密封避光保存防止花色苷降解。
1.4 数据处理
利用数据处理软件SPSS 19和Origin 85进行数据统计及图表绘制。
2 结果与分析
2.1 喷雾干燥单因试验结果
2.1.1 加热器温度对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在进料速率12 r/min、真空压力0.03 MPa的条件下,加热器温度对花色苷微胶囊平均粒径及包埋率的影响结果见图1。
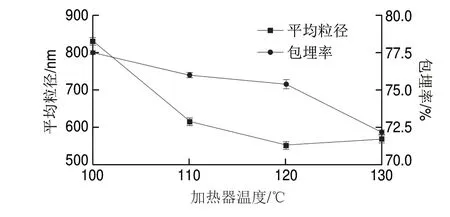
图 1 加热器温度对花色苷微胶囊平均粒径及包埋率的影响Fig. 1 Effect of heater temperatures on average particle size and microencapsulation rate
由图1可知,花色苷微胶囊平均粒径随温度的升高而先减后增,包埋率呈下降趋势,包埋率随温度变化波动较小则主要考虑粒径变化。加热器温度为120 ℃时微胶囊平均粒径达到最小值552.3 nm,包埋率为75.4%,时进出料口温度分别为70.2、64.8 ℃,后平均粒径随加热器温度的上升而增大,可能是加热器温度过低时进出料口温度过低,微胶囊化时间长,溶剂蒸发速度慢,流动性差,且易回潮,导致微胶囊颗粒聚集大小不均一,粒径分布较为广泛,加热器温度过高时溶剂蒸发速度太快,囊壁破碎从而影响花色苷微胶囊的稳定性及生物活性[19]。因确定喷雾干燥法制备花色苷微胶囊的最佳加热器温度为120 ℃。
2.1.2 进料速率对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在真空压力0.03 MPa、加热器温度120 ℃的条件下,进料速率对花色苷微胶囊平均粒径及包埋率的影响结果见图2。
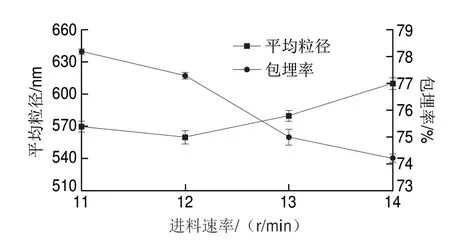
图 2 进料速率对花色苷微胶囊平均粒径及包埋率的影响Fig. 2 Effects of feeding rate on average particle size and microencapsulation rate
由图2可知,花色苷微胶囊的平均粒径随进料速率的增加而先减后增,包埋率呈下降趋势,综合粒径和包埋率的变化趋势及波动性,选择主要参考平均粒径。进料速率达到12 r/min时,平均粒径达到最小值571.5 nm,包埋率为77.3%,之后平均粒径随着进料速率的增加而增大,可能是在喷雾干燥过程中,进料速率过快,品流量过大,较多品进入雾化器降低品与热空气的传热传质效率[20],品未能充分干燥导致微胶囊颗粒发生聚集,从而影响花色苷微胶囊的粒径大小。因确定喷雾干燥法制备花色苷微胶囊的最佳进料速率为12 r/min。
2.1.3 真空压力对花色苷微胶囊粒径及包埋率的影响
低温喷雾干燥参数设置中,在加热器温度120 ℃、进料速率12 r/min的条件下,真空压力对花色苷微胶囊平均粒径及包埋率的影响见图3。
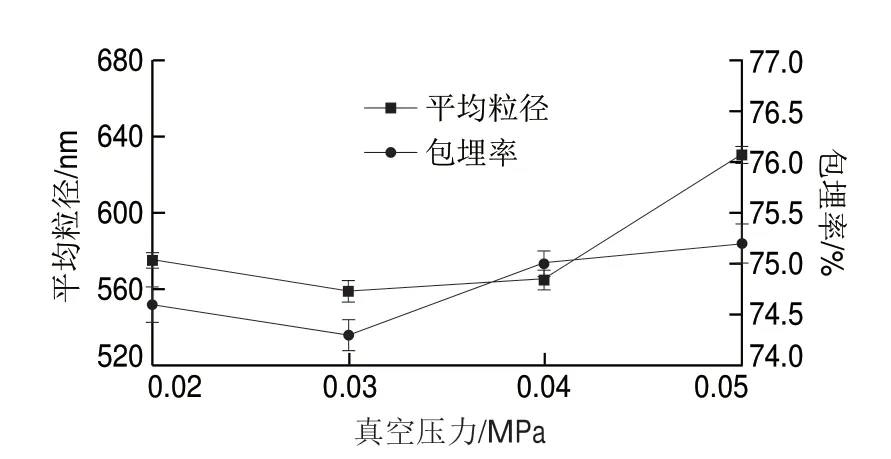
图 3 真空压力对花色苷微胶囊平均粒径及包埋率的影响Fig. 3 Effects of vacuum pressure on average particle size and microencapsulation rate
由图3可知,花色苷微胶囊的平均粒径及包埋率均随真空压力的增加而先减后增,综合粒径和包埋率的变化趋势及波动性,选择主要参考平均粒径。在0.03 MPa时,其平均粒径仅为560.1 nm,包埋率为74.3%,之后平均粒径随真空压力的升高而变大,可能是较小真空压力影响溶剂蒸发速度及颗粒成型速度,进出料口间隔距离较短,品未能及时干燥成型;真空压力太大则超出囊壁承压范围致使囊壁破碎,芯材流出。因确定喷雾干燥法制备花色苷微胶囊的最佳真空压力为0.03 MPa。
2.2 喷雾干燥正交试验结果
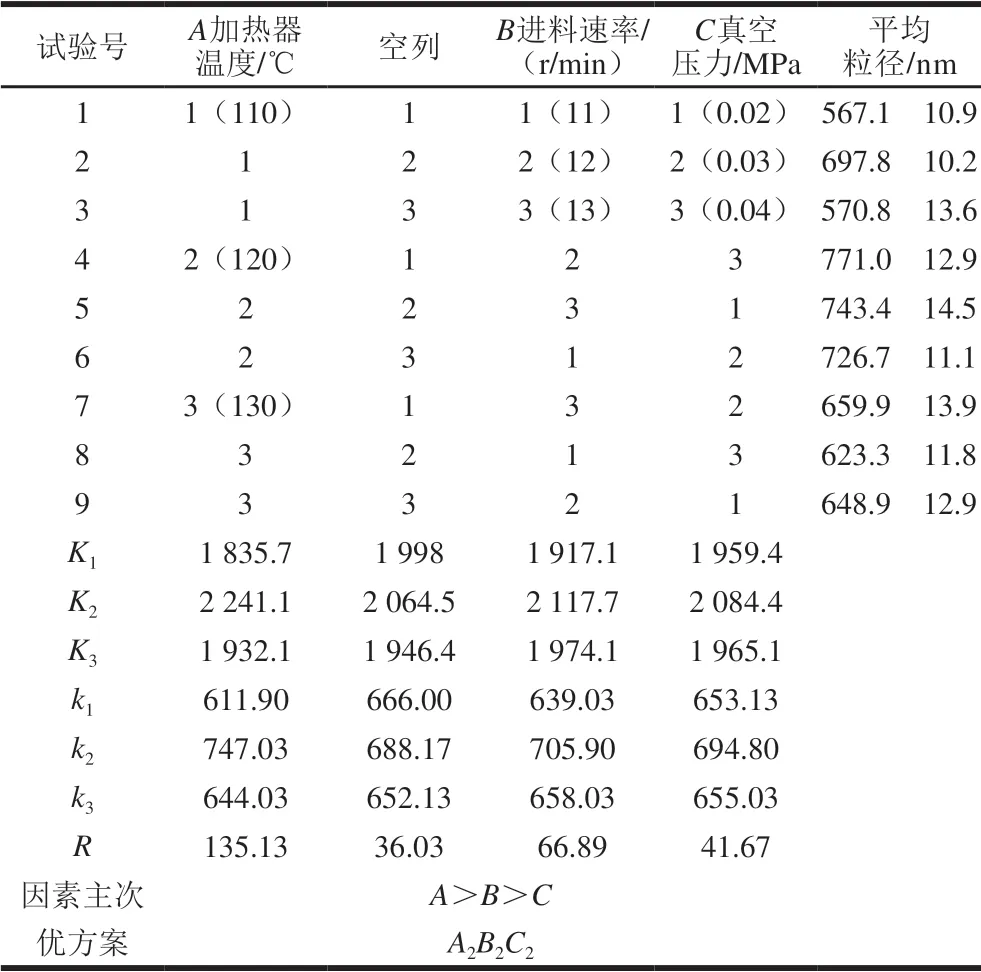
表 1 正交试验设计与结果Table 1 Orthogonal array design and results
2.3 花色苷微胶囊的形态及粒径大小
2.3.1 花色苷微胶囊的形态

图 4 花色苷微胶囊SEM图Fig. 4 SEM image of anthocyanin microcapsules
由图4可知,喷雾干燥的花色苷微胶囊分布均匀、颗粒完整,呈现圆形外部结构并且有不同尺寸的附聚物,具有喷雾干燥粉末的特征[21]。部分微胶囊会存在表面开裂、凹痕或形状不规则的情况,可能与品的水分含量、操作温度、进料速率有关[22-23]。
2.3.2 花色苷微胶囊的粒径
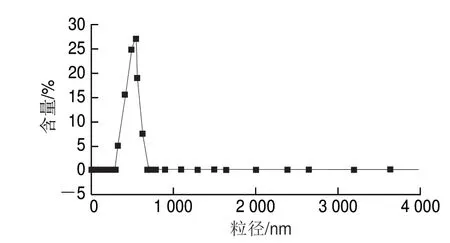
图 5 花色苷微胶囊的粒径分布Fig. 5 Particle size distribution of anthocyanin microcapsules
喷雾干燥的花色苷微胶囊呈粉末状,圆球度好,大小均一,粒径分布均匀,平均粒径可达到558.2 nm(图5)。综上可知,喷雾干燥法有利于制备胶囊化产品,制备所需时间较短能避免品受热时间过长,并且可有效降低微胶囊的粒径大小,使粒径分布更为集中[24]。
2.4 花色苷微胶囊的紫外-可见光特征
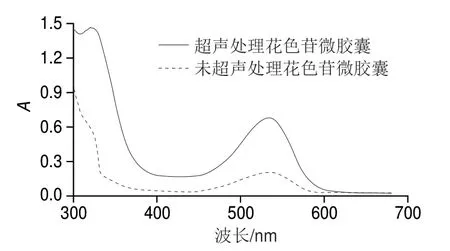
图 6 花色苷微胶囊的紫外-可见光谱特征Fig. 6 Ultraviolet-visible absorption spectrum of anthocyanin microcapsules
2.5 光照对花色苷微胶囊稳定性影响

图 7 光照对花色苷、花色苷微胶囊的稳定性影响Fig. 7 Effects of light on the stability of free anthocyanins and anthocyanin microcapsules
由图7可知,光照3 h和5 h,花色苷微胶囊的保存率分别为93.8%和82.1%,花色苷的保存率分别为80.0%和63.7%,可见花色苷微胶囊的光稳定性要明显高于花色苷,表明以海藻酸钠为壁材的内源乳化法制备微胶囊可有效保护花色苷芯材;避光保存5 h,花色苷和花色苷微胶囊的保存率分别为78.6%和91.4%,结果表明微胶囊化可提高花色苷的保存率[3,25]。分别比较花色苷和花色苷微胶囊在光照和避光条件下的保存率,发现光照能加速花色苷的降解,而微胶囊化可增强花色苷对光照的耐受力,提高其稳定性[26]。
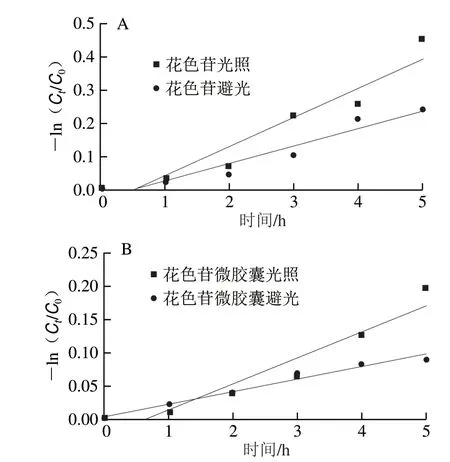
图 8 光照对花色苷(A)和花色苷微胶囊(B)的降解Fig. 8 Degradation rates of free anthocyanins (A) and anthocyanin microcapsules (B) in light
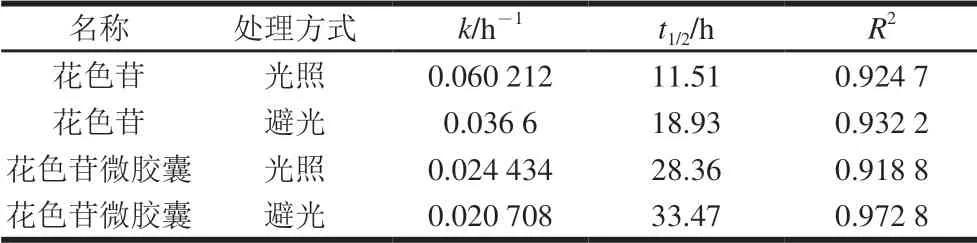
表 2 花色苷、花色苷微胶囊的光降解动力学参数Table 2 Photo-degradation kinetics parameters of free anthocyanins and anthocyanin microcapsules
由表2可知,相较于避光状态,在光照条件下花色苷和花色苷微胶囊的一级反应速率常数k均增大,且半衰期均减小,表明花色苷在光照条件下不稳定,避光状态更利于保存。在光照和避光条件下,花色苷微胶囊的半衰期比花色苷的半衰期长,说明微胶囊化的花色苷由于壁材的保护作用未直接暴露于光照而更加稳定, 进一步表明基于内源乳化法的微胶囊化包埋花色苷具有可行性。
2.6 温度对花色苷微胶囊稳定性影响
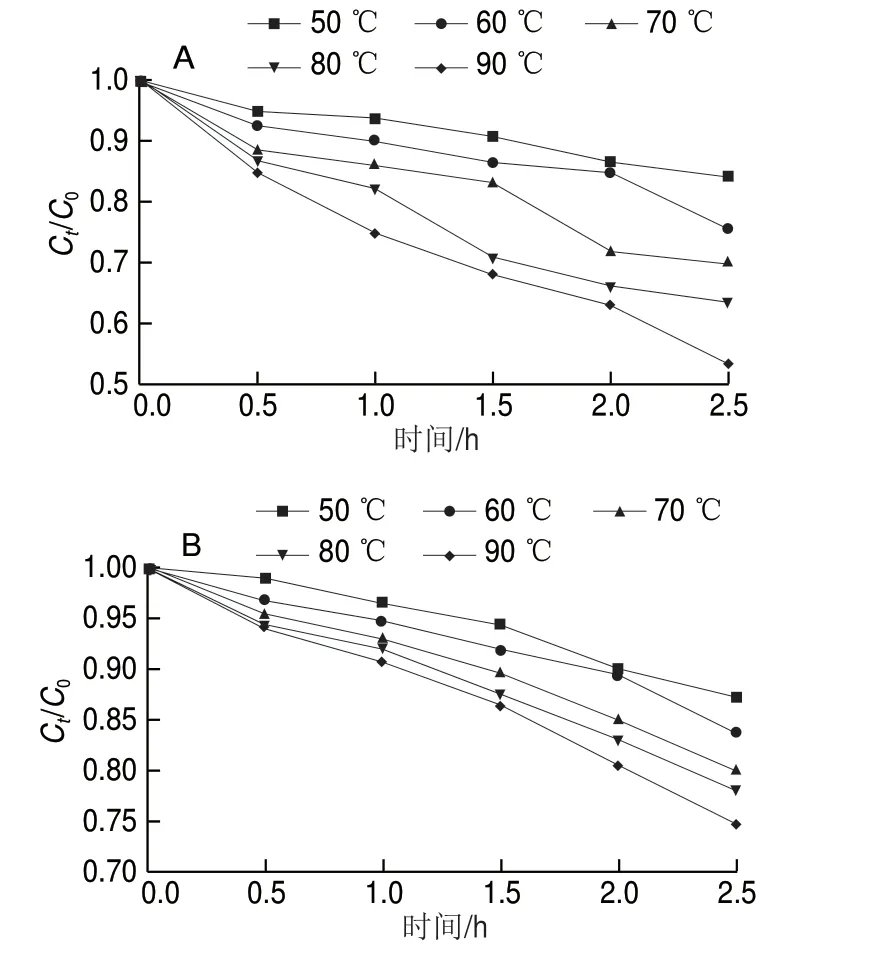
图 9 温度对花色苷(A)和花色苷微胶囊(B)稳定性的影响Fig. 9 Effect of temperature on the stability of free anthocyanins (A) and anthocyanin microcapsules (B)

图 10 花色苷(A)和花色苷微胶囊(B)的热降解Fig. 10 Thermal degradation of free anthocyanins (A) and anthocyanin microcapsules (B)
由图9可知,花色苷和花色苷微胶囊在高温下均发生了不同程度的热降解。由图9A可知,高温加热1 h,花色苷保存率急速降低;90 ℃加热2.5 h,其保存率仅为53.3%。由图9B可知,高温加热1.5 h花色苷微胶囊保存率逐渐降低;90 ℃加热2.5 h,其保存率为74.7%。由可知,随着加热时间和温度的增加,相较于微胶囊化花色苷,花色苷的热降解更加显著,即高温状态微胶囊化的花色苷的热稳定性更高[3],可能是微胶囊化的花色苷受海藻酸钠壁材的保护其结构未被直接破坏。现有研究表明,升高温度能加快降解花色苷[27-28],因在贮存花色苷及其微胶囊化品时应避免高温。
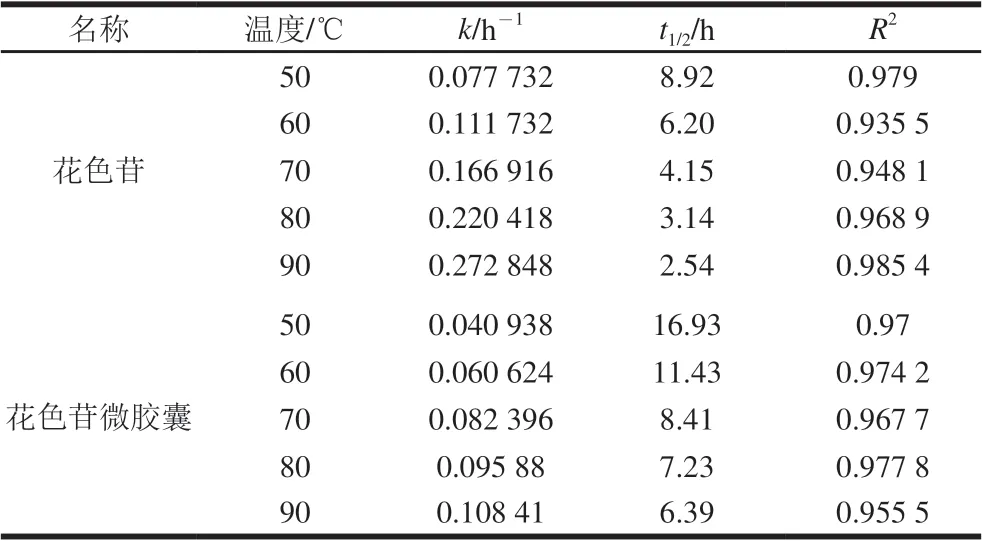
表 3 花色苷、花色苷微胶囊的热降解动力学参数Table 3 Thermal degradation kinetic parameters of free anthocyanins amd anthocyanin microcapsules
随温度的升高,花色苷和花色苷微胶囊的一级反应速率常数k均增大,而半衰期均减小,表明花色苷及花色苷微胶囊在高温状态下热稳定性下降且热降解速率快;在相同温度条件下,花色苷微胶囊的热降解速率常数k(0.040 938)比花色苷k(0.077 732)小,而半衰期(16.93 h)比花色苷的半衰期(8.92 h)大,说明微胶囊化的花色苷在高温状态下比花色苷更稳定,同时体现出基于内源乳化法的微胶囊化包埋花色苷的有效性。
2.7 花色苷微胶囊在模拟人肠消化环境中的稳定性

图 11 花色苷在人工模拟胃液中的保存率Fig. 11 Retention rates of free and microencapsulated anthocyanins in artificial gastric juice

表 4 经过人工模拟消化后花色苷、花色苷微胶囊的保存率Table 4 Retention rates of free anthocyanins and anthocyanin microcapsules after artificial digestion

图 12 花色苷在人工模拟肠液中的保存率Fig. 12 Retention rates of free and microencapsulated anthocyanins in artificial intestinal juice
3 结 论
本实验以海藻酸钠为壁材,采用内源乳化法制备湿态花色苷微胶囊,再考察喷雾干燥工艺对微胶囊化湿态花色苷的影响,通过单因、正交试验获得喷雾干燥花色苷微胶囊的最佳工艺参数为加热器温度120 ℃、进料速率12 r/min、真空压力0.03 MPa,花色苷微胶囊的平均粒径为558.2 nm,包埋率为75.12%。
研究结果表明,微胶囊化前后花色苷的光降解稳定性均符合一级反应动力学方程,在避光条件下较光照条件下的保存率更高;且花色苷微胶囊稳定性在光照和避光贮藏条件下均高于花色苷。微胶囊化前后花色苷的热降解稳定性也符合一级反应动力学方程,其保存率均随温度升高而降低,但花色苷微胶囊的温度稳定性高于花色苷。在人工模拟肠液中花色苷微胶囊的稳定性均高于花色苷。综上可知,内源乳化法结合喷雾干燥法制备花色苷微胶囊可有效提高花色苷的光照、温度、肠消化稳定性。

