超声辅助酶法提取薰衣草花色苷及其热降解动力学
(昌吉学院,化学与应用化学系,新疆昌吉 831100)
薰衣草(LavandulaangustifoliaMill.)为唇形科多年生的亚灌木植物,拥有浓烈的香气,故有“芳香之王”的美誉[1],主要分布于新疆、云南等地,其叶、茎、花全株呈浓香,香味浓郁而柔和、无刺激感、无毒副作用,被广泛地应用于医药[2]、化妆[3]、洗涤、食品行业[4]。薰衣草含有甾醇类、有机酸类、苷类等多种生物活性成分[5]。花色苷是一种具有糖苷键的生物类黄酮,广泛存在于色泽鲜艳的植物中,具有抗氧化[6]、抗菌消炎[7]、抗肿瘤[8]、保护心脑血管[9]以及缓解视疲劳[10]等功效,特别是其具有安全性高以及资源可再生等特点而成为研究的热点。传统的花色苷提取方法主要有溶剂萃取法[11]、超声辅助法[12]、微波辅助法[13]、超高压法[14]和生物酶法[15]等。目前有关薰衣草主要集中在化学成分[5]和精油提取[16]方面的研究,最近学者研究了薰衣草中黄酮的提取,但是采用超声辅助酶法提取薰衣草花色苷的研究鲜见报道[12]。
热处理是食品加工过程中最普遍和有效的杀菌方式,但高温处理可能会引起花色苷发生降解,甚至导致褐变。因此,利用化学动力学原理研究花色苷热降解动力学规律,对确定提高花色苷稳定性的措施和拓展其应用范围极为重要。近年来,国内外许多学者对花色苷热降解动力学进行了研究,腾飞等[17]研究了不同pH和温度下龙葵果花色苷的热降解规律,曹少谦等[18]研究了桑葚花色苷热降解动力学,李恩惠等[19]研究了在不同pH下蓝莓花色苷的花色苷热降解动力学,这些研究表明花色苷的热降解动力学模型符合一级反应动力学方程。然而,以上报道均使用花色苷粗提物进行降解研究。花色苷粗提物中含有糖、有机酸及黄酮类等杂质,这些杂质对花色苷降解机理有一定的影响,而纯花色苷的降解机制研究尚无报道。
基于此,本文以新疆伊犁薰衣草花色苷为研究对象,采用响应曲面法优化超声辅助酶法提取薰衣草中花色苷,通过Box-Behnken设计试验结合响应面分析法优化提取工艺条件,并对薰衣草花色苷进行分离纯化,探讨在不同pH和温度对纯薰衣草花色苷的热稳定性影响,进而建立其热降解动力学模型,以期为薰衣草花色苷的资源开发利用提供参考。
1 材料与方法
1.1 材料与仪器
薰衣草花穗 2018年6月购自新疆伊犁霍城县;果胶酶(30000 U/g) 天津市利华酶制剂技术有限公司;乙醇、盐酸、冰醋酸、醋酸钠、氯化钾 均为分析纯,阿拉丁化学试剂有限公司。
AL204型电子天平 梅特勒-托利多仪器(上海)有限公司;UV-2550型紫外-可见分光光度计 日本岛津公司;XO-2B型超声波提取器 南京先欧仪器制造有限公司;DK29821型电热恒温水浴锅 天津市泰斯特仪器有限公司;RE-1002旋转蒸发器 西安禾普生物科技有限公司;pH510酸度计 安莱立斯仪器科技(上海)有限公司;SHZ-2000循环水式真空泵 河南省巩义市英峪予华仪器厂;800B型离心机 上海安亭科学仪器厂制造;MiLLROCK冷冻干燥机 美国Commillrock公司。
1.2 实验方法
1.2.1 薰衣草花色苷的提取 准确称取干燥的薰衣草花穗2.000 g,依次加入10.0 mL pH为3的醋酸钠缓冲溶液、0.20%的果胶酶,充分混合,在40 ℃水浴中酶解反应60 min;然后加入无水乙醇使其反应体系浓度为80%,继续在同样温度条件下超声(800 W)提取30 min,于4000 r/min离心15 min,取上清液得到薰衣草花色苷提取物并进行含量测定。
1.2.2 花色苷的测定 花色苷含量采用pH示差法进行测定[12]。将一定量上清液转移至25 mL容量瓶内,用无水乙醇定容,再分别用pH1.0和pH4.5缓冲液稀释n倍,混匀后,放入40 ℃水浴中静置平衡30 min。对照组将乙醇用pH1.0和pH4.5缓冲液稀释n倍,混合均匀后放入40 ℃水浴中平衡30 min,平衡结束后,测其在最大吸收波长545和700 nm处的吸光度。按式(1)计算薰衣草花色苷的相对含量:
花色苷的质量浓度c(mg·mL-1)=[(A545-A700)pH1.0-(A545-A700)pH4.5]× n×M/εb
式(1)
式中:n为稀释倍数;M为矢车菊-3-葡萄糖苷的相对分子质量445.2 g/mol;ε为矢车菊-3-葡萄糖苷的摩尔吸光系数,29600;b为比色皿厚度cm。
花色苷得率为:
花色苷得率(%)=提取液中花色苷的质量/薰衣草质量×100
式中:薰衣草质量,g;提取液中花色苷的质量,g。
1.2.3 单因素实验 按照1.2.1中花色苷提取方法,分别考察加酶量(0.05%、0.1%、0.15%、0.2%、0.25%)、乙醇浓度(50%、60%、70%、80%、90%)、酶解时间(30、60、90、120、150 min)、酶解温度(30、40、50、60、70 ℃)、超声提取时间(10、15、20、25、30 min)和酶解pH(2.0、3.0、4.0、5.0、6.0)等6个因素对薰衣草花色苷得率的影响。单因素变化时,确定乙醇浓度80%、酶解时间60 min、酶解温度40 ℃、超声提取时间30 min和酶解pH 3等因素不变。每个单因素实验平行重复3次,结果取平均值。
1.2.4 响应面试验设计 以单因素实验为基础,选取对花色苷提取影响较大的超声时间、乙醇浓度、酶解温度和酶解时间四个因素为变量,花色苷得率为响应值,采用Box-Benhnken设计响应面试验,各因素水平见表1。
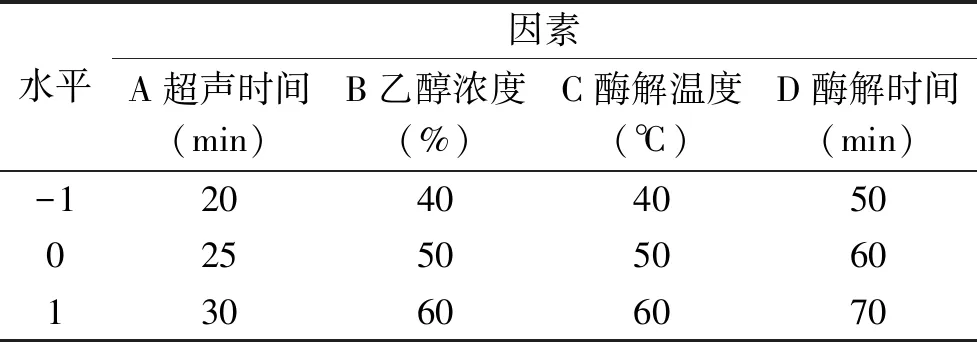
表1 超声波提取薰衣草花色苷的响应面分析因素与水平表Table 1 The experimental factors and levelsTable of response surface analysis
1.2.5 薰衣草花色苷的纯化 按照1.2.4节中优化工艺提取薰衣草花色苷粗提液,上清液经浓缩、用石油醚萃取、水相通过D-101大孔吸附树脂吸附纯化、用酸化的乙醇溶液洗脱,洗脱液再浓缩、冷冻干燥,得到粉末,低温下保存,备用[20]。
1.2.6 不同pH薰衣草花色苷溶液的热稳定性 称取一定量的薰衣草花色苷冻干粉,配制成360.5 mg/L的花色苷溶液。在花色苷溶液中,分别加入缓冲溶液,调节溶液的pH为1.0、2.0、3.0、4.0、5.0、6.0,再分别置于50、60、70、80 ℃水浴中避光保温6 h。在各温度条件下,每隔1 h取样1次,取样后,放入冰水中急速冷却待测液至室温,测定其花色苷含量,平行实验3次,取其平均值。
1.2.7 不同pH下花色苷热降解动力学研究 大多数研究表明,花色苷降解遵循一级反应动力学模式。假定薰衣草花色苷的热降解反应也符合零级、一级、二级或三级反应动力学。
花色苷残留率(%)=(Ct/C0)×100
式(1)
即花色苷残留率(%)=(At/A0)×100
式(2)
式中,Ct、C0、At、A0为热处理后和处理前花色苷含量、吸光度。
根据花色苷残留率,按以下公式计算零级、一级、二级或三级动力学反应的速率常数(k)。
零级动力学方程:Ct-C0=-kt
式(3)
一级动力学方程:lnCt/C0=lnAt/A0=-kt
式(4)
二级动力学方程:1/Ct-1/C0=-kt
式(5)
式(6)
式中,t为热处理时间(h),k0、k1、k2、k3分别为零级、一级、二级、三级速率常数,min-1。
薰衣草花色苷降解的半衰期t1/2(h)由(7)式计算:
t1/2=ln2/k
式(7)
温度系数Q10由(8)式计算:
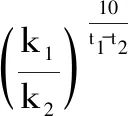
式(8)
式中,Q10表示温度每升高10 ℃,反应速率增大的比例数;k1和k2分别为温度t1和t2时的一级反应速率常数。
薰衣草花色苷降解90%所需时间D(h)由(9)式计算:
D=-ln10/t
式(9)
式中,k为T ℃下的降解速率。
薰衣草花色苷的半衰期(t1/2)变化10倍所需的温度变化Z由(10)式计算:
T=-Z lgt1/2+b
式(10)
式中,b为线性方程提供的截距。
花色苷热降解活化能(Ea)根据Arrhenius方程由(11)、焓变(ΔH,kJ/mol)由(12)式计算:
lnk=lnk0-Ea/RT
式(11)
ΔH=Ea-RT
式(12)
式中,R为气体常数,8.314 kJ/(mol·K);k0为频率常数,min-1;T为绝对温度(K)。
1.3 数据处理
使用Origin 8.0处理实验数据,采用Design Expert V 8.0.6.1软件进行二次回归拟合以及方差分析。
2 结果与分析
2.1 单因素实验
2.1.1 果胶酶添加量对薰衣草花色苷得率的影响 由图1可知,随着果胶酶量的增加,花色苷得率呈现先逐渐升高,然后基本保持平稳,最后呈缓慢降低的趋势。这可能由于底物细胞壁含有果胶,随着果胶酶量的增加时,能够促进果胶物质的水解和溶质扩散,有利于花色苷溶出;当果胶酶添加量在0.10%~0.20%范围内时,酶浓度趋于饱和,细胞壁的降解较彻底;而过量的果胶酶,不仅会抑制酶的活性,而且会水解花色苷中糖苷键,破坏花色苷结构[15,21],进而影响提取效果。考虑到经济性,故选择0.10%为最佳加酶量。

图1 加酶量对花色苷得率的影响Fig.1 Effects of enzyme dosage on anthocyanins yield
2.1.2 乙醇浓度对薰衣草花色苷得率的影响 由图2可知,在一定范围内,花色苷得率随着乙醇浓度的增大而增大,当乙醇浓度为50%时,花色苷提取效果最佳;继续增加乙醇浓度,花色苷得率反而逐渐下降。这可能是因为随着乙醇浓度的增加,溶剂的渗透力增强,有利于花色苷的释放。继续增大乙醇浓度,不仅使得溶液的极性降低,导致极性花色苷糖苷溶解度下降,还使得一些醇溶性杂质以及亲脂类物质的溶出量增加,从而与花色苷形成竞争,不利于花色苷的溶出,同时增加了后续工艺难度,故乙醇浓度选择40%~60%为宜。
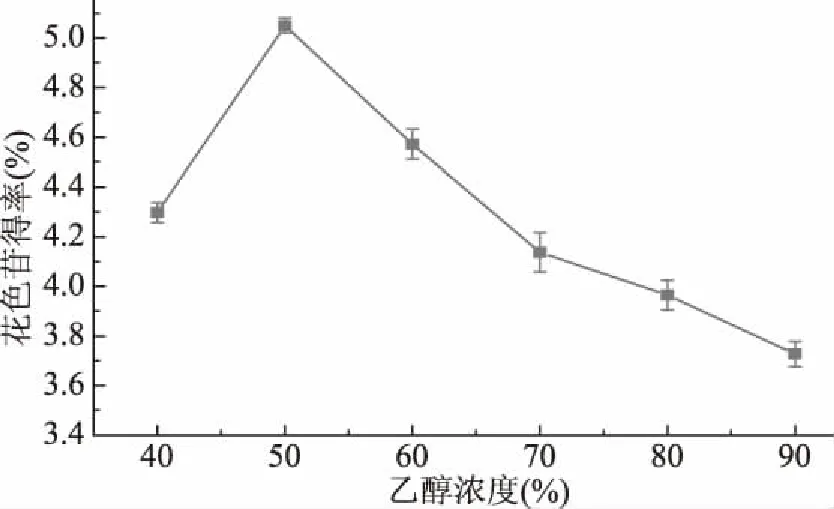
图2 不同乙醇浓度对花色苷得率的影响Fig.2 Effects of ethanol concentration on anthocyanins yield
2.1.3 酶解时间对薰衣草花色苷得率的影响 由图3可知,随着酶解时间的延长,花色苷得率迅速升高;当酶解时间60 min时,提取效果最好,花色苷得率达5.83%;当继续延长酶解时间,花色苷得率反而有所降低,这可能是因为酶解时间为60 min时,酶解反应基本完成;继续延长酶解反应时间不仅会使花色苷发生氧化,导致花色苷分子结构部分分解而被破坏,还使得其它非花色苷成分大量溶出,从而导致花色苷得率反而降低,且增加了能耗,不利于工业生产。故选择50~70 min为宜。

图3 酶解时间对花色苷得率的影响Fig.3 Effects of enzymatic hydrolysis time on anthocyanins yield
2.1.4 酶解温度对薰衣草花色苷得率的影响 由图4可知,花色苷得率随着酶解温度的升高呈现先升高后下降的趋势。当酶解温度为50 ℃时,花色苷得率最高,说明酶达到活性最强。这可能是在低温度下,酶的活性没有有效的发挥作用,随着温度升高,溶液体系的热能增加,促进酶分子和活性物质分子的渗透、扩散和溶解,加快分子运动速度,同时增强酶的活性,促进酶解反应加速,使得花色苷更易释放到溶剂中;但温度过高,使酶的稳定性降低,甚至高温会破坏酶的结构,减弱或抑制酶的活性,导致酶解速率降低。另外,温度升高,花色苷易发生氧化或分解,使得稳定性降低,从而使得率下降。故选择40~60 ℃为宜。

图4 酶解温度对花色苷得率的影响Fig.4 Effects of enzymatic hydrolysis temperature on anthocyanins yield
2.1.5 超声提取时间对薰衣草花色苷得率的影响 由图5可知,随着超声提取时间的延长,花色苷得率呈先逐渐升高后略下降的趋势,超声时间为25 min 时,花色苷得率达到最大,说明大部分花色苷已从组织中溶出,体系内花色苷浓度达到动态平衡;继续延长时间,花色苷得率略有降低,这可能是因为随着超声提取时间的延长,花色苷在空化作用下加剧被氧化降解从而破坏花色苷结构和稳定性,导致花色苷得率略有下降。因此超声提取时间在20~30 min为宜。
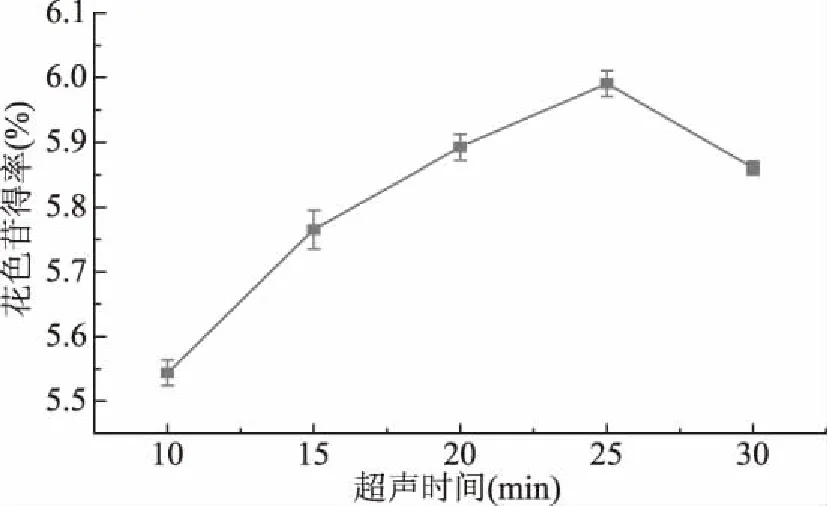
图5 超声时间对花色苷得率的影响Fig.5 Effects of ultrasonic-assisted extraction time on anthocyanins yield
2.1.6 pH对薰衣草花色苷得率的影响 由图6可知,当pH在2~3之间,随着pH的升高,花色苷得率逐渐增大;pH在3时,花色苷得率达到最高;当pH大于3时,花色苷得率反而逐渐降低。这说明pH为3左右是该体系中酶解反应的最适pH,在此条件下,果胶酶的活性最高,酶解反应效果最佳,且花色苷在酸性环境中稳定存在,故选择pH3为宜。
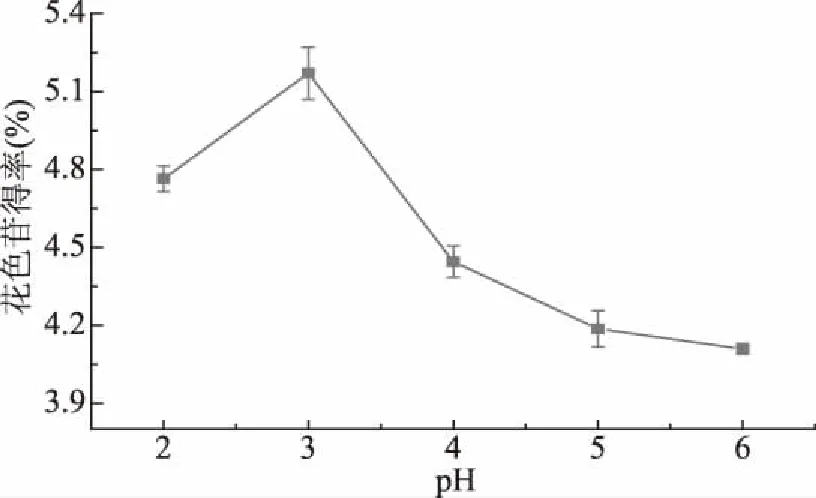
图6 pH对花色苷得率的影响Fig.6 Effects of pH on anthocyanins yield
2.2 响应面试验
2.2.1 响应面回归模型的建立与分析 提取薰衣草花色苷的响应面试验设计方案与结果见表2。
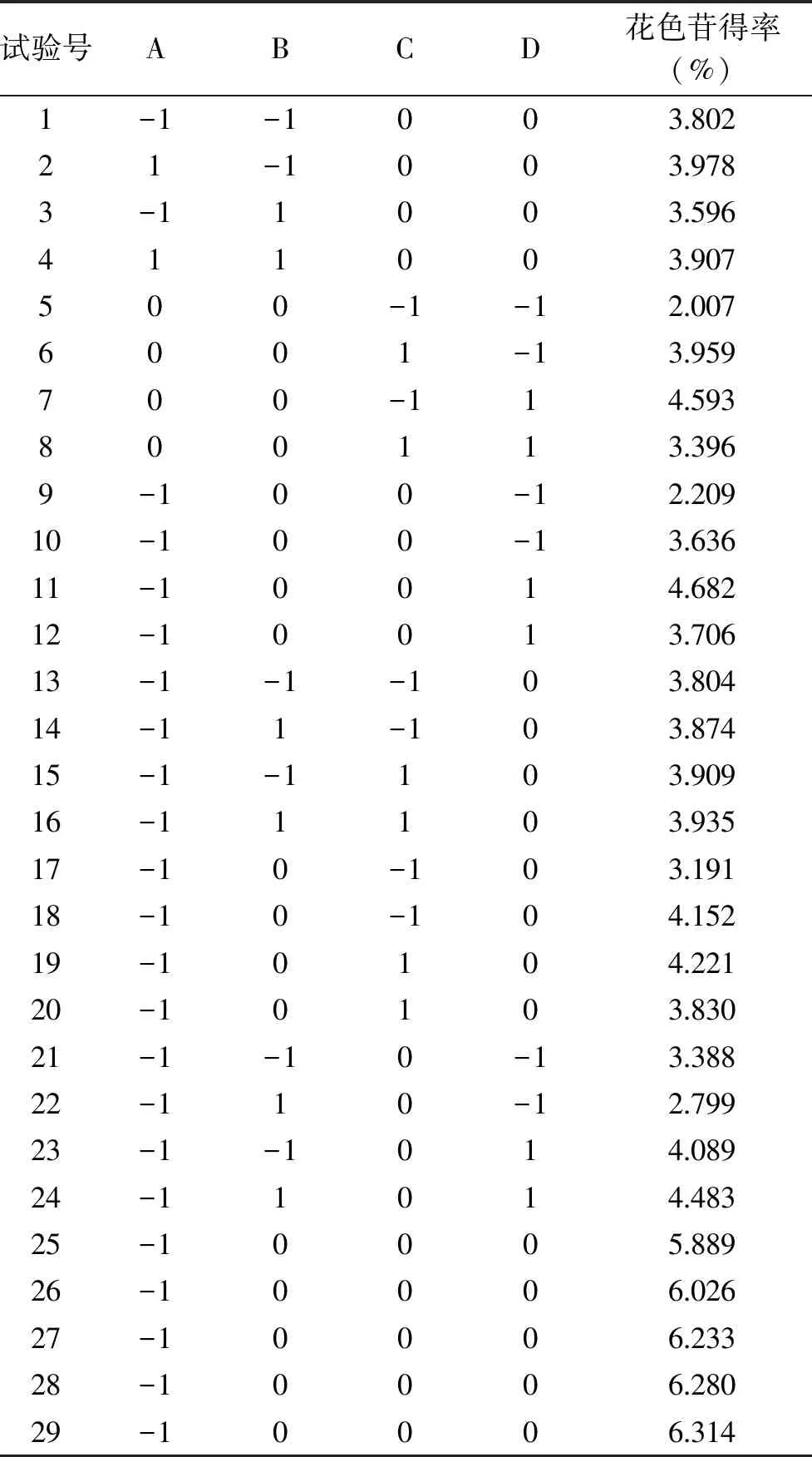
表2 响应面试验设计及结果Table 2 Experimental design and results of response surface experiment
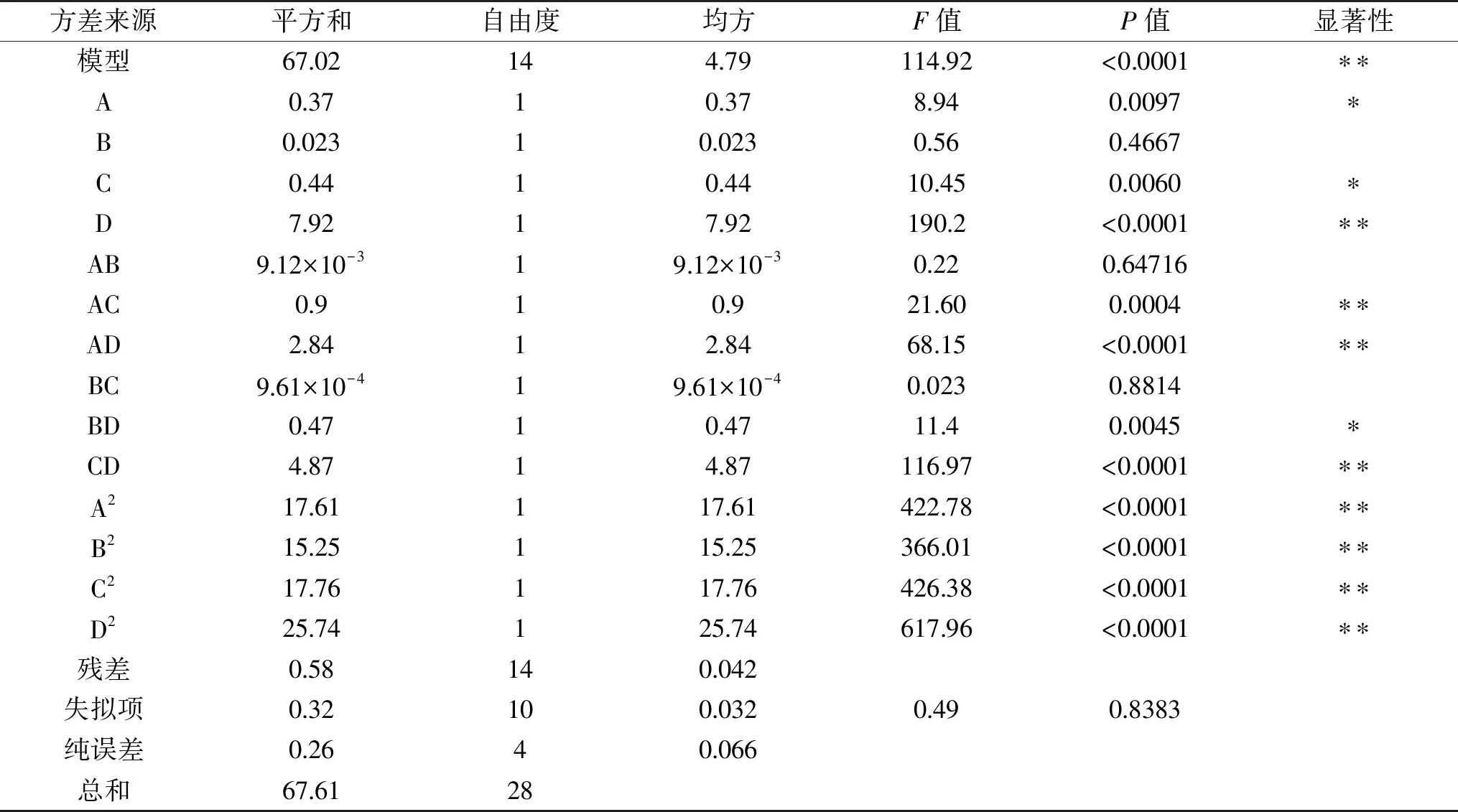
表3 回归方程方差分析Table 3 Analysis of variance for the developed regression model
注:P<0.0010表示该指标非常显著,**;P<0.0500表示该指标显著,*;P>0.0500表示该指标不显著。
利用Design-Expert 8.0软件对试验数据进行回归拟合,得到薰衣草花色苷得率对4个自变量因子的二次多元回归方程模型为:花色苷得率Y=6.15+0.13A-0.031B+0.14C+0.58D+0.034AB-0.34AC-0.60AD-0.011BC+0.25BD-0.79CD-1.17A2-1.09B2-1.18C2-1.42D2,此方程中各项系数的绝对值大小反映了各因子对响应值的影响程度。
由回归方程系数显著性检验可知,该模型的一次项D、交互项AC、AD、CD和平方项A2、B2、C2、D2对花色苷得率的影响极显著(P<0.01),一次项A、C和交互项BD对花色苷得率的影响显著(P<0.05),其他项不显著,表明各因素对花色苷得率的影响不同。从F值可知,各因素对花色苷得率影响的显著性大小顺序为酶解时间>酶解温度>超声时间>乙醇浓度。
2.2.2 响应面分析 为了进一步确定各因素间的交互作用对响应值的影响,利用Design Expert-V8.0.6.1软件中响应面图对回归方程进行分析,结果见图7。
根据响应面图中曲线陡峭程度和等高线形状,可以直观地反映出各因素交互作用对响应值影响的显著性。由图7可知,交互项超声时间与酶解温度AC、超声时间与酶解时间AD、乙醇浓度与酶解时间BD和酶解温度与酶解时间CD对花色苷得率的曲线非常陡峭,等高线呈椭圆形,表明其交互作用显著;交互项超声时间与乙醇浓度AB和乙醇浓度与酶解温度BC对花色苷得率的曲线较平缓,且等高线图呈圆形,表明其交互作用不显著,但其对花色苷得率存在一定的影响,这与前面方差分析结果一致。
2.2.3 最佳工艺的确定与验证实验 在加酶量0.15%和pH为3的最佳单因素试验结果基础上,通过Design Expert V8.0.6.1软件对回归模型进行最优化分析,得到超声波辅助酶法提取薰衣草花色苷的最佳工艺条件为浓度50.1%乙醇溶液作为提取剂、酶解温度为49.88 ℃、酶解时间62.08 min、超声时间25.01 min,在此条件下,预期花色苷得率可达到6.21%。考虑到实际试验条件的可操作性,将最佳工艺条件修正为乙醇浓度50%、酶解温度50 ℃、酶解时间62 min、超声时间25 min,在此条件下进行3次重复验证实验,薰衣草花色苷平均得率为6.22%。实际值与理论预测值非常接近,其相对误差约为0.16%,可以说明该数学模型可靠,采用响应面分析法优化超声辅助酶法提取薰衣草花色苷的工艺是可行的。

图7 各因素交互作用的响应面图Fig.7 Response surface of the interactive effects of various factors
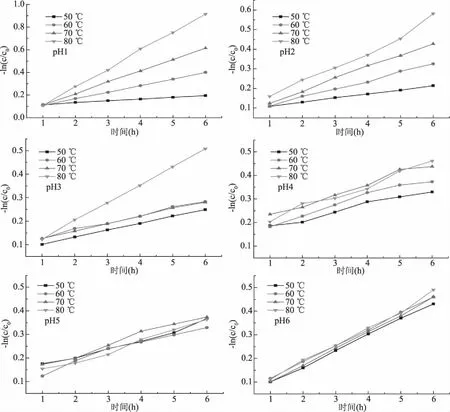
图8 在不同pH下花色苷的热稳定性Fig.8 Thermal stability of anthocyanins at different pH values
2.3 不同pH薰衣草花色苷溶液的热稳定性
如图8所示,随时间变化,花色苷含量呈现一定的规律:温度越高,花色苷降解越快,稳定性越差;在相同pH条件下的花色苷随加热时间和温度的变化出现不同程度降解。80 ℃时,花色苷的降解明显比其他温度下降解速率快,花色苷浓度变化明显,说明花色苷损失较大;花色苷在低pH、低温情况下,稳定性较好。通过直接观察现象,花色苷受温度的影响,颜色变化较大,特别是在高温情况下尤为明显,而在低温下,颜色持久鲜艳。
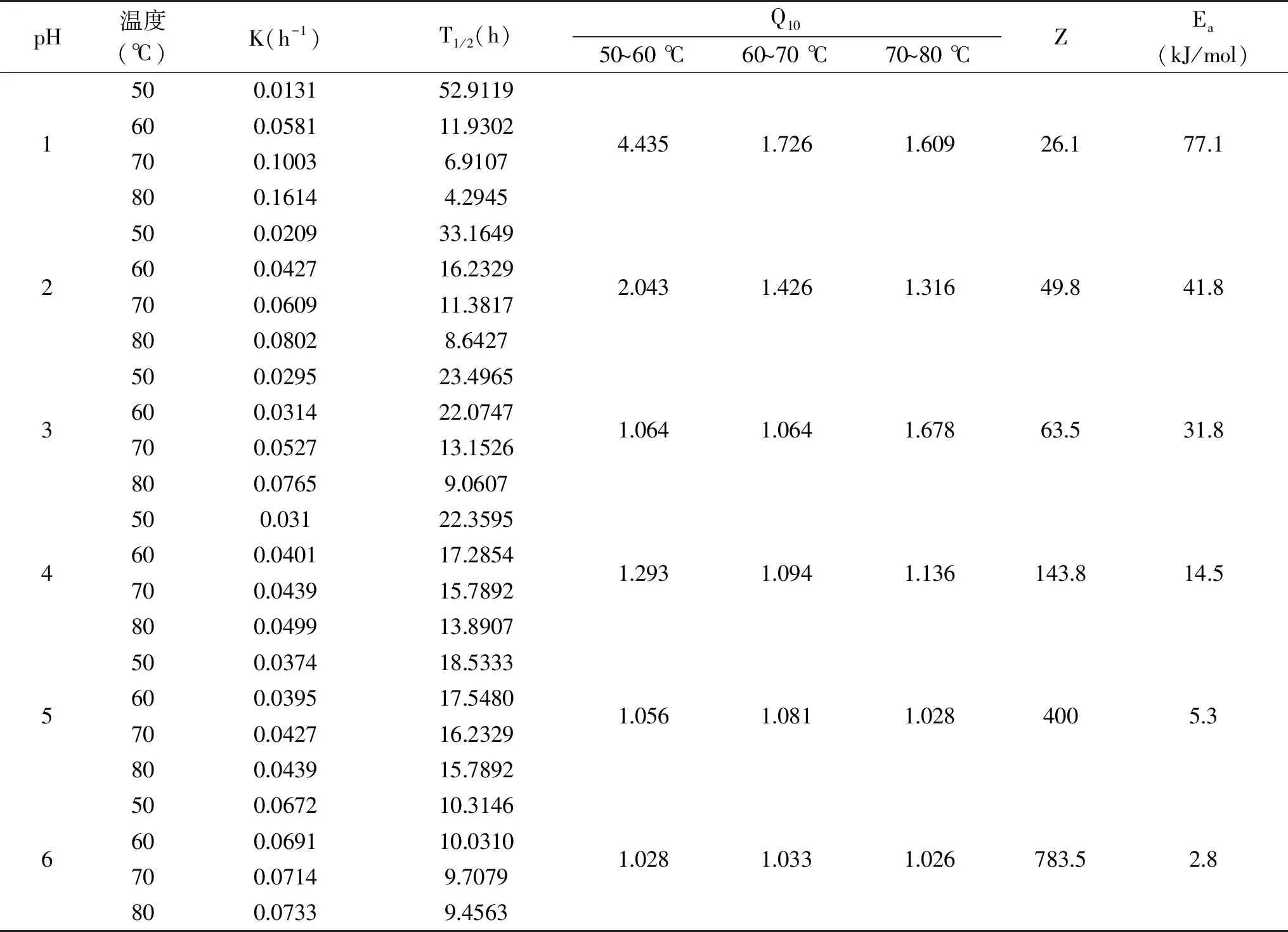
表4 不同pH下薰衣草花色苷溶液的动力学参数Table 4 Kinetic parameters of lavender anthocyanin solution under different pH values
同样,薰衣草花色苷稳定性受pH的影响很大。在相同温度下,随pH的增加,花色苷浓度降低,残留值变少,这也与早期文献报道相符[22],可能是pH小于3.0时,薰衣草花色苷主要以2-苯基苯并吡喃阳离子的形式存在,随着pH升高,薰衣草花色苷逐渐转变为不稳定的查尔酮结构,因此薰衣草花色苷在酸性环境中,稳定性更强。
2.4 不同pH下薰衣草花色苷热降解动力学研究
为了进一步了解薰衣草花色苷降解过程,对花色苷进行动力学研究。根据Arrhenius公式拟合线性回归分析,由不同温度和pH下,-ln(Ct/C0)与时间做图(见图8)得速率常数(k),线性回归曲线相关系数R2均大于0.9(见表4)。由速率常数k的大小和R2值确定薰衣草花色苷降解反应符合一级反应动力学反应,这与不同花色苷来源如玫瑰[23]、蓝莓[19]、玫瑰茄[24]、桑葚[18]中的花色苷降解动力学结果相似。
如表4所示,不同pH条件下,薰衣草花色苷热降解速率K(h-1)和半衰期T1/2(h)受加热温度的影响。花色苷热降解速率K(h-1)随温度的升高而加快,同时伴随着半衰期T1/2(h)减少。花色苷在pH为1时Ea最大且Z值最小,表明花色苷在pH为1时发生热降解需要的能量最高,热稳定性好。pH为6时Ea最小且Z值最大,热稳定性最差,花色苷降解反应对温度变化敏感性比较弱。
在相同温度下,不同的pH对花色苷的降解速率不一样[25],随pH的增大,花色苷的降解速率加快。在pH为1时,薰衣草花色苷Z值最小,活化能Ea最大,说明薰衣草花色苷在此时热稳定性最好,热降解需要更高的能量。随着pH的增大,Z值逐渐增大,活化能Ea逐渐减小,同样说明随 pH增大,薰衣草花色苷的热稳定性变差。
表5显示不同pH下,花色苷溶液的热降解热力学参数,可以进一步解释热降解反应中发生的各种现象。焓变ΔH客观反映了化学键的强度大小,值越小表示反应的势垒越低,越容易发生反应。值得注意的是相同pH下,不管温度如何变化,薰衣草花色苷的焓变ΔH几乎相等,变化不大,说明花色苷降解所需要的能量势垒大小与温度无关。
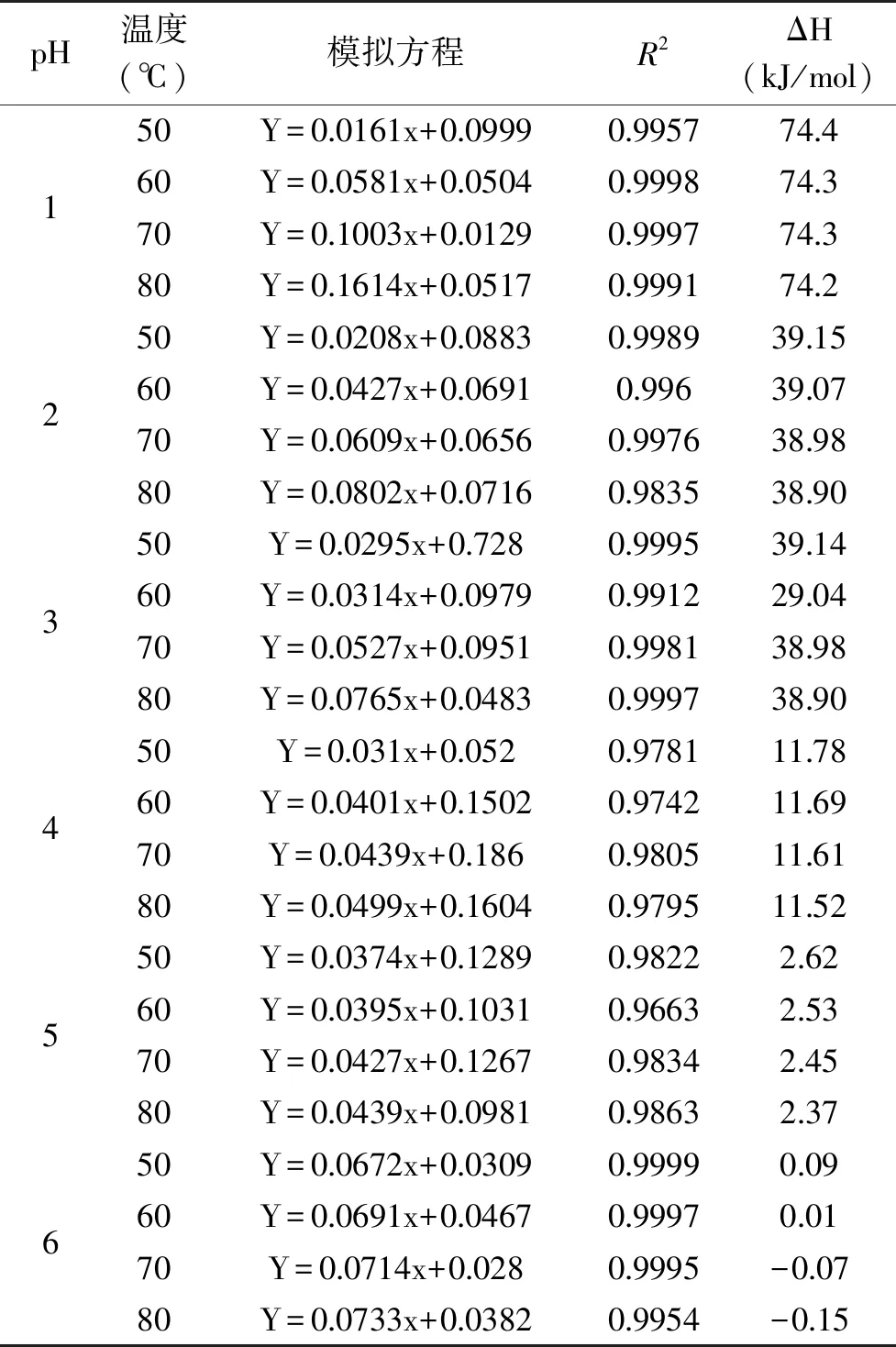
表5 不同pH下花色苷溶液热力学参数Table 5 Thermodynamic parameters of anthocyanin solution at different pH values
3 结论
本实验利用超声波辅助酶法提取薰衣草中花色苷,在单因素实验确定最佳加酶量0.10%和pH为3的基础上,以超声时间、酶解温度、酶解时间和乙醇浓度为主要因素进行Box-Behnken实验设计,建立薰衣草花色苷提取的数学模型。经响应面优化得出提取薰衣草花色苷的最佳工艺参数为:乙醇浓度50%、酶解温度50 ℃、酶解时间62 min、超声时间25 min,在此条件下薰衣草花色苷得率为6.22%,较单一超声提取法(4.88%),超声辅助酶法具有明显提取优势。另外,通过对不同pH和温度下纯薰衣草花色苷稳定性的研究发现,不同pH下,薰衣草花色苷热降解符合一级动力学方程;薰衣草花色苷热稳定性较差,当pH6.0时,其对热最为敏感,pH1.0时,其热稳定性最强;在相同pH下,花色苷降解所需要的能量势垒大小与温度无关。

