不同分子量壳聚糖型SO2缓释材料性能研究
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
甲壳素(chitin)是甲壳类动物外壳的结构材料,在自然中广泛存在,存在量仅次于纤维素。其脱乙酰产物壳聚糖(chitosan)是一种天然的可食性保鲜材料,由于其有较好的成膜性、气体选择透过性和抗菌性,被广泛地用做葡萄的采前和采后保鲜包装处理[1]。但壳聚糖的溶解性能较差,不溶于水、碱性溶液和大部分有机溶剂,这大大限制了壳聚糖的应用。不过由于壳聚糖分子链中氨基葡萄糖单元上的伯羟基、仲羟基以及氨基等基团具有较强的反应活性[2-3],可通过功能化修饰或改性方法改善其溶解,并被赋予各种不同的功能特性[4-7],制备出各种不同性能的壳聚糖衍生物。例如在医药行业中使用的壳聚糖改性后制备的缓释材料、医用保水赋形材料[8-9]以及利用其生物相容性、抑菌性能制备的其他多种新型药用材料[10]。
目前,国内外相关研究人员在气调贮藏[11-13]、辐射处理[14]、臭氧[15]、二氧化氯[16]等保鲜措施方面做了一些研究,但成本高以及多次施药处理在生产上可行性不高。SO2兼具防腐、钝化氧化酶活性、抗氧化、抑制呼吸、延缓代谢等多重功能[17],是目前使用最为广泛的葡萄保鲜剂。但由于SO2对人体有毒害作用,因此通过SO2保鲜处理的葡萄的保鲜剂残留量问题也是人们关注的焦点之一。
本研究以壳聚糖为主要原料,利用金属离子配位反应、硫化反应及包埋技术制备壳聚糖型SO2缓释材料。采用场发射环境扫描电子显微镜、傅里叶红外光谱仪对材料进行表征,探讨不同分子量壳聚糖合成的SO2缓释材料对SO2释放的影响。选出合成壳聚糖型SO2缓释材料的最佳分子量,为今后合成新型SO2缓释材料提供理论基础,并为将该材料用于葡萄保鲜奠定基础。
1 材料与方法
1.1 材料与仪器
壳聚糖(脱乙酰度97%,分子量分别为50、100、150 kDa)、壳聚糖盐酸盐(分子量为50 kDa) 自江苏瑞多生物有限公司;冰乙酸、丙酮、无水乙醇、甲酸、硫酸铜、氢氧化钠、碘 分析纯,天津市致远化学试剂有限公司;焦硫酸钠 分析纯,天津市光复精细化工研究所;硫代硫酸钠 分析纯,天津市北联精细化学品开发有限公司;氨水 天津永晟精细化工有限公司;沉淀硫(含Al) 分析纯,天津市福晨化学试剂厂;四硫化双五亚甲基秋兰姆(≧98%) 上海麦克林生化科技有限公司。
FA2004N电子天平 d=0.01 mg,上海菁海仪器有限公司;101-E电热鼓风干燥箱 北京市永光明医疗仪器有限公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;85-2控温磁力搅拌器 江苏金怡仪器科技有限公司;pHS-3E酸度计 天津市赛得利斯实验分析仪器制造厂;HTC-1数显温湿度计 红旗仪表(江苏)有限公司;nicolet6700傅立叶变换红外光谱仪 赛默飞世尔科技公司;FEI Quanta 250-EDS场发射环境扫描电子显微镜-能谱仪 美国。
1.2 实验方法
1.2.1 壳聚糖型SO2缓释材料的制备 工艺流程如图1,本文拟利用金属离子对不同分子量(分子量分别为50、100、150 kDa)壳聚糖以及分子量为50 kDa的壳聚糖盐酸盐改性,进行壳聚糖分子链上N配位制得产物A;再将产物A利用胶硫剂对壳聚糖分子进行浅交联制得产物B;进一步利用产物A包埋分散亚硫酸盐或焦亚硫酸盐制备得产物C;将产物B与产物C复合制得具有SO2分段缓释、SO2缓释周期长的壳聚糖型SO2缓释材料。

图1 壳聚糖型SO2缓释材料工艺流程
Fig.1 Technological process of chitosan-type SO2sustained-release materials
1.2.1.1 产物A的制备 根据文献[18]中的合成方法,准确称取1.0 g的壳聚糖原料,溶于100 mL的1%甲酸溶液中,搅拌均匀,在磁力搅拌下滴加与壳聚糖单体等摩尔量的硫酸盐水溶液,室温反应3 h后,加稀氨水调pH至5~7,继续搅拌3 h,即为产物A,装烧杯密封备用。
1.2.1.2 产物B的制备 准确称取0.2 g的沉淀硫,研磨至变色加入1 mL饱和硫代硫酸钠溶液继续研磨,均匀后加入0.2 g四硫化双五亚甲基秋兰姆继续研磨,加入1 mL乳化剂OP-10。研磨均匀即为胶硫剂。将产物A和胶体硫以1∶1的比例混匀,在60 ℃下搅拌至颜色将要变为黑色,即为产物B,装烧杯密封备用。
1.2.1.3 产物C的制备 准确各称取0.5 g的硫代硫酸钠和焦硫酸钠,与1 mL乳化剂OP-10同时加入到液态产物A中,在60 ℃下搅拌至颜色将要变为黑色,即为产物C,装烧杯密封备用。
1.2.1.4 缓释材料的制备 将产物C与产物B以1∶1的比例分散混合,在室温下转速为2000 r/min搅拌1 h。用乙醇/丙酮(1∶1,V/V)的混合溶剂将产物沉淀出来,抽滤,用75%乙醇、无水乙醇依次洗涤沉淀,最后60 ℃烘干至恒重,即为壳聚糖型SO2缓释材料。若壳聚糖分子量为50 kDa的产物B和壳聚糖分子量为150 kDa的产物C混合,制成的壳聚糖型SO2缓释材料即为5B15C;若壳聚糖分子量为150 kDa的产物B和壳聚糖分子量为50 kDa的产物C混合,制成的壳聚糖型SO2缓释材料即为5C15B。
1.2.2 SO2释放的测定及缓释材料表征
1.2.2.1 壳聚糖型SO2缓释材料释放量测定 参考文献[19]所载方法测定在室温环境下每天释放的SO2变化量及变化趋势,将定量的壳聚糖型SO2缓释材料放入1号磨口锥形瓶中,室温下放置24 h后迅速取出壳聚糖型SO2缓释材料,放入2号瓶中,再室温下放置。48 h后,再从2号瓶中迅速取出壳聚糖型SO2缓释材料,放入3号瓶中,检测2号瓶的SO2量。依上类推,连续测定60 d的SO2缓释量,并记录每天的温湿度。
检测1号瓶释放SO2量,迅速加入100 mL新煮沸过的去离子水及1 mL,10.5 mol/L的NaOH溶液,吸收30 min后,加入2 mL淀粉指示剂,然后用1.0 mol/L的碘标准溶液滴定至恰显蓝色,记录数据,并以同样的方法作空白试验。
每1 g缓释材料释放SO2的质量mSO2(mg/g)=N(V1-V0)
式中:N:碘标准溶液的浓度,mol/L;V1:滴定试样时消耗的碘标准溶液的体积,L;V0:滴定空白试样消耗的碘标准溶液的体积,L。
1.2.2.2 红外光谱检测分析 依据文献[20]中方法对壳聚糖原料及5B15C进行检测,取溴化钾载体约100 mg,置于玛瑙研钵中,并加入少许样品(样品与载体的质量比为1∶100)充分混合、磨细、混匀、装模,然后将模具置于压片机上并真空加压至12 kPa,受压1 min,制成0.1~1.0 mm厚的透明圆形薄片。用样品架固定圆形薄片,置于红外光谱仪的样品室中进行测试。仪器的分辨率设定为0.4 cm-1,累加扫描16次。
1.2.2.3 场发射环境扫描电子显微镜分析 依据文献[21]中的测样方法,取适量原料、产物A、B、C和5B15C(壳聚糖分子量为50 kDa的产物B和壳聚糖分子量为150 kDa的产物C混合,制成的壳聚糖型SO2缓释材料)在60 ℃干燥箱中干燥至恒重的待测样品,置于环境真空模式下的样品舱中进行测试,倍数由小到大聚焦清晰后,调节最佳工作距离(WD)值;选择合适的对比度和亮度、选择适当的扫描速度和分辨率,最后将图像保存。仪器使用的电压为20 kV,设定的压力(pressure)为130 Pa、保压时间(dwell)为30 μs、模式(mode)为SE、探头(det)为GSED。得到能谱图、电镜图及元素组成。
1.3 数据处理
用WPS 2019对数据进行分析处理,用Origin 9.1作图软件进行图形绘制。
2 结果与分析
2.1 不同分子量壳聚糖型SO2缓释材料的SO2释放量
由图2可知,在室温条件下连续测样60 d内的最大温差为14.6 ℃;最大相对湿差为25%。由图3、图4可知,在该条件下壳聚糖型SO2缓释材料均有SO2气体释放,并且随着时间的增加,50和150 kDa壳聚糖合成的壳聚糖型SO2缓释材料释放SO2呈现先上升后下降的趋势。单一分子量合成的缓释材料中(图3),50和150 kDa壳聚糖合成的壳聚糖型SO2缓释材料释放曲线有先上升后下降的趋势;壳聚糖盐酸盐和100 kDa壳聚糖合成的壳聚糖型SO2缓释材料释放曲线忽上忽下,受温湿度的影响较大; 复合分子量合成的壳聚糖型SO2缓释材料比单一分子量合成的壳聚糖型SO2缓释材料的SO2释放量相对平稳(图4)。图4中壳聚糖分子量为50 kDa的产物B和150 kDa的产物C混合而成的壳聚糖型SO2缓释材料(5B15C)前4 d,由于该缓释材料在水气及氧气的作用下,含硫壳聚糖骨架分子在金属离子的催化下释放二氧化硫,使得SO2的释放量突然升高,第4~30 d释放量维持在50 mg·g-1以上,30 d之后释放量逐渐减小,并且在整个释放过程中相对5C15B其SO2的释放量随着温湿度的改变而出现忽高忽低的现象较少,受温湿度的影响较小,更适宜合成壳聚糖型SO2缓释材料。

图2 测定样品时环境的温湿度Fig.2 Temperature and humidity of the environment when measuring the sample
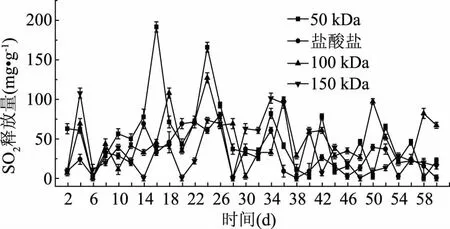
图3 不同分子量缓释材料的SO2释放量Fig.3 SO2 release from different molecular weight sustained release materials
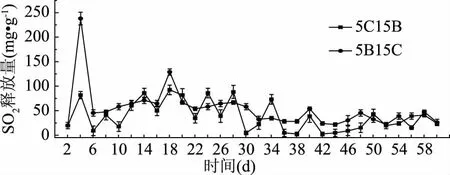
图4 复合缓释材料的SO2释放量Fig.4 SO2 release from composite slow release materials
2.2 壳聚糖原料和5B15C的红外光谱分析
通过红外光谱的检测图5可知50和150 kDa分子量的壳聚糖原料在其特征结构处均有吸收峰,即3400 cm-1左右是形成氢键缔结的-OH伸缩振动吸收峰与-NH的伸缩振动吸收峰重叠而增宽的多重吸收峰(峰Ⅰ);2918.8~2922.4 cm-1和2880.4~2881.7 cm-1为C-H的两个伸缩振动吸收峰(峰Ⅱ);1656.1~1657.8 cm-1是较强的酰胺I吸收峰(峰Ⅲ);1591.5~1598.8 cm-1是酰胺Ⅱ吸收峰(峰Ⅳ);1350~400 cm-1处为指纹区。
由图5可知,5B15C与壳聚糖原料相比在峰Ⅰ处发生蓝移,并且透过率增大;在峰Ⅱ处没有吸收峰;在峰Ⅳ处出峰较小,可忽略不计;在峰Ⅲ处,吸收峰位置没有发生变化但是透过率增加;在指纹区发生红移,透过率介于50和150 kDa的壳聚糖原料之间。
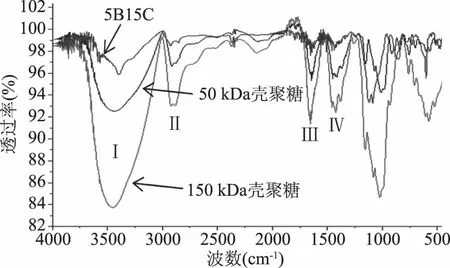
图5 红外光谱Fig.5 Infrared spectrum
2.3 扫描电镜以及元素分析
2.3.1 壳聚糖原料的场发射扫描电镜检测 由壳聚糖的化学结构式可知(图6),壳聚糖原料中主要由C、H和O元素构成,因此在能谱仪元素分析结果中只有C和O元素(图7),其中C和O元素的原子含量分别为57.74%、42.26%;归一化质量分别为64.54%、35.46%。扫描电镜下壳聚糖形状呈片状(图8)。
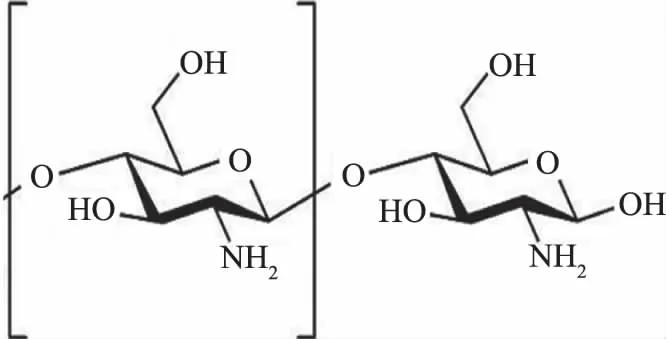
图6 壳聚糖结构式Fig.6 Structural type of chitosan
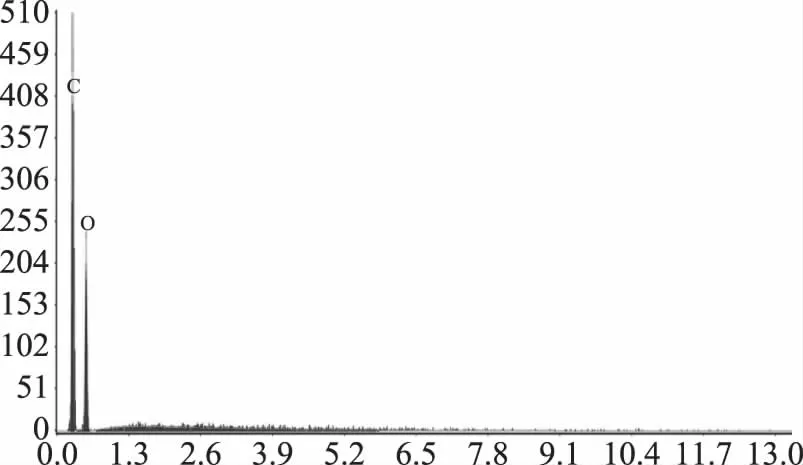
图7 壳聚糖EDS谱图Fig.7 EDS spot 1-Det 1 of chitosan

图8 壳聚糖电镜图(1600×)Fig.8 Electron micrograph of chitosan(1600×)
2.3.2 产物A的场发射扫描电镜检测 如图9,壳聚糖通过与金属离子络合配位得到改性后的产物A,使其分子链聚集状态改变,金属离子产生溶剂化效应,水溶性增加,具备良好的成膜性和包覆性,并且改变分子结构的电性质,使其正电性增强,抑菌能力增强[22-23]。由于本实验选用的金属离子盐是无水硫酸铜,故在壳聚糖的基本结构上引入了Cu离子,对其反应过程进行推测[24-25]。由能谱仪元素分析可知(图10),C、O、Cu和S的原子含量分别是24.70%、36.10%、32.71%、6.49%;归一化质量分别是40.88%、44.86%、10.23%、4.02%。电镜下观察由壳聚糖原料的片状结晶体转变成弥漫球状(图11)。

图9 产物A合成途径Fig.9 Synthetic pathway of compound A
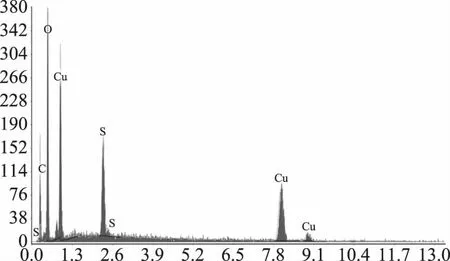
图10 产物A的EDS谱图Fig.10 EDS spectrogram of compound A

图11 产物A电镜图(1600×)Fig.11 Electron micrograph of compound A(1600×)
2.3.3 产物B的场发射扫描电镜检测 如图12所示,络合改性后的壳聚糖进行硫化交联得到产物B,在合成过程中引入了硫,使得产物B分子骨架形成含硫大网状结构,能在水分子和氧的作用下将B分子骨架上的硫转化为SO2缓慢释放,是作为贮藏前期较高浓度SO2缓释剂。其反应过程推测如下[24-25],由能谱仪元素分析(图13)可知,C、O、S、Cu及Al的原子含量分别是44.80%、36.99%、5.82%、11.58%及0.80%;归一化质量分别是57.96%、35.93%、2.82%、2.83%及0.46%,其中含有Al离子是从试剂中引入。电镜下观察产物B由产物A的弥漫球状转变为交联在一起(图14)。

图12 产物A合成途径Fig.12 Synthetic pathway of compound B
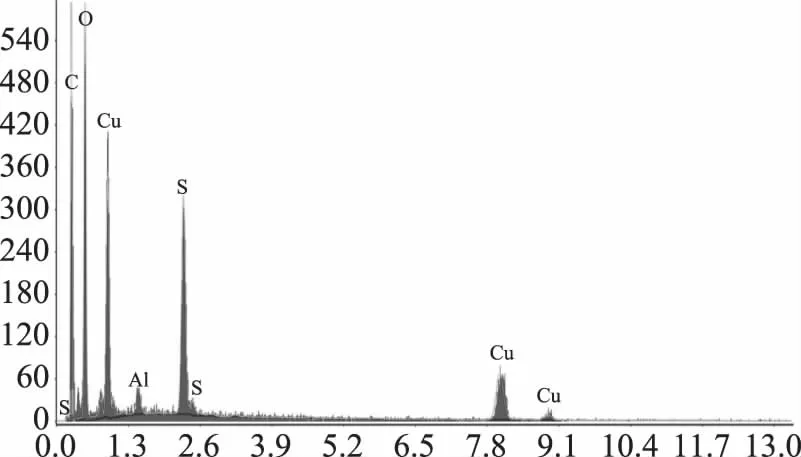
图13 产物B的EDS谱图Fig.13 EDS spectrogram of compound B

图14 产物B电镜图(1600×)Fig.14 Electron micrograph of compound B(1600×)
2.3.4 产物C的场发射扫描电镜检测 利用金属离子配位改性后的壳聚糖为包埋剂,对亚硫酸盐、焦亚硫酸盐进行包埋得到产物C,故在包埋过程中引入了硫,作为贮藏中后期SO2平稳长效缓释剂,其结构推测如图15[24-25],由能谱仪元素分析(图16)可知,O、Cu、S的原子含量分别是31.59%、53.39%、15.03%;归一化质量分别是60.13%、25.59%、14.27%。电镜下观察产物C由产物A的弥漫球状转变为包埋在一起(图17)。
图15 产物C形态Fig.15 Pattern of compound C
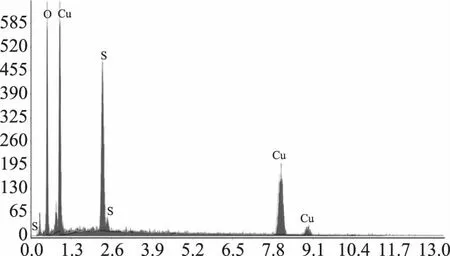
图16 产物C的X-射线能谱图Fig.16 EDS spectrogram of compound C

图17 产物C电镜图(1600×)Fig.17 Electron micrograph of compound C(1600×)
2.3.5 5B15C的场发射扫描电镜检测 产品5B15C为固体粉末,呈墨绿色,其产品如图18。由能谱仪元素分析(图19)可知,C、O、Cu、S的原子含量分别是21.23%、36.00%、32.08%、10.70%;归一化质量分别是36.40%、46.34%、10.40%、6.87%。电镜下观察为絮云状(图20)。

图18 壳聚糖型SO2缓释材料Fig.18 Chitosan-type SO2 sustained-release material
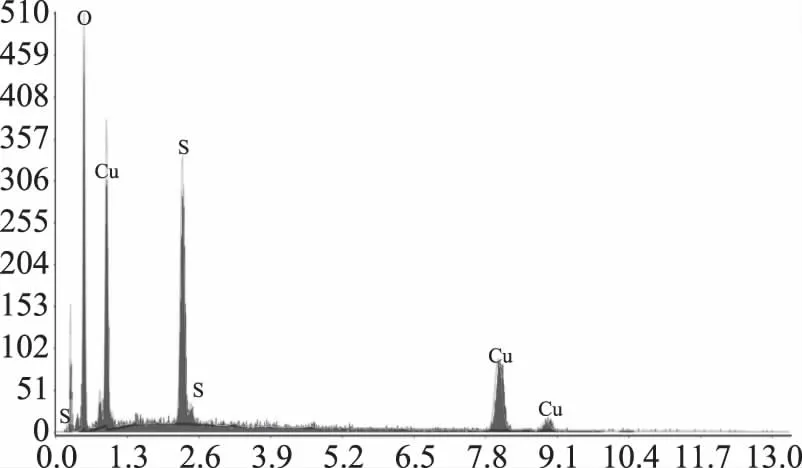
图19 能谱仪元素分析Fig.19 EDS element analysis

图20 5B15C电镜图(6000×)Fig.20 Electron micrograph of 5B15C(6000×)
通过扫描电镜图20可知,由壳聚糖原料合成壳聚糖型SO2缓释材料的中间产物的形状和组成元素上都发生了相应的改变,说明壳聚糖型SO2缓释材料的合成途径是正确的。该材料在水气及氧气的作用下,含硫壳聚糖骨架分子在金属离子的催化下,缓慢释放二氧化硫,在缓慢释放二氧化硫的过程中形成一定的孔洞,使水汽能透入包埋剂,包埋的亚硫酸盐在金属离子的催化下转化为二氧化硫释放。
3 结论
本研究利用碘量法测定SO2释放量可知,合成的材料均有SO2气体的释放,其中最佳分子量合成的壳聚糖型SO2缓释材料(5B15C)的释放曲线在前4 d,释放SO2的量突然升高,第4~30 d释放量趋于稳定,30 d之后释放量逐渐的减小,并且受温湿度影响较小,较为符合水果保鲜的曲线[26]。通过场发射环境扫描电子显微镜、傅里叶红外光谱仪等手段对5B15C进行表征。该缓释材料在室温环境下呈粉末状、墨绿色;电镜下为絮云状,其主要元素和原子含量为21.23% C、36.00% O、10.70% S、32.08% Cu;归一化质量分别是36.40%、46.34%、6.87%、10.40%;主要官能团为-OH、-NH、C-H以及酰胺键。本研究结果为制备新型SO2保鲜剂提供了新思路和一定的理论基础。但是,目前该材料未能控制释放SO2的释放量,后续将进一步优化该缓释材料的制备配方,并在研制壳聚糖型SO2缓释材料的基础上,初探该材料对“红地球”、“木纳格”葡萄保鲜贮藏品质的影响。

