氮输入和盐渍化对天津滨海湿地土壤可培养细菌和真菌群落组成及土壤酶活性的影响
王春萍,王银华,霍玉珠,侯涛亮,马成仓,郭宏宇
(1.天津师范大学生命科学学院,天津 300387;2.天津师范大学天津市动植物抗性重点实验室,天津 300387)
湿地生态系统在保持区域生态平衡和生物多样性方面具有重要作用[1].近年来,随着大气中氮氧化物含量的急剧增加和氮肥的广泛施用,大量外源氮素进入湿地生态系统中,对其产生了严重影响[2].湿地生态系统中,土壤微生物对维持生态系统的平衡和稳定具有重要作用[3],它们不仅可以加速动植物残体的分解[4]、驱动营养物质的循环和转化[5]、推动能量流动[6],同时也参与污染物降解和环境修复等过程[7].生态系统中的氮素水平会在很大程度上影响群落微生物的生理活动、代谢特征以及结构组成等.如叶成龙等[8]研究发现,土壤微生物的呼吸速率和累积碳释放量会随施氮量的增加而显著降低;何亚婷等[9]的研究显示,施氮利于群落中细菌数量的增加,但对真菌数量的影响较小或使其数量下降,还会改变土壤微生物的群落结构组成和底物利用方式,对土壤微生物多样性的影响表现出负效应.土壤盐渍化对微生物群落的影响也有一些报道.如Yuan 等[10]发现,甘肃地区盐碱化土壤中微生物的生物量和活性都与土壤含盐量呈显著负相关;龙启福等[11]的研究表明,随着盐度升高水体微生物的种类丰富度急剧下降.
天津滨海湿地位于渤海湾西岸海河流域下游.由于受海退、成土母质、地下水、气候以及人类活动等的影响,湿地存在较为明显的盐渍化现象[12-13],而氮输入急剧增加的趋势在京津地区表现得也较为突出[14-15].本研究采用多因子交互控制实验,探究不同氮输入水平和盐度对天津滨海湿地的土壤可培养细菌和真菌群落组成及土壤酶活性的影响,为在环境条件变化背景下科学制定滨海湿地管控措施,更好地利用和保护滨海湿地土壤微生物资源提供理论依据.
1 材料与方法
1.1 材料
2017 年4 月,在天津滨海湿地中具有代表性的七里海湿地[16]采集原状土壤.选择环境条件基本一致的典型芦苇湿地,用环刀采样器(直径20 cm,高15 cm)采集土样(保留土样中的植被,主要为芦苇幼苗).共采集土样36 份,分别放置于36 个培养盆中(直径20cm,高15 cm,底部有透水孔),带回天津师范大学种植园,进行不同氮输入水平和盐度交互实验.实验中,氮输入水平设置为:0(对照)、20(与天津滨海湿地当前出现的氮输入水平基本相当)、40 g/(m2·a)(模拟未来较高氮输入水平).盐度设置为:0.1%(对照,与天津滨海湿地淡水沼泽盐度基本相当)和1.0%(与临海区域出现的盐渍化水平基本相当).两因子(氮输入水平和盐度)交互实验中共有6 个处理组合:0 g/(m2·a)×0.1%(A),0 g/(m2·a)×1.0%(B),20 g/(m2·a)×0.1%(C),20 g/(m2·a)×1.0%(D),40 g/(m2·a)×0.1%(E)和40 g/(m2·a)× 1.0%(F).将 36 盆土样随机分配到 6 个组合中,每个组合6 个重复.
将花盆置于适当大小的水盆中(维持水深3 cm),土壤通过透水孔吸收水分以保持稳定的含水量(约20%,与天津滨海湿地土壤含水量基本相当).2017 年5 月初开始进行处理,每周根据氮输入水平在土样表面施加适量尿素颗粒;根据盐度水平在水盆中施加适量NaCl 溶液.2017 年11 月,采集各实验处理中的原状湿地土壤样品,每个土样中均采用五点取样法,取样深度为0~10 cm,土样充分混匀后装入无菌样品袋中,-80 ℃下保存备用.
1.2 测定指标及方法
1.2.1 土壤细菌和真菌的分离和鉴定
采用经典稀释平板法对土壤样品中的可培养细菌和真菌进行数量测定.细菌采用牛肉膏蛋白胨培养基,真菌采用添加孟加拉红和链霉素的马丁氏培养基.将涂布后的平板倒置于培养箱中培养,细菌37 ℃下培养2~3 d,真菌28 ℃下培养3~5 d,每个土样设置3 个重复.对平板上的细菌和真菌分别进行数量统计,并采用划线法对形态不同的菌株进行纯化,根据纯化后菌落的形态特征进行菌种的初步分类,应用分子生物学方法对其进行进一步的分类鉴定.分别应用细菌和真菌基因组DNA 提取试剂盒(索莱宝科技有限公司,北京)提取细菌和真菌的基因组DNA.分别对所得DNA的特异片段进行PCR 扩增[17].以基因组DNA 为模板,利用引物 27F(5′-AGA GTT TGA TCC TGG CTC-AG-3′)和1492R(5′-GGT TAC CTT GTT ACG-ACT T-3′)扩增细菌16S rRNA 基因片段;利用引物 Geo A2(5′-CCA GTA GTC ATA TGC TTG TCT C-3′)和 Geo11(5′-ACC TTG TTA CTT TTA CTT CC-3′)扩增真菌 18S rRNA 基因片段.经纯化后的PCR 扩增产物送至生工生物工程(上海)公司进行测序.
将DNA 序列数据提交至GenBank 数据库中,使用 BLAST 程序(http://blast.st-va.ncbi.nlm.nih.gov/Blast.cgi)进行比对分析,鉴定到属分类学水平.
1.2.2 土壤酶活性测定
土壤酶活性是反映土壤微生物群落生态功能的重要指标,测定按照文献[18]中的方法进行:蔗糖酶活性的测定采用3,5-二硝基水杨酸比色法;β-葡萄糖苷酶活性的测定采用硝基酚比色法;脲酶活性的测定采用靛酚蓝比色法;蛋白酶活性的测定采用茚三酮比色法.
1.3 数据处理
利用各处理中细菌和真菌的群落组成数据,分别计算细菌和真菌群落的Shannon-Wiener 多样性指数(H)和Simpson 多样性指数(D),计算公式如下:

式中:Pi表示群落中第i 个物种的个体数占群落中个体总数的比例.
应用JMP 7 统计软件对数据进行双因子方差分析,并进行Tukey HSD 多重比较分析,用SigmaPlot 10.0 软件和Origin Pro 2017 软件作图.
2 结果与分析
2.1 不同处理中土壤可培养细菌和真菌的群落组成
本研究共分离得到可培养细菌和真菌各10 个属,如图1 所示.

图1 不同处理下土壤可培养细菌和真菌的群落组成Fig.1 Community composition of soil culturable bacteria and fungi under different treatments
由图1(a)可知,在不同氮输入水平和盐度处理组合中均分布有农杆菌属(Agrobacterium)、微杆菌属(Microbacterium)、溶杆菌属(Lysobacter)和芽孢杆菌属(Bacillus).特别是农杆菌属和芽孢杆菌属,在各处理中均占有较高比例.而红球菌属(Rhodococcus)只出现在氮输入0 g/(m2·a)和盐度0.1%(占1.54%)以及氮输入0 g/(m2·a)和盐度1.0%(占0.86%)处理组合中;类芽孢菌属(Paenibacillus)只出现在氮输入0 g/(m2·a)和盐度 0.1%处理组合中(占 3.08%).由图1(b)可知,在不同氮输入水平和盐度处理组合中均分布有曲霉属(Aspergillus)、拟青霉属(Paecilomyces)、镰刀菌属(Fusarium)、青霉属(Penicillium)和多环孢霉属(Plectosphaerella).相比盐度为0.1%的处理组合,青霉属在1.0%盐度条件下占有较高的比例;而曲霉属在0.1%盐度条件下占有较高的比例.
2.2 不同处理中土壤可培养细菌和真菌的数量

图2 不同处理下土壤可培养细菌和真菌的数量Fig.2 Quantities of soil culturable bacteria and fungi under different treatments
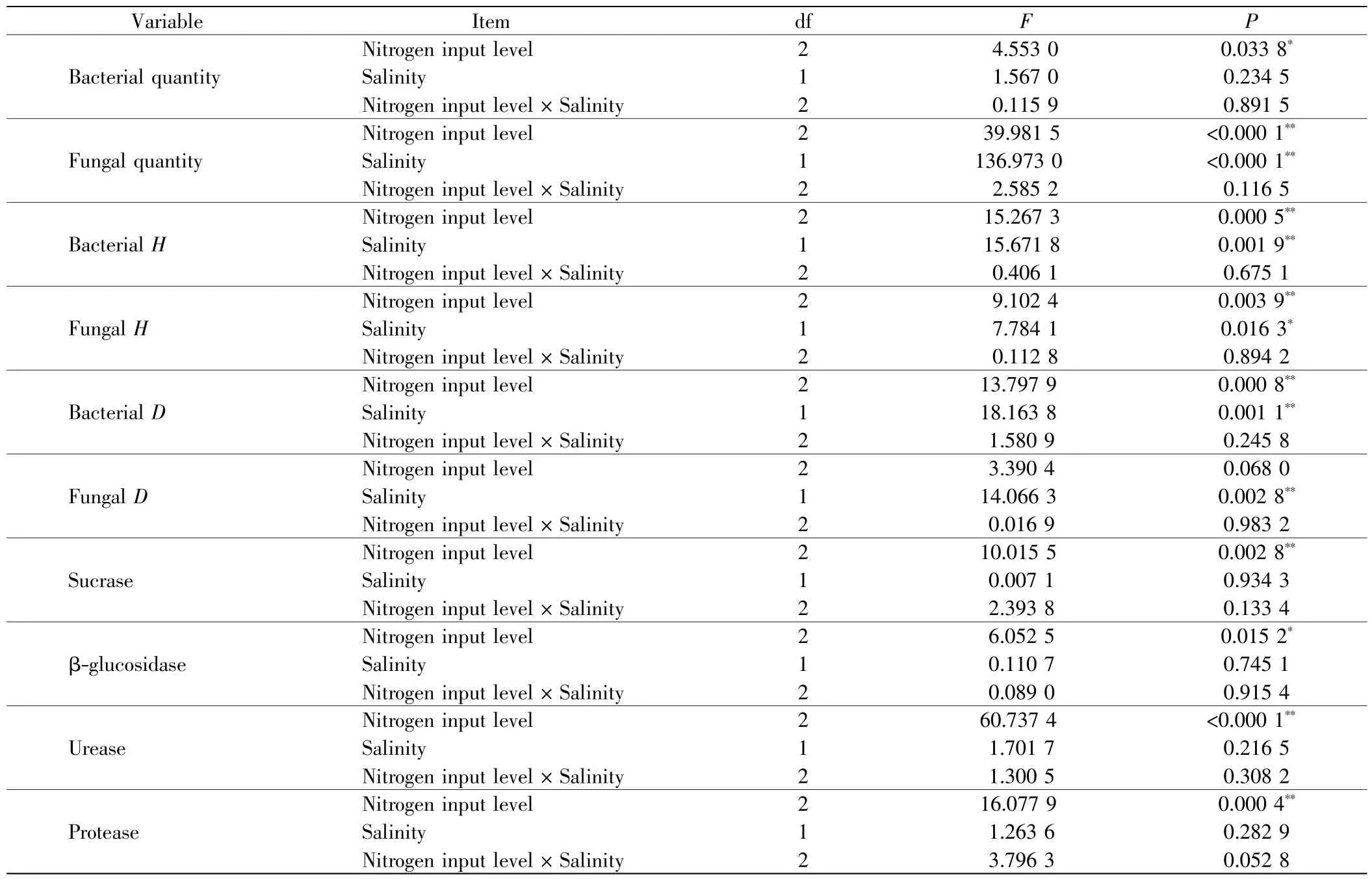
表1 氮输入水平、盐度及其交互作用对土壤细菌和真菌数量、群落多样性及土壤酶活性作用的方差分析结果Tab.1 ANOVA results of the effects of nitrogen input level,salinity and their interaction on quantities,community diversity and soil enzyme activities
不同处理条件下,天津滨海湿地土壤可培养细菌和真菌的数量如图2 所示,氮输入水平、盐度及其交互作用对细菌和真菌数量、群落多样性及土壤酶活性影响的方差分析结果如表1 所示.由图2(a)可以看出,土壤可培养细菌数量随氮输入水平的增加呈上升趋势,方差分析结果表明氮输入水平的提高对细菌数量有显著促进作用(P <0.05).在相同氮输入水平下,较高盐度对细菌数量有一定程度的抑制作用,但未达到显著水平(P>0.05).
由图2(b)可以看出,土壤可培养真菌数量随氮输入水平和盐度的增加而降低.由表1 可以看出,氮输入水平和盐度对土壤真菌数量均有极显著影响(P<0.01),
但二者交互作用的影响则不显著(P>0.05).较高盐度对土壤真菌数量的抑制作用随氮输入水平的提高有增强趋势.比较盐度对天津滨海湿地土壤可培养细菌和真菌数量的影响,发现较高盐度对真菌的抑制作用强于细菌.
2.3 不同处理中土壤可培养细菌和真菌的群落多样性
不同处理中,天津滨海湿地土壤可培养细菌和真菌群落的Shannon-Wiener 和Simpson 多样性指数如图3 所示.由图3 可以看出,随着氮输入水平的增加,土壤可培养细菌和真菌群落的Shannon-Wiener 多样性指数和Simpson 多样性指数均降低;在相同氮输入水平条件下,较高盐度使细菌和真菌群落的2 个多样性指数均下降.表1 中的方差分析结果显示,氮输入水平和盐度对细菌和真菌群落的Shannon-Wiener 多样性指数均有显著影响(P<0.05);盐度对细菌和真菌群落的Simpson 指数均有显著影响,氮输入水平仅对细菌群落的Simpson 指数有显著影响(P<0.05).氮输入水平和盐度交互作用对细菌和真菌群落多样性的影响均不显著(P>0.05).
总的来看,天津滨海湿地土壤真菌群落的多样性高于细菌群落的多样性,且前者受氮输入水平增加和盐度升高负面影响的程度小于后者.
2.4 不同处理中的土壤酶活性
不同氮输入水平和盐度处理下,天津滨海湿地的土壤酶活性如图4 所示.由图4 可以看出,随着氮输入水平的增加,土壤蔗糖酶、β-葡萄糖苷酶和脲酶的活性均呈增加趋势,蛋白酶活性则先升高再降低,氮输入水平对4 种土壤酶活性均有显著影响(P<0.05).盐度以及氮输入水平和盐度交互作用对4 种土壤酶活性的影响则不显著(P>0.05).

图3 不同处理下土壤可培养细菌和真菌群落的多样性指数Fig.3 Community diversity index of soil culturable bacterial and fungal community under different treatments

图4 不同处理下土壤的蔗糖酶、β-葡糖糖苷酶、脲酶和蛋白酶活性Fig.4 Activities of soil sucrase,β-glucosidase,urease and protease under different treatments
3 讨论与结论
土壤细菌和真菌是土壤微生物中的主要类群,在生态系统物质循环过程中起着重要作用.本研究从天津滨海湿地土壤中分离到可培养细菌和真菌各10 个属:在不同的氮输入水平和盐度处理组合中均分布有农杆菌属、微杆菌属、溶杆菌属和芽孢杆菌属,农杆菌属和芽孢杆菌属在各处理中的比例均较高;在不同氮输入水平和盐度处理组合中均分布有曲霉属、拟青霉属、镰刀菌属、青霉属和多环孢霉属.考察氮输入水平和盐渍化对天津滨海湿地土壤细菌和真菌群落的影响,结果发现,氮输入水平的增加使细菌数量增加而真菌数量减少,较高的盐度会使细菌和真菌数量同时减少.对于其他生态系统的研究表明,施加氮肥会影响土壤理化性质,增加细菌数量,降低真菌数量,使土壤微生物群落的结构发生变化[19-21].如Norris 等[22]研究发现,土壤中氮输入的增加超过一定水平时土壤真菌丰度降低,从而土壤微生物群落由真菌占优势转变为细菌占优势.苏丹等[23]研究了施氮水平对桉树林土壤微生物群落的影响,结果表明,施氮显著降低了土壤真菌/细菌数量的比值.本研究中天津滨海湿地土壤细菌和真菌数量随氮输入水平增加的变化趋势与上述研究结果相同,可能是由于氮输入的增加降低了土壤碳氮比,细菌能够利用较低碳氮比的有机物质,较真菌更适应具有较低碳氮比的环境[24].较高盐度对天津滨海湿地土壤细菌和真菌数量均有负面影响,可能是由于它对多数土壤微生物形成了生理胁迫,从而使其数量降低.景宇鹏等[25]研究了土默川平原土壤微生物对不同程度盐渍化土壤的响应特点,发现土壤细菌、真菌数量及微生物总数均呈显著下降趋势.李凤霞等[26]研究了宁夏引黄灌区不同程度盐渍化土壤中微生物区系及其动态变化,发现细菌和真菌数量均随着盐渍化程度的加重而逐渐降低.本研究的结果与这些已有研究一致,进一步表明在天津滨海湿地生态系统中盐度是影响土壤微生物数量的重要生态因子,但二者交互作用则对微生物数量没有显著影响.
本研究发现,氮输入水平增加和盐度升高均对天津滨海湿地土壤微生物的群落组成有显著影响,降低了土壤微生物群落的多样性,但二者交互作用不显著.Zeng 等[27]研究了草地生态系统微生物群落对不同氮素水平的响应,结果表明较高的施氮量改变了土壤微生物群落组成,并且降低了细菌的丰富度.Carey 等[28]研究了半干旱草原土壤微生物群落对环境条件变化的响应,发现较高的氮素添加量改变了土壤微生物群落结构.何昌飞等[29]研究了北戴河退化滨海湿地土壤细菌多样性与环境因子间的关系,发现土壤细菌的丰富度与土壤含盐量呈负相关关系.闵伟[30]在新疆石河子地区研究了咸水滴灌条件下土壤微生物群落组成、结构与功能多样性的变化特征,结果表明,咸水灌溉显著抑制了土壤微生物活性,改变了土壤微生物群落结构.李新[31]研究了内蒙古河套灌区不同土壤盐度对土壤微生物群落结构和多样性的影响,结果表明土壤盐度是土壤微生物群落结构的显著影响因素.这些结果与本研究结果一致,表明氮输入和土壤盐渍化都会对土壤微生物的群落构成产生显著影响.这可能是由于氮营养的增加使能有效利用氮源的菌群更加占优势,从而降低了群落多样性,而较高盐度对土壤微生物类群产生较强的环境选择作用,使其多样性降低.
天津滨海湿地土壤细菌的群落多样性对氮输入水平和盐度增加的负响应较真菌群落更加敏感.Wang等[32]研究增氮对土壤微生物多样性的影响,发现随着氮添加量的增加,土壤细菌群落多样性下降的幅度较大,而土壤真菌群落多样性对增氮响应较为缓和,这与本研究结果相近.由此认为,土壤细菌的群落多样性可能更易受到环境因子的影响,而真菌群落多样性则表现出一定程度的稳定性.因此,在氮输入和盐渍化加剧的条件下,天津滨海湿地土壤细菌群落多样性的保护更应受到关注.
土壤蔗糖酶对土壤中易溶性营养物质的增加起着重要作用,一般情况下土壤蔗糖酶活性较强时土壤肥力较高.土壤β-葡萄糖苷酶是将纤维素分解为葡萄糖的限制酶,其活性与土壤有机质含量呈正相关.土壤脲酶可促进有机物水解生成氨和二氧化碳,其活性与土壤有机质及全氮含量等呈正相关.土壤蛋白酶参与土壤中氨基酸、蛋白质及其他含蛋白质氮的有机化合物的转化.本研究发现,氮输入总体上提高了天津滨海湿地土壤蔗糖酶、β-葡萄糖苷酶、脲酶和蛋白酶的活性,这可能是由于氮输入缓和了湿地土壤中微生物可利用氮素含量的限制,促进了微生物总量的增加,从而使上述几种重要的土壤酶活性增强.王淑英等[33]研究施肥对黄土旱塬黑垆土土壤酶活性的影响,发现施加氮肥在一定程度上提高了土壤蔗糖酶和脲酶的活性.Frey 等[34]的研究表明,氮沉降增加显著促进了森林生态系统中土壤β-葡萄糖苷酶的活性.于德良等[35]探究了沙地樟子松人工林中土壤酶活性受土壤理化因子的影响,发现土壤蛋白酶活性随有效氮含量的增加而增强.本研究和这些已有研究的结果都证实了氮输入水平的增加会提高与土壤微生物相关的土壤酶的活性.这表明在天津滨海湿地生态系统中氮输入的持续增加将进一步促进与土壤微生物相关的土壤酶活性,从而可能加速湿地土壤中碳氮营养物质的转化和释放[36-37],加剧天津滨海湿地和水体的富营养化趋势.

