miR-616通过靶向TIMP-2增强肺癌细胞放射敏感性的机制研究
范庞双 庞先琼
大多数肺癌患者被诊断时已处于晚期,存活率低[1-2]。放射疗法(Radiation therapy,RI)是一种广泛用于临床抗癌细胞的治疗方式,但许多患者表现出对RI获得性放射抗性导致治疗失败[3-4]。miRNA是一类内源小非编码RNA,通过阻断靶mRNA的翻译在基因表达的调控中发挥作用[5-6]。越来越多的证据表明,miRNA对包括肺癌在内的多种类型癌症的放射敏感性也起着关键作用。例如,miR-616的低表达水平与非小细胞肺癌(NSCLC)患者的放射敏感性显著相关[7]。此外,已发现miR-616上调与NSCLC患者的放射效力减弱和中位生存时间缩短有关,而对miR-616的抑制则通过刺激细胞凋亡逆转放射抗性[8]。基质金属蛋白酶抑制物-2(Tissue inhibitor of metalloproteinase-2,TIMP-2)在几种人类恶性肿瘤中被证实为抑癌基因,通过抑制LATS2基因以及基质金属蛋白酶-2、9等抑制口腔癌的转移[9];TIMP-2还可以靶向CD44或TIMP3抑制癌细胞的侵袭和转移[10]。本研究拟探讨miR-616通过靶向TIMP-2增强肺癌细胞放射敏感性的机制,为肺癌放射治疗提供理论依据。
1 材料与方法
1.1 人肺癌HCC827细胞培养及分组设计
人肺癌HCC827细胞购自南京科比奥生物技术公司,细胞在含有10%胎牛血清,2 mM L-谷氨酰胺,100 IU/mL青霉素和100 mg/mL链霉素的RPMI 1640培养基中,在37℃,5%CO2的饱和湿度环境中培养。使用第10和20代之间的细胞,每24 h更换完全培养基。
HCC827细胞组:HCC827细胞在正常培养基中培养;RI组:HCC827细胞使用X射线发生器进行X射线照射,即以4 Gy/min的固定剂量率发射,用于照射细胞的X射线的能量分级为8 Gy,照射孵育时间为24 h;miR-616 inhibitor组:为了敲低miR-616的表达,将HCC827细胞在RPMI 1640培养基中培养24 h,按照制造商推荐的程序使用LipofectamineTM2000,用miR-616-shRNA(5′-GAAGGAGAGGCAACTGGAT-3′)靶向转染HCC827细胞;miR-616 inhibitor+RI组:使用LipofectamineTM2000,用miR-616-shRNA靶向转染HCC827细胞,随后使用X射线发生器进行X射线照射。
1.2 细胞活力及细胞集落形成测定
细胞培养结束后,使用MTT方法测定细胞增殖情况。各组细胞加入20 μL MTT(5 mg/mL),随后将96孔板在5%CO2中于37℃培养箱中温育。4 h 后,弃去液体并向每个孔中加入150 μL二甲基亚砜。振荡10 min后,在酶标仪中以570 nm的波长测量光密度(OD)值,以蒸馏水为空白组,细胞存活率=(实验组OD-空白组OD)/(对照组OD-空白组OD)×100%。各组细胞接种在10 cm组织培养皿中的软琼脂中并培养1周以允许集落形成。集落定义为由至少10个细胞组成。将集落用4%多聚甲醛固定,用吉姆萨染色,并用肉眼或立体显微镜计数。形成的集落数目表示为克隆形成数目。
1.3 细胞凋亡测定
各组细胞培养结束后,使用不含乙二胺四乙酸的胰蛋白酶分离细胞,并收集到流动管中,细胞离心并弃去上清液。然后用冷PBS洗涤细胞三次并再次离心,弃去上清液。根据异硫氰酸荧光素(FITC)标记的膜联蛋白V(Annexin-V-FITC)凋亡检测试剂盒,将1×106个细胞重悬于100 μL 膜联蛋白-V-FITC/PI溶液中,摇动并混合,然后在室温下孵育15 min,加入1 mL HEPES溶液,振荡并混合。在525、620 nm带通滤波器中,在488 nm的激发波长下检测FITC和PI荧光,进行细胞凋亡分析。
1.4 细胞周期水平测定
各组细胞培养结束后,用PBS洗涤细胞三次,离心弃上清液。然后通过PBS重悬细胞并调节至1×105个细胞/mL的密度。随后,在1℃下预冷的1 mL 75%乙醇将细胞在4℃下固定1 h,然后将细胞以7 500 rpm离心5 min。然后弃去使用的冷乙醇,用PBS冲洗细胞两次,然后除去上清液。此后,细胞在37℃,黑暗条件下用100 μL RNaseA水洗30 min,在4℃下用碘化丙锭(PI)染色。在避光的条件下放置30 min。使用流式细胞仪记录激发波长为488 nm的红色荧光以检测细胞周期。
1.5 细胞侵袭水平测定
细胞培养结束后,用胰蛋白酶分离各组中的细胞,并重复研磨以制备单细胞悬浮液。然后在两次PBS冲洗后用无血清培养基重悬细胞,将细胞浓度调节至1.5×105个细胞/mL。将100 μL细胞悬浮液接种到Transwell小室中,并将500 μL含有10%FBS的培养基加入到基底外侧室中。在37℃孵育后10~12 h,移除小室,使用棉芽将未能穿透膜的细胞擦掉。然后将细胞用95%乙醇固定15 min并用0.1%结晶紫染色10 min。在三次PBS漂洗和自然风干之后,将腔室倒置在载玻片上并使用荧光显微镜拍照。从每个滤膜中随机选择五个视图(200×)以计算跨膜细胞的数量。实验重复五次。
1.6 细胞miR-616、TIMP-2基因表达水平测定
根据制造商的说明书,使用TRIzol试剂从各组细胞中分离总RNA。通过Multiscribe RT试剂盒进行逆转录。使用TaqMan microRNA测定miR-616、TIMP-2基因表达水平,并归一化至U6。使用的引物序列如下:miR-616:5′-CCTGTACGCCAACACAGTGC-3′(正向)和5′-ATACTCCTGCTTGCTGA TCC-3′(反向);TIMP-2:5′-GCCAAAGCGGTCAGTGAGA-3′(正向)和5′CCTGGTGCCCGTTGG GTT-3′(反向);U6:5′-CTCGCTTCGGCAGCACA-3′(正向)和5′-AACGCTTCACGAATTTGCGT-3′(反向);用7300 Fast Real-time PCR系统进行实时PCR。根据-2△△CT方法进行相对定量分析。
1.7 细胞TIMP-2蛋白表达水平测定
将制备的细胞和组织在冰上在RIPA裂解缓冲液补充PMSF蛋白酶抑制剂中裂解30 min。在4℃下以14 000×g离心30 min后,收集上清液。按照标准方案进行SDS-聚丙烯酰胺凝胶电泳和蛋白质印迹。人抗-TIMP-2的单克隆抗体,人抗β-肌动蛋白均以1∶1 000稀释,二抗均以1∶4 000稀释。
1.8 统计处理
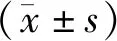
2 结果
2.1 各组HCC827细胞OD值、存活率水平的比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的OD值、存活率显著降低(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组的OD值、存活率显著降低(P<0.05)(表1)。
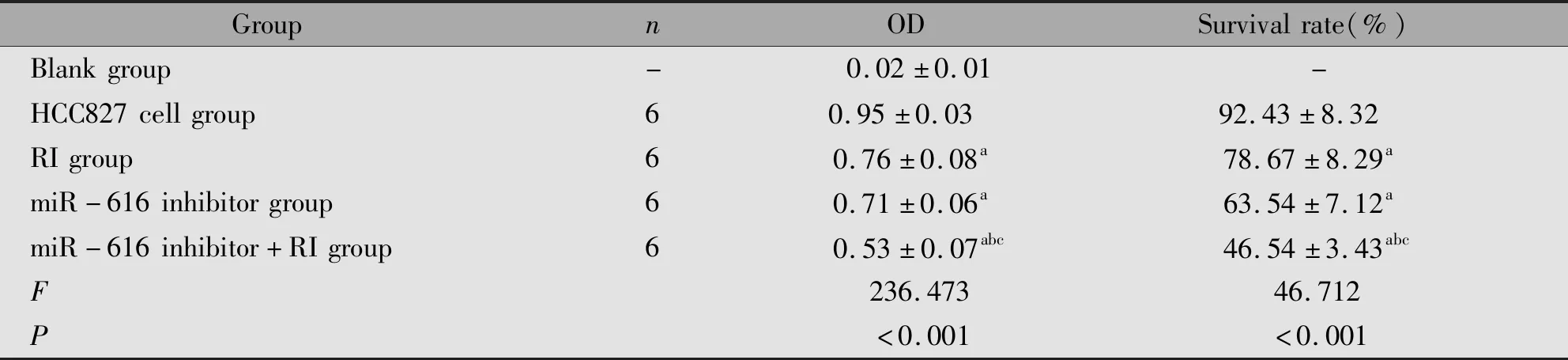
表1 各组HCC827细胞OD值、存活率水平的比较Table 1 Comparison of OD value and survival rate of HCC827 cells in each group
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
2.2 各组HCC827细胞克隆形成数目的比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的细胞克隆形成数目降低(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组细胞克隆形成数目降低(P<0.05)(图1,表2)。
2.3 各组HCC827细胞凋亡率的比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的凋亡率升高(P<0.05),与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组的凋亡率升高(P<0.05)(表3)。

表2 各组HCC827细胞克隆形成数目的比较Table 2 Comparison of the number of clone formation in each group of HCC827 cells
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
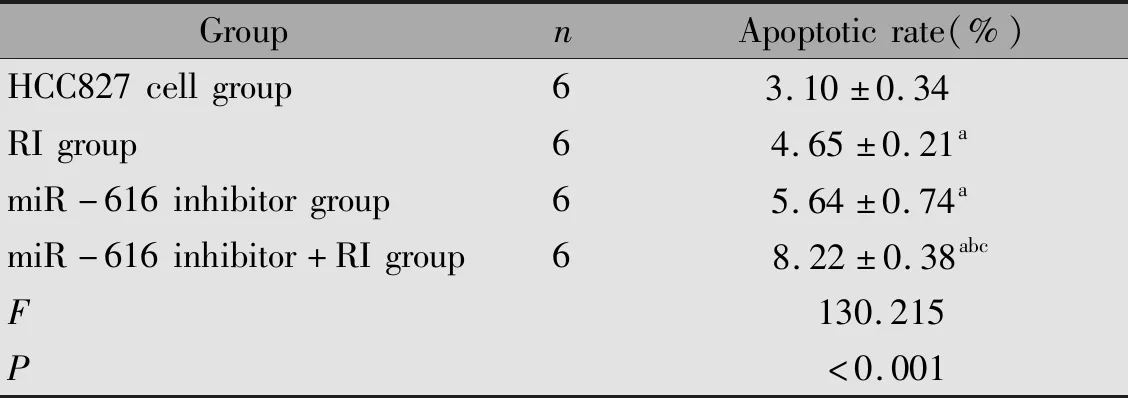
表3 各组HCC827细胞凋亡率的表达Table 3 Apoptotic rates of HCC827 cells in each group
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
2.4 各组HCC827细胞G1期比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的G1期升高(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组G1期升高(P<0.05)(图2,表4)。
2.5 各组HCC827细胞侵袭迁移能力的比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组穿膜数降低(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组穿膜数降低(P<0.05)(图3,表5)。
2.6 各组HCC827细胞miR-616、TIMP-2 mRNA表达水平比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的miR-616 mRNA表达水平降低(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组miR-616 mRNA表达水平降低(P<0.05)。与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组的TIMP-2 mRNA表达水平升高(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组TIMP-2 mRNA表达水平升高(P<0.05)(表6)。
2.7 各组HCC827细胞TIMP-2蛋白表达水平比较
与HCC827细胞组比较,RI组、miR-616 inhibitor组、miR-616 inhibitor+RI组TIMP-2蛋白表达水平升高(P<0.05);与RI组、miR-616 inhibitor组比较,miR-616 inhibitor+RI组TIMP-2蛋白表达水平升高(P<0.05)(图4,表7)。

表4 各组HCC827细胞G1期比较Table 4 Comparison of cell cycle at the G1 phase of HCC827 cells in each group
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.

表5 各组HCC827细胞侵袭迁移能力的比较Table 5 Comparison of invasion and migration ability of HCC827 cells in each group
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
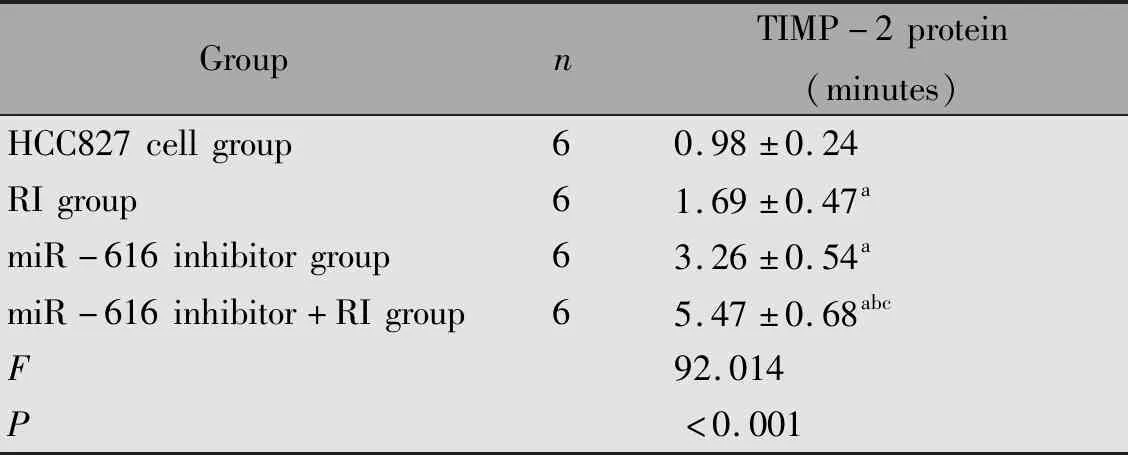
表7 各组HCC827细胞TIMP-2蛋白表达水平比较Table 7 The expression of TIMP2 protein in HCC827 cells
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
2.8 miR-616与TIMP-2 mRNA和蛋白相关分析
相关分析显示,miR-616与TIMP-2 mRNA、蛋白呈负相关(P<0.01)(表8)。
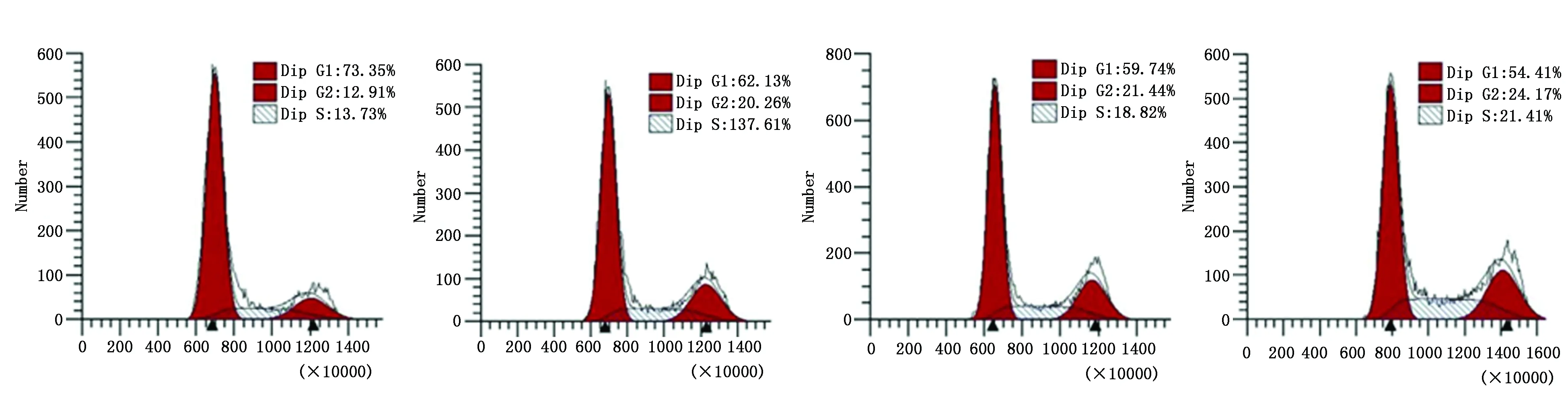
图2 各组HCC827细胞G1期比较Figure 2 Comparison of cell cycle at the G1 phase of HCC827 cells in each groupNote:A.HCC827 cell group;B.RI group;C.miR-616 inhibitor group;D.miR-616 inhibitor + RI group.
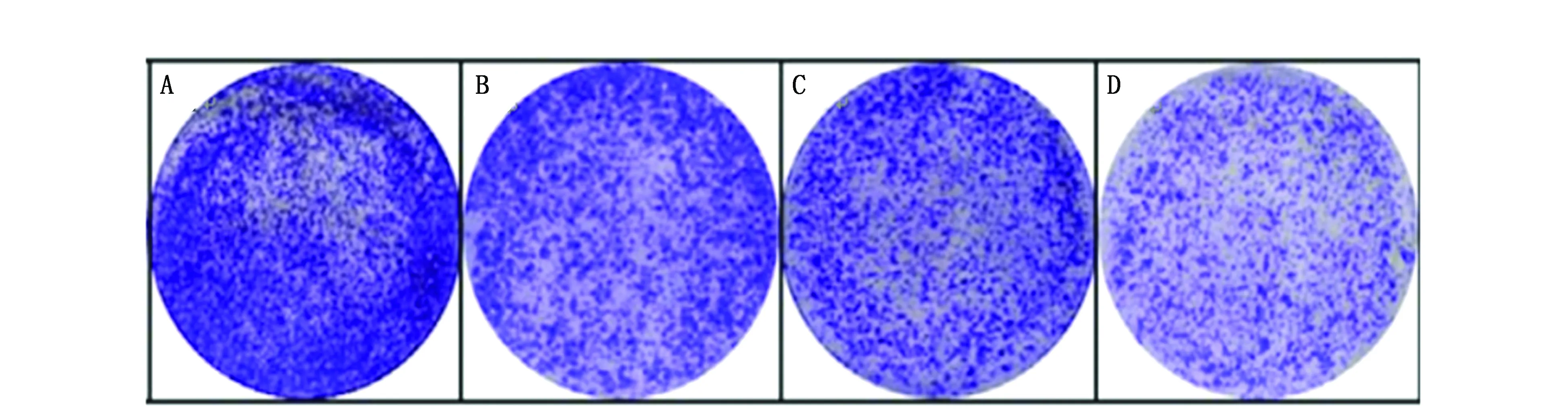
图3 各组HCC827细胞穿膜数的比较Figure 3 Comparison of the number of transmembrane HCC827 cells in each groupNote:A.HCC827 cell group;B.RI group;C.miR-616 inhibitor group;D.miR-616 inhibitor + RI group.
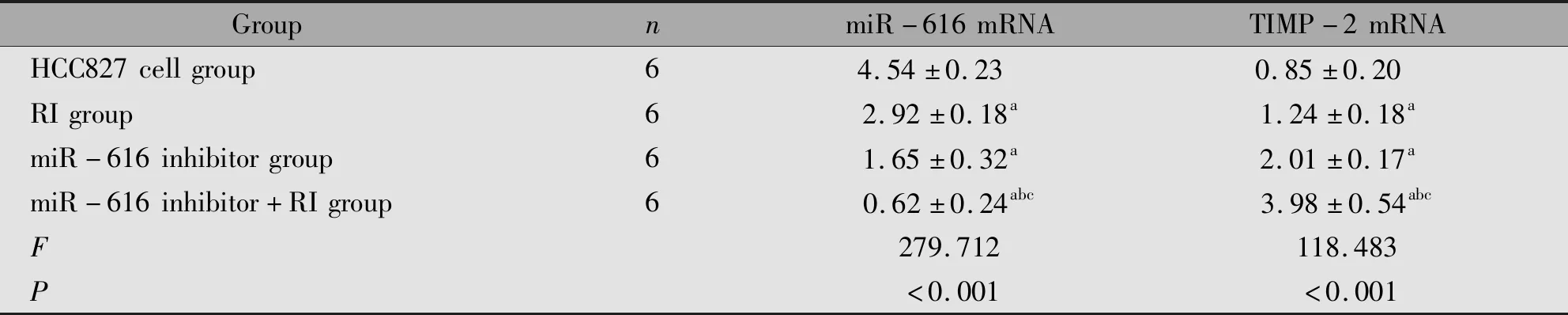
表6 各组HCC827细胞miR-616、TIMP-2 mRNA表达水平比较Table 6 The expression of miR-616 mRNA and TIMP2 mRNA in HCC827 cells
Note:aP<0.05,compared with the HCC827 cells group;bP<0.05,compared with the RI group;cP<0.05,compared with the miR-616 inhibitor group.
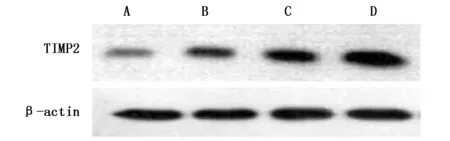
图4 各组HCC827细胞TIMP-2蛋白表达水平比较Figure 4 The expression of TIMP-2 protein in HCC827 cellsNote:A.HCC827 cell group;B.RI group;C.miR-616 inhibitor group;D.miR-616 inhibitor + RI group.

表8 miR-616与TIMP-2 mRNA和蛋白相关分析Table 8 The relationship between miR-616 and TIMP-2 genes
3 讨论
肺癌是常见类型的呼吸系统肿瘤,具有高度侵袭性。如今,放射治疗在很大程度上提高了肺癌患者的总体生存率,并被公认为是患者治疗的首选。阐明调节放射敏感性的潜在机制至关重要。miR-616已被定性为癌基因并在癌细胞转移中起关键作用。miR-616促进了乳腺癌的上皮-间充质转变和转移[11];miR-616有助于黏液腺癌的侵袭性表型。有充分证据表明下调miR-616并用作多种肿瘤中的肿瘤抑制因子,包括肺癌、胃癌、乳腺癌、胰腺癌、和肝细胞癌[12]。据报道,miR-616可作为食管癌、胃癌、乳腺癌的预后生物标志物。在膀胱癌细胞中经常观察到miR-616的高表达,而通过抑制剂降低miR-616的表达水平可诱导细胞周期停滞显著抑制癌细胞增殖[13]。本研究结果显示,与HCC827细胞组比较,RI组和miR-616 inhibitor+RI组OD值、存活率水平、克隆形成数目、穿膜数降低,与RI组比较,miR-616 inhibitor+RI组OD值、存活率水平、克隆形成数目、穿膜数降低。与HCC827细胞组比较,RI组和miR-616 inhibitor+RI组凋亡率、G1期升高,与RI组比较,miR-616 inhibitor+RI组凋亡率、G1期升高。同时说明miR-616的表达下调可以在体外增强肺癌细胞放射敏感性,进而增强辐射介导的活力抑制、细胞凋亡和生长停滞。
TIMP-2是金属肽酶(TIMPs)家族组织抑制剂的成员,可以降解细胞外基质(ECM)和基底膜(BM)[14]。METP2的降解是肿瘤转移的先决条件。TIMP-2也是含有亮氨酸-拉链结构域的CREB/ATF转录因子家族的成员。从涉及细胞发育、增殖到细胞对应激信号和DNA损伤的反应[15]。证据显示癌细胞中TIMP-2表达失调会导致癌细胞增殖。先前研究表明,TIMP-2通过降低存活率和DNA损伤来抑制肺癌细胞的顺铂和放射抗性[16]。研究表明,预后良好的患者放化疗后TIMP-2水平显著升高[17];miR-301a通过直接靶向多发性骨髓瘤中的TIMP-2促进细胞增殖;miR-19a通过调节TIMP-2表达与喉鳞状细胞癌的预后和凋亡相关[18]。PI3K/AKT信号传导途径与许多生理功能相关,包括细胞增殖、炎症和恶性转化。越来越多的证据表明miRNA可能影响PI3K/AKT信号通路。直接靶向和抑制该途径可能增加放射敏感性并减少癌细胞的迁移和侵袭。PI3K和AKT的磷酸化是PI3K/AKT信号通路的关键分子,通常可以提高放射后癌细胞的存活率。本研究中,与HCC827细胞组比较,RI组、miR-616 inhibitor+RI组miR-616 mRNA表达水平降低,与RI组比较,miR-616 inhibitor+RI组miR-616 mRNA表达水平降低。与HCC827细胞组比较,RI组、miR-616 inhibitor+RI组TIMP-2 mRNA表达水平升高,与RI组比较,miR-616 inhibitor+RI组TIMP-2 mRNA表达水平升高。转染miR-616 inhibitor后,肺癌细胞中TIMP-2 mRNA、蛋白水平表达增加,而给予放疗处理后,TIMP-2 mRNA、蛋白水平升高更为明显。这与上述讨论一致,同时说明靶向抑制miR-616可促进TIMP-2基因、蛋白的表达进而增强肺癌细胞放射敏感性。
综上所述,miR-616的表达下调可以在体外增强肺癌细胞放射敏感性,进而增强辐射介导的癌活力抑制、细胞凋亡和生长停滞,其机制可能与抑制miR-616可促进TIMP-2基因、蛋白的表达有关。

