PFKFB4对胃癌细胞侵袭和迁移能力的影响及其作用机制
王 鸣 孙梯业
胃癌是我国较常见的消化道恶性肿瘤之一[1],由于缺乏有效的治疗手段,严重威胁着患者的生命安全。据统计,世界范围内胃癌在恶性肿瘤中排名第五,但在癌症相关死亡中排名第三[2]。由于早期胃癌诊断率较低,许多患者就诊时已经是中晚期。目前手术结合化疗的传统治疗手段预后较差,因此,迫切需要发现适用于胃癌患者的分子诊断和治疗新靶标。
6-磷酸果糖-2-激酶/2,6-二磷果糖酸酶4(PFKFB4)催化合成2,6-二磷酸果糖,2,6-二磷酸果糖作为一种重要的磷酸糖代谢产物参与糖酵解途径。目前对于PFKFB4的研究更多侧重于其在肿瘤中通过调节糖代谢来控制肿瘤的生长[3]。近期在乳腺癌研究中,发现PFKFB4能够通过对SCR-3(Steroid receptor coactivator-3,又被称为NCOA3)的磷酸化提高SRC-3的转录活性,进而启动下游相关基因的表达,促进乳腺癌的恶化和转移[4]。有研究表明,在胃癌细胞中PFKFB4基因及蛋白的表达水平均明显升高。但目前对于其在胃癌中的作用研究仍然局限于低氧环境下的糖代谢过程[5]。本研究检测了胃癌细胞中能够与PFKFB4有相互作用的SRC家族(p160/Steroid receptor coactivator family)蛋白,利用转录组学寻找SRC蛋白的下游调控基因LKB1(Liver kinase B1,也被称为STK11),并进一步研究这一调控路径在胃癌转移及恶化中的功能,以期为胃癌的治疗提供新的分子靶标及理论依据。
1 材料与方法
1.1 细胞系
将冻存的人胃癌细胞系MNK45从液氮中取出,置于37℃水浴中迅速溶解,解冻后细胞离心去除冻存液。离心的细胞转移至装有10% FBS、青霉素(100 IU/mL)和链霉素(100 mg/mL)的RPMI 1640培养基的培养瓶中培养,置于37℃、5% CO2的培养箱中培养。
siSRC-2+S698WT 载体购自Origene,siSRC-2+S698A定点突变序列为:siSRC-2+S698A F:5′-GGACAGCaagTCCCCTGTGGA-3′,R:5′-CAGGGGActtGCTGTCCTGCA-3′,使用Hieff MutTMSite-Directed Mutagenesis Kit 定点突变试剂盒,将Ser698突变为Asp698。
本研究中所用引物序列分别为:
PFKFB4-F:5′-CGATACCTGAACTGGATTGGT-3′,PFKFB4-R:5′-GGCACACTGCTTCCTGATTT-3′;SRC-2-R:5′-GGACCTGGTAAGAAGGTGTATTCAG-3′,SRC-2-F:5′-TGCCTCTTAGCATAGGACACAGA-3′;LKB1-F,5′-GCCGGGACTGACGTGTAGA-3′,LKB1-R:5′-CCCAAAAGGAAGGGAAAAACC-3′;ACTB-F:5′-TGAGCGCGGCTACAGCTT-3′,ACTB-R:5′-TCCTTAATGTCACGCACGATTT-3′。 文中所用抗体除anti-pSRC-2(Ser469)、anti-pSRC-2(Ser487)和anti-pSRC-2(Ser493),所用肽段序列参照文献[7]自行制备外,其余抗体购自Thermo Fisher公司。
1.2 方法
1.2.1 蛋白免疫共沉淀 (0.5~1)×107个MNK45细胞用预冷的磷酸盐缓冲液(PBS)洗2次,0.25%胰酶消化后PBS再洗3次。加入1 mL含蛋白酶抑制剂和RIPA的裂解液,4℃放置45 min,12 000 rpm 4℃离心10 min,收集上清液,加入抗体,4℃孵育过夜;再与预处理后的Protein A琼脂糖珠在4℃条件下孵育过夜。孵育结束后,用IP裂解液清洗5~7次,最后用Western blot法分析结果。
1.2.2 细胞培养与转染 人胃癌细胞系MNK45待细胞达到80%~90%进行传代,取3-5代进行实验。使用Lipofectamine 2 000进行转染MNK45细胞,将序列(5′-CACTTGTATGGTCCTGT-3′)转染MNK45细胞获得siPFKFB4组细胞;将序列(5′-GGGCTGTTAACATTAGCAA-3′)转染MNK45细胞获得siSRC-2细胞组[3];将序列(5′-TTCTCCGAACGTGTCACGT-3′)转染MNK45细胞获得NC siRNA细胞组[6];将购自Origene的LKB1过表达载体转染MNK45细胞获得OE LKB1细胞组,转染后培养48 h和72 h取细胞进行试验。转染siSRC-2序列24 h后,将载体siSRC-2+S698WT和siSRC-2+S698A分别转染至siSRC-2组细胞,获得siSRC-2野生型互补siSRC-2+S698WT组细胞及siSRC-2Ser6987突变互补siSRC-2+S698A组细胞(Ser6987突变为Asp698)。
1.2.3 实验分组 实验分为6组:NC siRNA组(干扰对照组)、siPFKFB4组(PFKFB4干扰组)、siSRC-2组(SRC-2干扰组)、OE LKB1组(过表达LKB1组)、siSRC-2+S698WT组(野生型SRC-2互补组)及siSRC-2+S698A组(Ser698位点突变的SRC-2互补组)。
1.2.4 转录组学分析 用TRIzol提取siSRC-2组和NC siRNA组细胞的总RNA,利用Qubit 3.0进行RNA定量,Agilent 2100生物分析仪评估RNA提取质量,样品检验合格后测序,进行文库构建。获取原始序列后对比人类基因组序列进行MAP和比对,通过RPKM值估算基因表达量,获得两组细胞的差异表达基因。
1.2.5 qRT-PCR 检测PFKFB4、SRC-2和LKB1在MNK45细胞中的表达,采用TRIzol试剂提取总RNA,利用SuperScriptase II试剂盒反转录合成cDNA。qRT-PCR的步骤同文献所述[4]。通过实时检测PCR扩增,选择β-actin为内参基因,每个样品做三个重复,用2-ΔΔCt法对样本基因进行表达差异相对定量分析,在扩增的指数期起始模板进行定量。
1.2.6 蛋白免疫印迹 采用Western blot的方法检测MNK45细胞中PFKFB4、LKB1、SRC-2的蛋白量及SRC-2蛋白磷酸化程度。利用含蛋白酶抑制剂和RIPA的裂解液裂解细胞,在4℃下13 000 rpm离心12 min并收集上清液。利用BCA法进行蛋白定量,蛋白变性后上样,电泳分离使用湿转法转膜。室温5%~10%脱脂奶粉封闭后,在4℃分别与一抗孵育过夜,二抗室温孵育1.5 h,在膜上滴加ECL化学发光底物曝光,用红外成像检测蛋白印迹带,以β-actin为内参,用“Quantity one”对条带灰度值定量。抗体使用浓度分别为:anti-β-actin(1∶5 000),anti-PFKFB4(1∶1 000),anti-SRC-2(1∶2 000),anti-LKB1(1∶1 000),anti-pSRC-2(Ser736)(1∶800),anti-pSRC-2(Ser698)(1∶1 000),anti-pSRC-2(Ser469)(1∶500),anti-pSRC-2(Ser487)(1∶750),anti-pSRC-2(Ser493)(1∶500)。
1.2.7 细胞迁移实验 将Transwell培养池放入24孔板中,上室分别加入100 μL稀释好的NC siRNA组、siPFKFB4组、siSRC-2组及OE LKB1组对数生长期细胞悬液,上述处理后的4组细胞分别接种3~5个小室,下室加入含10% FBS的RPMI 1640培养基。培养24 h,取出培养池,倒去培养基,擦去下室内表面未穿膜的细胞,用甲醇固定15 min,加入染色液DAPI室温染色10 min,PBS洗涤3次,荧光显微镜拍照。
1.2.8 细胞侵袭实验 取上述处理后的4组细胞在60 μL的Matrigel加入300 μL无血清培养基中,4℃混匀,加至Transwell小室,在37℃培养箱中孵育4~5 h至培养基凝固,剩余步骤同迁移实验。
1.3 统计学分析
运用SPSS 19.0统计学软件分析,计量资料以均数±标准差表示,两组独立样本比较采用t检验,两组以上独立样本比较采用方差分析(ANOVA),组间比较采用LSD检验,P<0.05为差异有统计学意义。
2 结果
2.1 与PFKFB4有相互作用的SRC家族蛋白的检测
SRC家族包含三个成员,分别为SRC-1、SRC-2和SRC-3,本研究通过免疫共沉淀方法能够检测在胃癌细胞MNK45中与PFKFB4相互作用的SRC蛋白。结果显示只有SRC-2与PFKFB4有明显的相互作用(图1)。
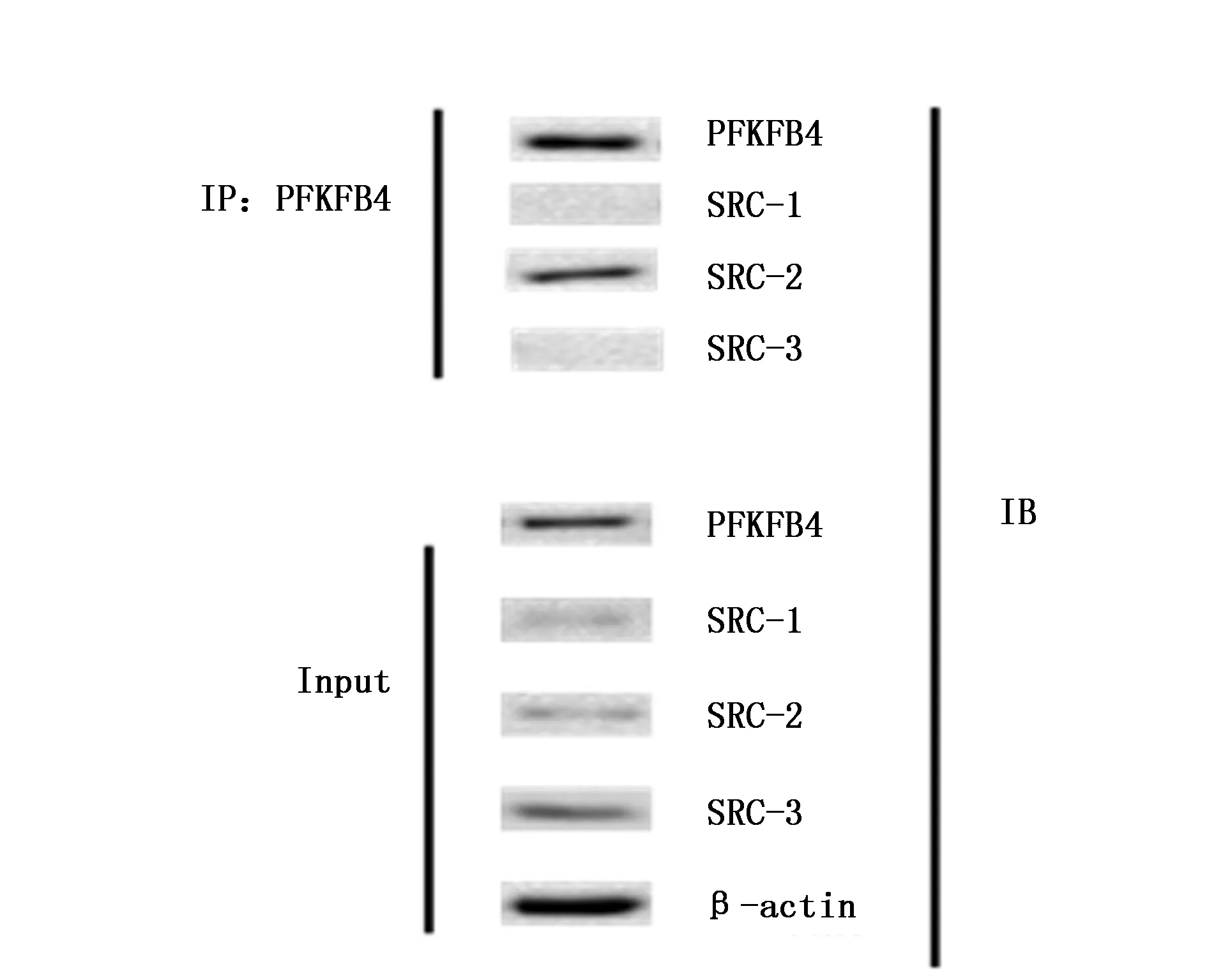
图1 CO-IP检测MNK45细胞中与PFKFB4有相互作用的SRC家族蛋白Figure 1 The SRCs protein interact with PFKFB4 in MNK45 cells by CO-IP
2.2 PFKFB4对SCR-2表达的影响
Western blot检测NC siRNA组和siPFKFB4组细胞中PFKFB4和SRC-2蛋白表达情况。统计学分析表明SRC-2蛋白(图2A)和mRNA(图2B)的表达量在两组细胞中没有统计学差异(P>0.05),说明下调PFKFB4并不影响SRC-2的表达。
2.3 PFKFB4磷酸化SRC-2的检测
有文献表明与转录有关的SRC-2磷酸化位点有Ser469、Ser487、Ser493、Ser698及Ser736[7-9],因此本研究分别用带有上述磷酸化位点的抗体检测PFKFB4对SRC-2的磷酸化作用,同时检测其磷酸化位点。结果显示尽管SRC-2的表达不受PFKFB4的影响,但PFKFB4能够磷酸化SRC-2的Ser698位点,Ser698的磷酸化程度随PFKFB4表达量降低而降低(图3)。
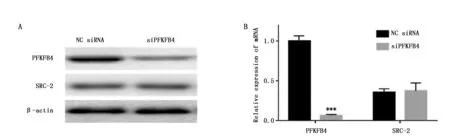
图2 PFKFB4对SRC-2表达的影响Figure 2 Effect of PFKFB4 on the expression of SRC-2 at levels of protein and mRNA in MNK45 cellsNote:***P<0.001,when compare with the NC siRNA group.
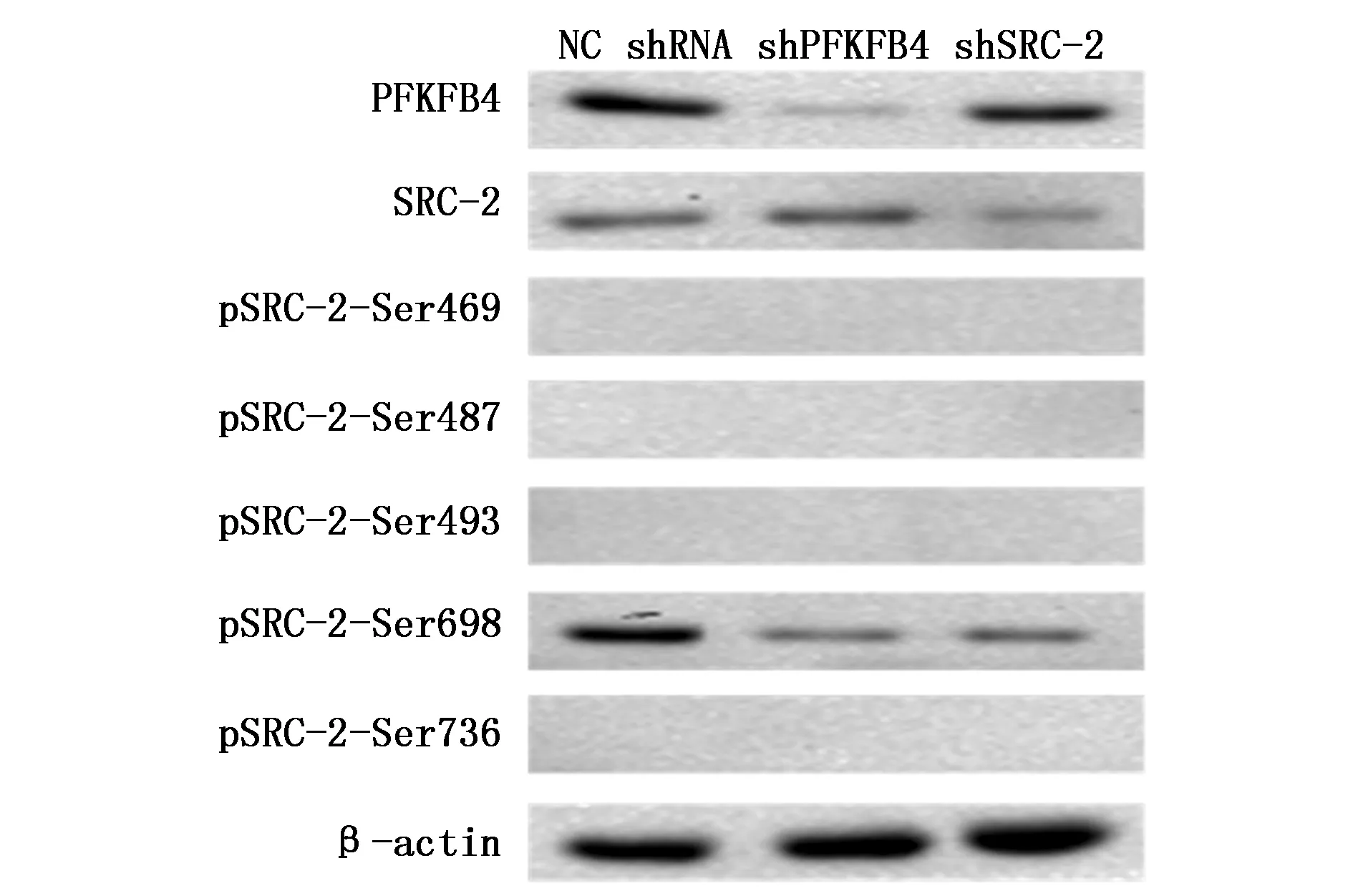
图3 PFKFB4对SRC-2的磷酸化作用及位点检测Figure 3 PFKFB4 was detected phosphorylated sites of SRC-2 in MNK45 cells
2.4 SRC-2磷酸化对LKB1基因表达的影响
利用转录组学分析NC siRNA组和siSRC-2组差异表达mRNA的情况,图4A展示了10个表达差异变化最大的基因,其中LKB1的表达水平在siSCR-2组变化最为明显。用qRT-PCR进行验证,发现LKB1的mRNA表达与转录组学结果一致且差异最为明显(图4B)。为检测是SRC-2表达量不同还是磷酸化差异对LKB1的表达产生了影响,本研究在siSRC-2组细胞中转入能表达野生型Ser698的siSRC-2+S698WT回补质粒和Ser698位点突变的siSRC-2+S698A质粒,并检测这两组细胞中LKB1蛋白和mRNA的表达,与NC siRNA组及siSRC-2组进行比较,发现只有siSRC-2+S698WT组细胞的LKB1才能恢复到NC siRNA的表达水平,而Ser698位点突变的siSRC-2+S698A组细胞中LKB1的表达显著高于NC siRNA,与siSRC-2组细胞持平(图4C、D)。
2.5 MNK45细胞迁移和侵袭能力检测
利用Transwell实验检测各组胃癌细胞MNK45的迁移和侵袭能力。与NC siRNA组相比,siPFKFB4组、siSRC-2组和OE LKB1组细胞的迁移和侵袭能力受到了显著的抑制(利用SLD方法进行组间分析,α=0.05)(图5)。
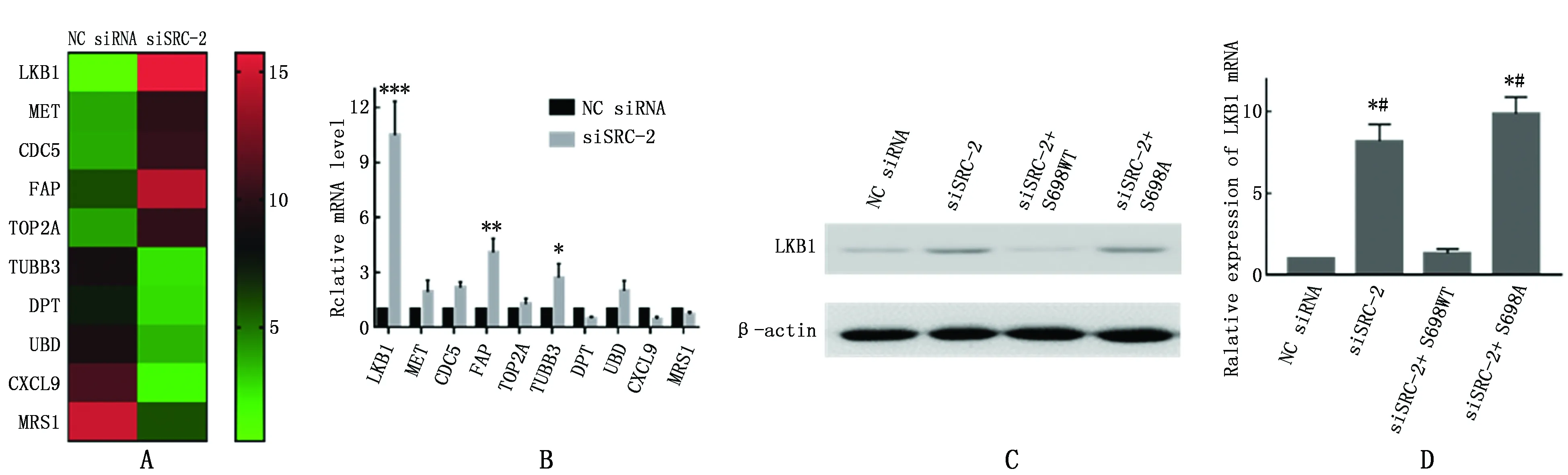
图4 SRC-2对LKB1表达的影响Figure 4 Effects of SRC-2 on the expression of LKB1 gene at levels of mRNA and proteinNote:*P<0.05,**P<0.01,when compared with the NC group.# P<0.05,when compared with siSRC-2 group.
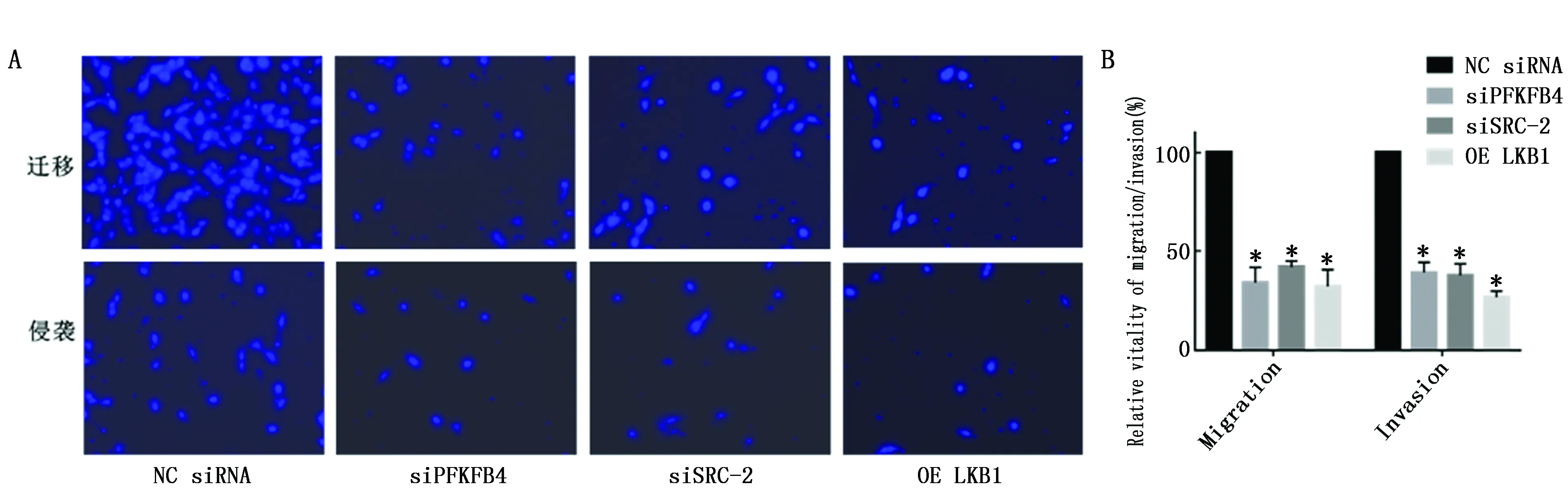
图5 Transwell实验检测MNK45细胞迁移和侵袭能力Figure 5 Effects of PFKFB4 on migration and invasion of MNK45 cellsNote:A.The cells of migration or invasion were observed under a fluorescence microscope;B.Statistical results of migration were analyzed in MNK45 cells.
3 讨论
PFKFB4基因编码6-磷酸果糖-2-激酶/2,6-二磷果糖酸酶4(6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase 4),能够催化合成2,6-二磷酸果糖,2,6-二磷酸果糖作为一种重要的磷酸糖代谢产物参与糖酵解途径。PFKFB4基因最初发现于人的睾丸中,在特定时间内参与精子的成熟过程[10-11],随后发现它在多个器官的正常组织中亦有表达[12-13]。2018年,Dasgupta等[4]发现在乳腺癌中,PFKFB4能够磷酸化SRC-3的S857位点,从而提高SRC-3的转录活性。由此我们认识到PFKFB4除作为关键成员参与肿瘤细胞的厌氧糖代谢外,还是一个重要的磷酸激酶,能够提高转录因子的活性,在癌细胞的转移和恶化过程中发挥作用。有研究表明,PFKFB4在胃癌细胞中高表达[3]。在胃癌细胞中阐明PFKFB4是否会发挥与其在乳腺癌细胞中类似的功能,激活SRC家族蛋白,从而促进胃癌的转移及恶化具有重要的意义。
SRC家族是第一个被鉴定的核受体辅激活子[14-17],有三个转录调控因子,分别为SRC-1(NCOA-1,RIP160[18]),SRC-2(NCOA-2,TIF-2,GRIP-1[19-20])和SRC-3(NCOA-3,AIB-1,TRAM-1,pCIP[21-23])。SRC能够通过二级协同蛋白增强下游靶基因的转录[18],SRC具有复杂的结构域,它们的功能通过被包括磷酸化在内转录后翻译所调节和扩展[24]。SRC-1参与胃癌细胞的迁移和侵袭的信号通路,且SRC-1低表达患者预后及五年生存期明显低于高表达患者[25],而SRC-3在多种癌症细胞中高表达,并促进肿瘤的发生、细胞增殖和转移[26]。SRC-2作为核受体的转录辅激活子,在不同的生理过程中发挥着多种作用,包括细胞生长、能量代谢、昼夜节律、进食行为和心脏功能[27-31]。有研究表明SRC-2是前列腺癌的关键致癌基因,在转移性前列腺肿瘤中,SRC-2基因的扩增、过表达和突变水平能够升高38%[32],且SRC-2的表达水平与前列腺肿瘤细胞增殖及疾病复发呈正相关[33]。在乳腺癌细胞中,SRC-2可以通过正向调控MAPK/ERK途径促进癌细胞的生长[6]。而SRC-2在胃癌中的作用以及其与PFKFB4的关系未见报道,在本研究中我们通过免疫共沉淀的方法确定在胃癌细胞中PFKFB4与SRC-2有相互作用,并进一步发现PFKFB4能够磷酸化SRC-2的Ser698位点。
为明确SRC-2磷酸化在胃癌细胞中的作用,本研究首先对siSRC-2组和NC siRNA组细胞进行了转录组测序。通过分析差异表达数据,发现下调SRC-2表达后,LKB1(Liver kinase B1,也被称为STK11)的mRNA表达显著上调。LKB1是肿瘤抑制因子,能够抑制多种肿瘤细胞的发展和进展[34]。为证实这一结果,利用Western blot和qRT-PCR检测了LKB1在siSRC-2组中蛋白和mRNA水平的变化,发现SRC-2表达降低后,LKB1的表达显著增加。为证实LKB1的表达与SRC-2 Ser698磷酸化的关系,将携带野生型SRC-2及Ser698位点突变的SRC-2 cDNA全长的质粒转染进siSRC-2组,得到siSRC-2+S698WT细胞组和siSRC-2+S698A细胞组,并检测LKB1在这些细胞中的表达,结果表明只有siSRC-2+S698WT组的LKB1表达量恢复到NC siRNA组的水平。
综上所述,在胃癌细胞MNK45中,PFKFB4能够磷酸化转录辅因子SRC-2的Ser698位点,从而提高SRC-2的转录活性,抑制抑癌基因LKB1的表达,从而保证胃癌细胞的增殖、迁移和侵袭。我们的研究表明,PFKFB4-SRC-2可能可以作为潜在的靶标,在胃癌的靶向治疗中发挥作用。

