跨膜型抗CD3单链抗体介导淋巴细胞体外特异性杀伤AFP阳性肝癌细胞活性观察
宋月雯,袁向飞,熊梦裳,林芳珍,卢杨,熊冬生,张砚君,范冬梅,张晴
1 中国医学科学院 北京协和医学院 血液病医院 血液学研究所,天津 300020;2 国家儿童医学中心 首都医科大学附属北京儿童医院 北京市儿科研究所
国内肝癌发病率高且普遍发现较晚,中晚期患者居多。肝癌最主要的根治性手段是肝切除术和肝移植术,但肝源匮缺是世界性难题,很多患者在等待肝源期间病情加重;此外,由于大部分肝癌患者对放化疗不敏感,预后差且易复发[1]。肿瘤细胞抗原表达水平较低或表达缺陷时,主要组织相容性抗原(MHC)表达不足,不能被细胞毒性T细胞(CTL)识别并攻击[2];而表面表达CD3单链抗体(CD3scfv)分子的细胞可绕过MHC的限制,直接激活淋巴细胞[3]。活化的淋巴细胞不仅对修饰后的肿瘤细胞起杀伤作用,对于未修饰肿瘤细胞也具有一定的细胞毒作用[4,5]。这提示我们可将CD3scfv分子修饰于免疫原性较弱的肿瘤细胞膜表面,绕过抗原表达及MHC分子限制等抗原局限问题,激活淋巴细胞进而达到治疗目的。本实验室在前期研究中成功构建人AFP启动子(hAFPp)操控的跨膜型抗CD3单链抗体(antiCD3scfv),并在AFP阳性(AFP+)肝癌细胞中特异性表达[6]。2018年8月~2019年7月,基于以上理论及研究基础,本文将针对antiCD3scfv分子体外活性进行研究,为肝癌免疫治疗提供新思路。
1 材料与方法
1.1 材料 AFP+人肝癌细胞HepG2、Huh-7和AFP阴性(AFP-)正常人肝细胞HL-7702、人乳腺癌细胞MCF-7均购自美国模式培养物集存库(ATCC),由本实验室冻存。正常人外周血单个核细胞(PBMC)分离自正常人富含血小板白膜,经科研用血审批购自天津市血液中心,培养于含10%胎牛血清(FBS)的RPMI1640培养基,加入100 U/mL人IL-2刺激细胞生长。所有细胞置于37 ℃ 5% CO2培养箱内常规培养,DMEM培养基、RPMI1640培养基、FBS均购自GIBCO公司。AdCD3scfv及空载AdTrack腺病毒为本实验室前期构建并鉴定。CytoToX96非放射性细胞毒检测试剂购自Promega公司,FITC直标抗CD69、抗CD25单克隆抗体购自BD公司,免疫细胞因子IL-2、TNF-α、IFN-γ检测试剂盒均购自eBioscience公司。活细胞工作站购自Nikon公司,倒置显微镜购自Olympus公司。
1.2 实验方法
1.2.1 AdCD3scfv修饰的HepG2靶细胞与PBMC结合情况观察 取对数生长期HepG2细胞,分别感染AdCD3scfv、AdTrack腺病毒(100 MOI)。将感染后的细胞接种至24孔培养板,每种细胞各接种2孔,共4孔。次日,按效靶比10∶1,向上述4孔各加5×105个PBMC(100 μL);同时各向每种细胞的其中一孔加入可溶性anti-CD3单克隆抗体25 ng/mL,另一孔加等体积PBS。静置3 h后,移除未结合的游离PBMC。每孔各加入100 μL PBS,于显微镜目镜(40×)下观察并拍照。
1.2.2 AdCD3scfv修饰的HepG2靶细胞与PBMC相互作用观察 采用活细胞工作站动态观察。取分别感染AdCD3scfv和AdTrack腺病毒的HepG2,接种至24孔培养板。次日,按效靶比10∶1向孔内各加入5×105个PBMC(100 μL),用水平离心机1 000 r/min离心1 min,使PBMC快速沉于孔底。将24孔板实验孔及对照孔置于活细胞工作站下,于488 nm通道及白光通道分别辨别靶细胞(GFP标记)及效应T细胞;选取合适的视野,动态观察效靶细胞的相互作用。
1.2.3 AdCD3scfv介导的淋巴细胞毒性作用观察 采用细胞介导的细胞毒性试验(LDH法)。取对数生长期的HepG2、Huh-7、HL-7702和MCF-7细胞,分别以AdCD3scfv(100 MOI)、AdTrack(100 MOI)及PBS感染各种靶细胞48 h。消化收集各组靶细胞,调整细胞密度为1×105/mL,按照分析板设置铺于相应96孔培养板内。以不同的效靶比,将PBMC细胞悬液加于相应孔内(200 μL/孔),其中靶细胞最大释放、靶细胞自发释放、培养基背景对照、培养基体积对照孔只加100 μL含10% FBS的RPMI1640培养基。按照Promega CytoToX96非放射性细胞毒检测试剂盒说明书操作,1 h内于490 nm处测吸光度值,计算细胞死亡率。细胞死亡率=(实验孔-靶细胞自发释放-效应细胞自发释放)吸光度值/(靶细胞最大释放-靶细胞自发释放)吸光度值×100%。
1.2.4 AdCD3scfv介导的PBMC活化情况观察 采用流式细胞术检测共培养体系中PBMC表面活化标志CD69及CD25。细胞类型及感染同1.2.3,感染48 h后铺96孔培养板,以10∶1加入PBMC(200 μL)共培养24 h。收集PBMC并转移至流式管,每种靶细胞均分为两2管;PBS洗2次,加入100 μL PBS重悬细胞。分别加入5 μL FITC直标CD69和FITC直标CD25流式抗体,每管平行设同型对照管,避光室温孵育30 min。PBS洗3次,孔径50 μm尼龙网过滤;上流式细胞仪检测,用FlowJo 7.6软件分析CD69及CD25阳性T细胞比例。
1.2.5 AdCD3scfv介导的免疫细胞因子IL-2、TNF-α、IFN-γ检测 采用ELISA法。细胞感染、铺板同1.2.4;与PBMC共培养24 h后,以250 g离心5 min,收集各孔上清,检测IL-2、TNF-α、IFN-γ。

2 结果
2.1 AdCD3scfv修饰的HepG2靶细胞与PBMC结合情况 感染AdCD3scfv的HepG2细胞表面表达antiCD3scfv分子并与PBMC表面CD3分子结合,使PBMC聚集于HepG2细胞周围;加入可溶性anti-CD3单克隆抗体后,与HepG2细胞膜表面修饰的antiCD3scfv分子竞争,PBMC聚集仅少量减少。加入anti-CD3单克隆抗体前后,感染AdTrack的HepG2细胞均不与PBMC结合。见图1。

注:souble mAb为可溶性anti-CD3抗体。
图1 AdCD3scfv修饰的HepG2靶细胞与PBMC结合情况。
2.2 AdCD3scfv修饰的HepG2靶细胞与PBMC相互作用 共培养3 h后,PBMC开始向HepG2周围聚集;共培养6 h后,部分HepG2细胞从视野消失;共培养15 h后,几乎所有靶细胞都因细胞毒作用漂起或消失。见图2。
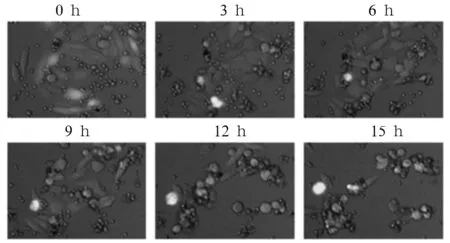
注:绿色荧光为AdCD3scfv修饰的HepG2细胞(靶细胞),白光为PBMC(效应细胞)。
图2 AdCD3scfv修饰的HepG2靶细胞与PBMC相互作用
2.3 PBMC对不同靶细胞的杀伤水平比较 与PBMC共培养12 h,感染AdCD3scfv病毒的AFP+细胞死亡率较感染AdTrack、PBS者增加(P均<0.05);且随着效靶比增加,死亡率也不断增强;当效靶比增加至10∶1时,HepG2、Huh-7细胞死亡率分别达到78.59%±7.50%、63.26%±6.21%;感染AdTrack、PBS的各类细胞死亡率均无明显变化,且PBMC对AFP-细胞的杀伤作用极为有限。见图3。

注:Blank是指感染病毒时仅加PBS,不加病毒;与感染AdTrack、PBS的同类细胞比较,*P<0.05。
图3 不同效靶比例下PBMC对不同靶细胞的杀伤作用比较
2.4 效靶细胞共培养体系中PBMC活化表面标志分子CD69及CD25表达比较 PBMC与不同靶细胞以效靶比10∶1共培养24 h,感染AdCD3scfv的AFP+细胞HepG2、Huh-7中CD69、CD25表达增加(P均<0.05),感染AdTrack、PBS的各类细胞CD69及CD25表达无明显变化。见图4。

注:Blank是指感染病毒时仅加PBS,不加病毒;与感染AdTrack、PBS的同类细胞比较,*P<0.05。
图4 效靶细胞共培养体系中PBMC表面活化标志CD69及CD25的表达水平
2.5 效靶细胞共培养体系中PBMC细胞因子分泌水平比较 PBMC与不同靶细胞以效靶比10∶1共培养24 h,感染AdCD3scfv的AFP+细胞HepG2、Huh-7上清液IL-2、IFN-γ、TNF-α水平增加(P均<0.05),而感染AdTrack、PBS的各类细胞IL-2、IFN-γ、TNF-α无明显变化。见图5。

注:Blank是指感染病毒时仅加PBS,不加病毒;与感染AdTrack、PBS的同类细胞比较,*P<0.05。
图5 效靶细胞共培养体系中PBMC细胞因子分泌水平比较
3 讨论
肝癌是第六位常见的恶性肿瘤,全球范围内每年新确诊病例约85万人[7],且有逐年递增的趋势。目前,首选治疗方案为肝切除术,术后5年生存率可达29%~81%,但复发率仍有51%~69%[8]。肝移植为肝癌根治手段之一,存在肝源缺乏的世界性难题,且其术后复发风险不容忽视。近年来,针对肝癌的分子靶向药、PD-1抑制剂及其他多种靶向治疗研究倍受瞩目,但疗效都十分有限[9,10]。索拉非尼是FDA惟一批准的用于治疗肝癌的分子靶向药[11],但患者的预后仍然很差,反应率低于5%,总体生存仅延长约2.5个月[12]。除此之外,尚无确定有效的二线药物。因此,开发针对肝癌这种恶性肿瘤的新疗法具有非常重要的临床意义,迫切需要寻找到一种有效杀伤肝肿瘤细胞的免疫治疗方法。
癌症免疫治疗的核心是肿瘤抗原,近年来利用人体适应性免疫系统,针对肿瘤抗原出现了过继疗法、肿瘤疫苗、抗体药物等治疗手段,但由于诸多因素,免疫治疗在实体瘤中未达到理想效果[13]。已有研究表明,当活化的淋巴细胞与靶细胞紧密接触时,可实现CTL介导的细胞毒作用[4]。抗CD3单克隆抗体(anti-CD3 mAb)可通过Fc段桥联与Fc受体阳性肿瘤细胞紧密结合,同时激活T细胞,实现裂解靶细胞的功能,但该方法仅适用于Fc受体表达阳性的肿瘤细胞[14]。此外,有学者设计antiCD3scfv使其在肿瘤细胞膜表面稳定表达,可实现CTL对肿瘤细胞的杀伤作用[5,15]。这种免疫细胞的激活是抗体直接作用于T细胞表面CD3分子,并向下游传递活化信号的结果。
在前期的研究中,我们成功将antiCD3scfv基因构建于Ad-5腺病毒载体中,并通过hAFPp启动子限制其只在AFP+肝癌细胞膜表面表达,为治疗系统提供靶向性,减少对正常细胞的伤害[6]。接下来为证实antiCD3scfv分子的活性,我们将转染AdCD3scfv病毒的靶细胞与淋巴细胞共培养。在活细胞工作站观察到,淋巴细胞在3 h内与靶细胞结合,并在15 h内将视野内靶细胞全部裂解。加入商品化可溶性anti-CD3单克隆抗体后,感染AdCD3scfv的细胞仅有部分PBMC聚集减少。这说明表达于细胞表面的antiCD3scfv分子具有更强的结合能力,可以将靶细胞与PBMC更紧密地连接,使后者活化并发挥细胞毒杀伤作用。随后,我们用LDH法检测细胞毒水平,发现淋巴细胞仅对表达antiCD3scfv分子的靶细胞表现杀伤作用,且随着效靶比升高杀伤作用也越强。在效靶细胞共培养体系中,表达antiCD3scfv分子的AFP+靶细胞能活化效应细胞,且其共培养上清中细胞因子IL-2、IFN-γ及TNF-α的分泌水平升高。以上研究结果均表明,antiCD3scfv蛋白具有一定的生物学功能:具有桥连作用,可直接将淋巴细胞与靶细胞紧密接触;能激活淋巴细胞发挥细胞毒作用,高效杀伤肿瘤细胞;并且,再次证明hAFP启动子调控antiCD3scfv分子的转录,使上述作用具有AFP肝癌特异性。
综上所述,本研究通过腺病毒实现在肝癌细胞表面修饰antiCD3scfv分子,可绕过表面抗原表达及MHC分子限制等局限问题,直接激活淋巴细胞,为实体瘤的免疫治疗提供新思路。

