外源L-天冬氨酸纳米钙抑制棉花生长的效应及潜在机制
刘亚林,闫 磊,曾 钰,贾志贤,姜存仓
(华中农业大学微量元素研究中心,资源与环境学院,武汉 430070)
由于纳米材料具有比一般材料更加独特、优异的磁、光、电、声、热、力及化学特性,而被广泛应用在工业、农业、医药等产业领域[1]。在使用过程中,不可避免地有一部分纳米颗粒(Nanoparticles,NPs)会随工业废弃物和废水排放到环境当中[2],对环境造成一定的影响。随着纳米技术的快速发展,为了应对纳米材料对环境的危害,纳米材料的毒性评价受到越来越多的关注。
研究表明,大多数金属NPs如纳米氧化锌(ZnONPs)、纳米氧化钛(TiO2-NPs)、纳米银(Ag-NPs)、纳米氧化铜(CuO-NPs)等都会改变植物的生长状态,对植物生长产生影响。对耐铜型海洲香薷的研究表明,CuO-NPs处理显著抑制了植株根系伸长,使生物量下降[3]。但高浓度CuO-NPs(<50 nm)对拟南芥种子的发芽率并未产生影响[4]。Ag-NPs对黄菖蒲的早期生长阶段进行处理后发现,其在培养后期能显著降低黄菖蒲生长速率[5],同时其也抑制了拟南芥根系的伸长和叶片的膨大[6]。ZnO-NPs处理显著抑制了黑麦草的苗期生长,对其产生毒害作用[7]。TiO2-NPs处理会使玉米根细胞壁孔径减小,水势减弱,生长速率受抑[8]。但也有研究表明,添加TiO2-NPs溶液能够提高叶绿素含量,并促进黄瓜对P、K养分的吸收和根系生长[9]。Ag-NPs能显著抑制拟南芥的生长,降低其光合作用并引起DNA损伤[10],这种现象在一年或多年生黑麦草的研究中也被发现,CuO-NPs能引起黑麦草基因突变和氧化修饰[11],并导致活性氧(ROS)含量升高,产生氧化胁迫[12]。植物自身会产生一系列的调节机制,大量的ROS会被SOD、POD等抗氧化酶所清除[13],同时植物本身也会调控叶片光合色素含量以适应这种胁迫[14]。但也有研究表明,利用纳米材料开发的纳米肥料可控制释放调节植物生长和增强靶标活性。
作为新型钙制剂,L-天冬氨酸纳米钙[Calcium L-aspartate nanoparticles,Ca(L-asp)-NPs]结构稳定、水溶性好、人体吸收率高,是具有生物活性的有机酸钙,其作为人体钙营养强化剂已被广泛应用[15],但其进入环境后的风险性评价鲜有报道。本文以南方常见经济作物棉花为试验材料,设置不同浓度的Ca(L-asp)-NPs处理,测定植株干鲜质量、根系形态、元素含量、叶绿素、抗氧化酶、MDA、电导率等指标,以期为深入揭示Ca(L-asp)-NPs纳米颗粒对植物的毒性效应及对环境的影响机理提供理论依据。
1 材料与方法
1.1 试验材料和设计
试验材料为华中农业大学棉花遗传育种研究室提供的鄂抗8号棉花种子,种子用浓硫酸(98%)脱绒露出黑色的种壳后随即用清水洗净残留的硫酸,然后将种子放入36℃烘箱中烘干48 h以破除种子休眠。破除休眠的种子,用60℃的温开水浸泡6 h至种皮发软,将浸泡好的种子置于纱布上,再用两层纱布覆盖,转入30℃培养箱暗中催芽48 h,此过程中不定期浇水以保持种子湿润。发芽后的种子转入光照培养箱(温度:白天30℃/黑夜18℃,光强:10 000 lx)进行培养,待长出两片真叶后,在4月22日将其移到5 L的黑色塑料桶中进行全营养液培养,每桶移栽两株。营养液配制参考阿夫多宁和Arnon的配方并略有改 动[16]:0.240 g·L-1NH4NO3,0.100 g·L-1Na2HPO4·12H2O,0.100 g·L-1NaH2PO4·2H2O,2 mg·L-1KCl,0.360 g·L-1CaCl2·2H2O,0.500 g·L-1MgSO4·7H2O,0.22 mg·L-1ZnSO4·7H2O,1.81 mg·L-1MnCl2·4H2O,0.09 mg·L-1(NH4)6Mo7O24·4H2O,1.2 mg·L-1H3BO3,0.08 mg·L-1CuSO4·5H2O,48.5 mg·L-1EDTA-Fe。
1.2 测定项目及方法
1.2.1 生长指标和生物量的测定
植株收获时,每个处理随机选取3株棉花,用直尺测量整株植株的高度和主根长度,取其平均值作为测量值。用Epson Perfection V700型根系分析仪对根系形态进行扫描,利用WinRHIZO根系分析系统分析植株总根长(Total length,TL)、根表面积(Total sur⁃face area,TSA)、根总体积(Total root volume,TRV)、根平均直径(Average diameter,AD)和根尖数(Forks,F)等根系形态指标。样品收获后用超纯水冲洗干净,将植株分为根、茎和叶3部分,分别测定各部位的鲜质量,然后将样品放于105℃烘箱中杀青30 min,然后在70℃下烘干至恒质量,称量干质量[17]。
1.2.2 钙含量的测定
棉花根、茎、叶片的钙含量用干灰化-原子吸收分光光度法测定[18]。即将烘干称质量的样品磨碎过筛,取0.1 g样品放置于坩埚中,用电炉碳化后转入马弗炉在500℃条件下干灰化4 h后移出,用0.1 mol·L-1的HCl溶解稀释后用原子吸收光谱仪测量钙含量。钙的转移因子(TF)按照下列公式计算:
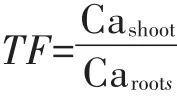
式中:Cashoot代表地上部钙含量;Caroots代表根部钙含量。
1.2.3 叶绿素含量的测定
称取0.2 g新鲜叶片,去中脉后剪碎放在50 mL比色管中,加入25 mL 95%的乙醇,封口后黑暗中放置24 h,摇匀,以95%的乙醇为空白测量665、649、470 nm处的吸光度,色素浓度(mg·L-1)按照下式计算[19]:
土地经过整理后,郭书凤种上了大白桃品种桃树,还在稍微差些的地里种上了核桃和麦黄杏等。机遇是给有准备的人的,郭书凤就这几块零零碎碎的加起来二亩地的果园,经过精心管理,很快就要开始有收益了。
(1)叶绿素a Chl a=13.95A665-6.88A649
(2)叶绿素b Chl b=24.96A649-7.32A665
(3)类胡萝卜素

1.2.4 根系抗氧化酶活性、MDA含量、电导率的测定
取0.5 g新鲜根,加入5 mL 50 mmol·L-1磷酸缓冲液(PBS,pH=7.8),在预冷的研钵上磨碎后转入10 mL离心管中离心成匀浆(20 min,4℃,10 000×g),收集上清液作为酶提取物。超氧化物歧化酶(SOD,EC 1.15.1.1)采用氮蓝四唑光还原法测定,过氧化物酶活性(POD,EC 1.11.1.7)采用愈创木酚氧化法测定,抗坏血酸过氧化物酶活性(APX,EC 1.11.1.11)和过氧化氢酶活性(CAT,EC 1.11.1.6)以及MDA含量在用分光光度计(UV-1800,Mapada)测量不同吸光度下的光密度(OD)后计算求得,电导率由电导仪测定并计算求得[19]。
1.3 数据分析
采用Excel 2010进行数据处理,Duncan新复极差法进行单因素方差分析及显著性检验(ANOVA,SPSS Statistics 20.0),Origin 8.6pro作图。
2 结果与分析
2.1 不同浓度Ca(L-asp)-NPs对棉花生长的影响
不同浓度外源Ca(L-asp)-NPs对棉花的生长均产生抑制作用,且随其浓度的增加,抑制作用显著增强(图1A)。与对照相比,棉花株高在外源添加25 mg·L-1Ca(L-asp)-NPs时便开始出现显著下降,株高减少约 14%,50、75、100 mg·L-1处理时,下降率为37%、30%、35%,均达显著水平,但此3个处理之间无明显差异(图1B)。主根根长在50 mg·L-1处理以后开始出现显著差异,在50、75、100 mg·L-1处理时,根长减少了27%、34%、33%(图1C),说明正常生长的棉花植株在外源添加Ca(L-asp)-NPs后,其地上部和地下部生长会受到显著的抑制作用。
2.2 不同浓度Ca(L-asp)-NPs对棉花植株生物量的影响
对棉花植株的干鲜质量进行分析发现,Ca(L-asp)-NPs浓度不同时,植株根、茎、叶的干鲜质量差异显著(表1)。根系鲜质量最大出现在75 mg·L-1处理,最大干质量出现在25 mg·L-1处理。随着Ca(L-asp)-NPs浓度的增加,茎的干鲜质量显著下降,且在100 mg·L-1时达到最小值,此时与对照相比干鲜质量分别减少66%和63%。叶的干鲜质量最小值也出现在100 mg·L-1,与对照相比分别减少52%和50%。但施入Ca(L-asp)-NPs后,植株的根冠比增大,这可能是由于棉花对Ca(L-asp)-NPs毒害所作出的适应性改变。
2.3 不同浓度Ca(L-asp)-NPs对棉花钙含量及其转运的影响
如图2所示,随着外源Ca(L-asp)-NPs的施入,棉花植株根、茎、叶的钙含量呈显著先增加后减少的趋势。根钙含量和叶钙含量最高出现在75 mg·L-1处理,分别为7905 mg·kg-1和38 117 mg·kg-1,比对照增加102%和51%,达到显著差异水平,但施入量超过75 mg·L-1时,钙在根和叶中的含量呈现下降趋势。茎钙含量最大出现在50 mg·L-1处理时,为13 144 mg·kg-1,比对照增加61%,此后钙含量也呈下降趋势。对钙的转移因子进行计算发现,与对照相比,钙的转移因子在Ca(L-asp)-NPs施入后显著下降,其最小值出现在50 mg·L-1处理时,为6,这说明施入Ca(L-asp)-NPs严重抑制了钙向地上部的转移。
2.4 不同浓度Ca(L-asp)-NPs对光合色素含量的影响
如图3所示,与对照相比,添加25 mg·L-1Ca(L-asp)-NPs对Chl a、Chl b的含量无显著影响,但显著提高了Car的含量。添加量超过25 mg·L-1时,Chl a、Chl b的含量显著下降,而Car的含量与对照相比无显著差异。Chl a/b的值在添加外源Ca(L-asp)-NPs时有明显提升,这说明外源添加Ca(L-asp)-NPs对棉花光合色素的影响较大。
2.5 不同浓度Ca(L-asp)-NPs对根系形态指标的影响
TL、TSA、AD、TRV、F是用来评价根系生长状况的良好指标,对这些指标分析发现,外源施入Ca(L-asp)-NPs严重抑制了根系的生长(表2)。与对照相比,TL、TSA、TRV、F的值显著减小,且都在施入100 mg·L-1Ca(L-asp)-NPs时达到最小值,下降率为71%、68%、62%、81%,而AD的值在显著增大,在施入100 mg·L-1Ca(L-asp)-NPs时达到最大,为对照的120%。
2.6 不同浓度Ca(L-asp)-NPs对根系抗氧化酶活性的影响
由图4可知,根系SOD、POD、APX、CAT活性在外源输入Ca(L-asp)-NPs后显著下降,SOD、POD、APX活性在100 mg·L-1处理时活性最低,而CAT活性最低出现在50 mg·L-1处理。4种抗氧化酶的活性都随着外源Ca(L-asp)-NPs的施入而呈现减弱的趋势,但在施入 50、75、100 mg·L-1Ca(L-asp)-NPs时,POD、APX、CAT的活性未出现显著变化。
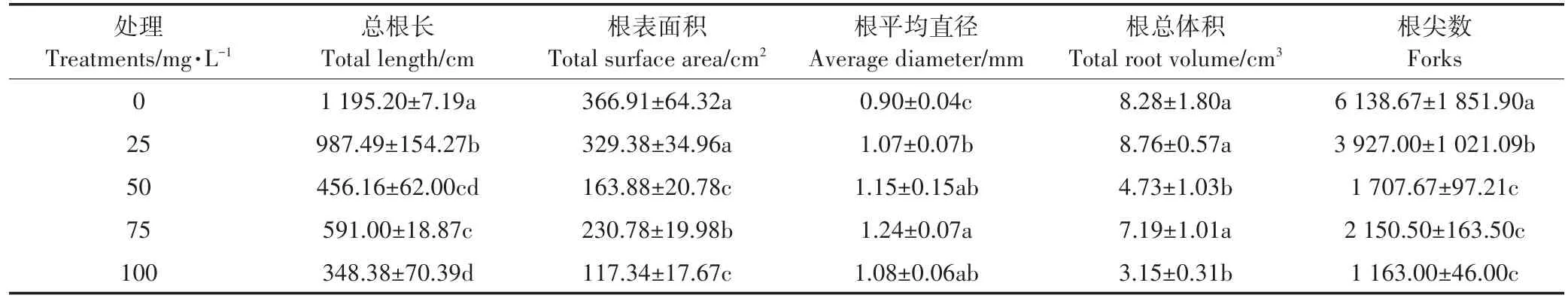
表2 不同浓度Ca(L-asp)-NPs对根系形态指标的影响Table 2 Effects of different concentrations of Ca(L-asp)-NPs on root morphological parameters

图2 不同浓度Ca(L-asp)-NPs对棉花钙积累及转运的影响Figure 2 Effects of different concentrations of Ca(L-asp)-NPs on Ca accumulation and transport in cotton

图3 不同浓度Ca(L-asp)-NPs对叶绿素a、叶绿素b、类胡萝卜素含量及叶绿素a/b的影响Figure 3 Effects of different concentrations of Ca(L-asp)-NPs on chlorophyll a,chlorophyll b,caroteneoid content and chlorophyll a/b
2.7 不同浓度Ca(L-asp)-NPs对根系MDA含量及电导率的影响
MDA含量常用来表示质膜的过氧化程度。如图5所示,添加25 mg·L-1Ca(L-asp)-NPs时,棉花根系MDA含量与对照相比显著增高,而超过25 mg·L-1时,则显著降低,说明外源Ca(L-asp)-NPs施入量达到一定值时,会显著降低质膜过氧化程度。对根系电导率的测定也更加验证了这个结果。
3 讨论
NPs进入环境被植物吸收后会对植物产生一系列的作用,根系是吸收NPs的第一器官。我们对棉花的试验也发现,作为纳米材料的Ca(L-asp)-NPs被施入后,显著抑制了棉花生长,造成其株高和根长随着浓度的增加而减小,并因此导致植株生物量下降,但在施入75 mg·L-1Ca(L-asp)-NPs时,根鲜质量出现最大值,这可能与此时Ca(L-asp)-NPs的浓度、形状和粒径有关[20],还有待进一步探究。

图4 不同浓度Ca(L-asp)-NPs对根系抗氧化酶活性的影响Figure 4 Effectsof different concentrations of Ca(L-asp)-NPs on root antioxidant enzyme activities
植物的根冠是一个动态平衡系统,依赖与竞争并存,良好的根冠比能够使植物更好地利用水分和营养,促进自身生长[21]。本研究表明,棉花的根冠比、AD在施入Ca(L-asp)-NPs后显著增加,而TL、TSA、TRV、F等根系形态指标显著减少,这可能是根系的适应性反应。同时根系是植物吸收和转运营养的主要部位,Ca(L-asp)-NPs处理后,植物根、茎、叶中的钙含量都随着处理浓度的增加呈先增加后减少的趋势,说明一定浓度的Ca(L-asp)-NPs处理会增加棉花植株对钙的吸收,但超过一定浓度后,即会抑制植物对钙的吸收,这与氧化铈纳米颗粒(CeO2-NPs)施入土壤后根部铈含量的吸收情况相同[22],而与对CuO-NPs的研究不同,其研究表明根、茎、叶中的铜浓度随着CuO-NPs浓度的升高而升高[3],这可能是由于不同纳米颗粒其本身性质不同造成的。钙的转移因子(TF)定义为根冠钙含量比[23]。研究表明,纳米颗粒如CeO2-NPs、ZnONPs等处理会使植物的元素TF显著降低[7,22],本试验结果也与此相同,这可能是由于大部分NPs吸附在根表或Ca(L-asp)-NPs较Ca2+更难运输到地上部相应部位所导致的[7]。

图5 不同浓度Ca(L-asp)-NPs对根系MDA含量及电导率的影响Figure 5 Effects of different concentrations of Ca(L-asp)-NPs on MDA content and conductivity
叶绿素含量的高低能反映植物光合作用的强弱,而Chl a/b的高低能反映植物对光能吸收的强弱,其值越高,越不利于吸收光能[24]。本试验表明,Ca(L-asp)-NPs处理后,Chl a和Chl b含量显著下降,Chl a/b的比值升高,抑制了棉花的光合作用,从而抑制了其地上部的生长。大多数试验证明,外源钙的添加能够减缓植物所遭受的逆境胁迫并提高叶绿素的含量[25-26]。但是对于NPs而言,Shi等[3]用CuO-NPs处理耐铜型海洲香薷后发现,随着CuO-NPs浓度升高,叶绿素含量显著降低。张传玲等[27]研究发现,Ag-NPs处理拟南芥后能显著减少叶绿素含量,降低其光合作用。本试验结果也表明,Ca(L-asp)-NPs对植物生长的影响不仅是由其在溶液中析出的Ca所决定,很大一部分是与其NPs的性质有关[3]。
抗氧化酶SOD、POD、APX、CAT是植物体内产生的抵抗外界胁迫的防御酶[28]。研究表明,Fe2O3-NPs、CuO-NPs等NPs处理植物后会通过显著升高抗氧化酶活性清除产生的ROS等有害物质,进而维持植株的正常生长[29-30]。本试验研究发现,随着Ca(L-asp)-NPs浓度的增加,根系4种抗氧化酶活性显著降低,使质膜的过氧化作用增加,从而产生更多的MDA,但试验发现根系MDA除在25 mg·L-1处理时显著升高外,其余浓度与对照相比均降低。这可能是由于低浓度的Ca(L-asp)-NPs更容易被根吸收;浓度较高时,纳米颗粒的团聚现象使其不能轻易进入根细胞中,此时只有Ca(L-asp)-NPs析出的Ca2+进入,另外也可能是由于Ca(L-asp)-NPs吸附在根表,使渗漏的离子不能进入溶液中[31]。
4 结论
(1)Ca(L-asp)-NPs进入环境中后会对植物生长造成一定的影响,抑制棉花生物量的积累和根系的生长,棉花自身通过形成良好的根冠比来适应此胁迫。
(2)一定量的Ca(L-asp)-NPs处理会促进棉花对钙的吸收,但Ca(L-asp)-NPs会降低叶片叶绿素含量,同时降低根系抗氧化酶活性、MDA含量和电导率,但其深入机制需要进一步探究。

