运输应激对山羊免疫器官的病理损伤及热休克蛋白表达的影响
郑文亚,彭瑞妮,刘 犇,张雯苑,梅 婷,章志涛,李国生,邹剑伟,崔 燕
(1.宜春学院 生命科学与资源环境学院,江西 宜春 336000;2.甘肃农业大学 动物医学学院,甘肃 兰州 730070;3.江西绿科农牧科技有限公司,江西 宜春 336000)
随着我国山羊养殖业的迅速发展,在山羊养殖过程中,由于引种、异地采购、异地繁育等需要,远距离运输难以避免。目前主要以车辆运输为主,长途运输过程中,颠簸、震动、噪音、高(低)温和禁食禁水等刺激因素往往导致山羊发生心跳呼吸频率加快、惊恐或狂躁不安等应激反应。当应激强度超过机体的自我调节能力时,其免疫系统受到严重损害,体质条件差的山羊甚至会发生死亡,由运输应激引起的疾病和死亡对山羊养殖带来的危害及经济损失不容小觑。热休克蛋白(HSPs)是细胞在应激原诱导下生成的一组蛋白质,与运输应激关系紧密,其中HSP27、HSP70和HSP90是研究较多的应激诱导型热休克蛋白[1-2]。目前,国内外关于应激对动物热休克蛋白影响的报道,主要以鼠[3]、鸡[4]和猪[5]等为研究对象,对山羊等反刍动物的研究较少。有研究表明,热休克蛋白可以与一些抗原递呈细胞如巨噬细胞、树突状细胞等上的某些Toll样受体(TLR)结合来激活非特异性免疫系统,此外,特异性免疫系统也可以借助这种方式被激活[6]。因此,热休克蛋白能通过上述途径来介导免疫反应。免疫反应与免疫器官的结构和功能密不可分,本试验就运输应激对山羊免疫器官的病理损伤以及热休克蛋白表达的影响进行研究,为减少山羊运输损伤和探明抗运输应激机制等提供依据。
1 材料与方法
1.1 试验动物与试验设计将12只饲养条件相同,体质量相近(13.89±2.96) kg的健康公山羊随机分为3组,对照组、运输应激2 h组和6 h组。对照组在原来环境下正常饲养,其余2组分别进行2 h和6 h的运输(车速35~45 km/h),车内温度28~32℃,途中禁食禁水,运输后立即剖杀,采集肠系膜淋巴结和脾脏,分别放入4%多聚甲醛、2.5%戊二醛固定液和液氮中,用于后续试验。
1.2 试验材料小鼠SP试剂盒和DAB试剂盒购自北京中杉生物工程公司;HSP27、HSP70、HSP90等一抗和二抗Goat Anti-Mouse IgG购自Abcam公司;Mouse Anti-β-actin、SDS-PAGE凝胶制备试剂盒购自博士德生物;总蛋白提取试剂盒和蛋白质定量试剂盒(BCA)购自普利莱基因技术公司;4×Protein SDS PAGE Loading Buffer购自北京宝日医生物技术公司;超敏化学发光检测试剂盒购自US Everbright Inc公司。
1.3 显微和超微结构观察将4%多聚甲醛固定的淋巴结和脾脏组织在流水中冲洗过夜,取出后经脱水、透明、浸蜡和包埋等步骤,制成5 μm厚的连续切片,HE染色后在光学显微镜下观察并拍照;将2.5% 戊二醛固定的淋巴结和脾脏组织,经1%锇酸固定,脱水、包埋和超薄切片机切片后,用醋酸铀-枸橼酸铅染色,透射电镜观察并拍照。
1.4 免疫组织化学染色切片脱蜡至水,在柠檬酸缓冲液中进行微波抗原修复,按照小鼠SP试剂盒说明操作。一抗均按照1∶400稀释后使用,DAB显色后用苏木精复染。经脱水、透明、封片后,于显微镜下观察,阳性产物呈棕色为强表达,黄色为中等表达,淡黄色为弱表达,不着色为不表达。
1.5 Western blot测淋巴结和脾脏样品质量后用总蛋白提取试剂盒制备蛋白样品,用BCA法测定蛋白浓度并将正常组和运输组的蛋白浓度调为一致,按1∶3的比例加入4×Protein SDS PAGE Loading Buffer,95℃变性10min后上样。电泳2.5 h后进行转膜,用PVDF膜湿转1 h,电转后取出PVDF膜用TBST漂洗后封闭2 h,再用TBST漂洗3次,10 min/次,放入一抗(HSP27 1∶5 000,HSP70 1∶1 000,HSP90 1∶1 000,内参蛋白Mouse Anti-β-actin 1∶1 000)在垂直混合仪中4℃孵育18 h;取出后用TBST漂洗3次,10 min/次,接下来放入二抗(一抗为HSP27、HSP70、HSP90和内参蛋白对应的二抗浓度分别为1∶8 000,1∶20 000,1∶2 000,1∶10 000)在水平摇床上孵育2 h后用TBST漂洗3次,10 min/次,最后用超敏化学发光检测试剂盒在暗环境下显色并在Amersham Imager 600超灵敏多功能成像仪上拍照。
1.6 图像采集与统计分析将图片用Image Pro Plus 6.0软件读取目的条带密度值后,与内参蛋白密度值进行比较,记为测试值。再用SPSS 18.0软件进行分析,结果记为平均值±标准差,P<0.01表示差异极显著,P<0.05表示差异显著,P>0.05表示差异不显著。
2 结果
2.1 淋巴结和脾脏的病理学观察
2.1.1淋巴结 光镜观察显示,与对照组相比,运输2 h组皮质的淋巴小结体积增大,数量增多,生发中心明显;髓质的髓索变粗,髓窦中充满淡红色红染物质,且伴有巨噬细胞增生。运输6 h时,淋巴小结增生愈发明显,但生发中心的淋巴细胞核可见核碎片,淋巴细胞数量有所下降,髓质中髓索和髓窦的界限不清(图1)。电镜观察显示,运输6 h组淋巴结的淋巴细胞线粒体肿胀,出现空洞;部分淋巴细胞核膜破裂,染色质呈碎块状,细胞器结构不清;少数淋巴细胞胞核呈锯齿状或核膜凹陷;偶见淋巴细胞核中出现包涵体,网状细胞线粒体肿胀变空,形态异常,呈细长型;粗面内质网脱颗粒(图2)。

图1 山羊淋巴结的显微结构观察 A~C.对照组;D~F.运输应激2 h组;G~I.运输应激6 h组。C.被膜;LN.淋巴小结;MC.髓索;MS.髓窦;圆框.淡红色渗出物;箭头(黑).巨噬细胞
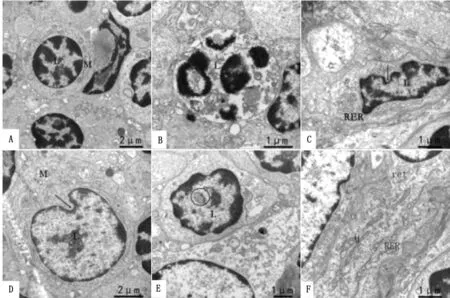
图2 山羊淋巴结的超微结构观察 A~F.运输应激6 h组淋巴结超微结构电镜观察不同视野图。L.淋巴细胞;ret.网状细胞;M.线粒体;RER.粗面内质网;箭头(黑).核膜凹陷;圆框.包涵体
2.1.2脾脏 光镜观察显示,与对照组相比,运输2 h 组脾小结增生,边缘区面积明显增宽,红髓中可见大量红细胞,且有含铁血黄素颗粒散在分布。运输6 h时,红髓中的红细胞数量有所减少,脾小结淋巴细胞可见核碎片,且数量有所减少,细胞间空隙变宽(图3)。电镜观察显示,脾脏的淋巴细胞线粒体肿胀变空,嵴断裂或减少;部分淋巴细胞高尔基体扩张,扁平囊膜出现空泡,偶见淋巴细胞核内出现包涵体。淋巴细胞间可见凋亡细胞,固缩,电子密度高,核质比增大,核周间隙增宽,可见凋亡小体。髓质中出现较多中性粒细胞,其表面短小微绒毛消失,表面光滑,染色质固缩,核膜破裂,小梁内平滑肌细胞线粒体肿胀变空,呈细长形。网状细胞线粒体肿胀,内腔基质中出现界限不清的絮状物质。浆细胞核周间隙变宽,内部清亮,粗面内质网丰富,局部扩张,似筛状结构(图4)。
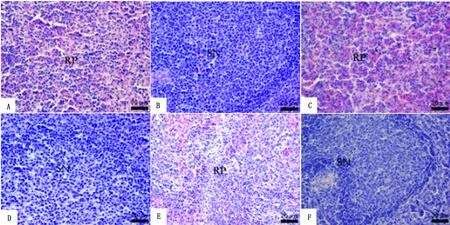
图3 山羊脾脏的显微结构观察 A~B.对照组;C~D.运输2 h组;E~F.运输6 h组。RP.红髓;SN.脾小结;黑箭头.含铁血黄素颗粒

图4 山羊脾脏的超微结构观察 A~F.运输应激6 h组脾脏超微结构电镜观察不同视野图。L.淋巴细胞;RBC.红细胞;NG.中性粒细胞;SMC.平滑肌细胞;ret.网状细胞;P.浆细胞;M.线粒体;RER.粗面内质网;圆形框.核内包涵体;黑箭头.核周隙增宽;白箭头.核膜破裂;正方形框.小梭形的特殊颗粒;长方形框.圆形的嗜天青颗粒;椭圆框.密体;三角形框.絮状物质
2.2 热休克蛋白在淋巴结和脾脏的表达
2.2.1淋巴结 免疫组织化学结果显示,HSP27在对照组和运输应激组的表达部位没有明显差异,在被膜和小梁以及血管内皮细胞胞质呈黄色,网状细胞和髓窦窦壁内皮细胞胞质呈黄色,淋巴小结有散在的淋巴细胞胞核呈棕色,淋巴小结周围弥散淋巴组织有部分淋巴细胞胞核呈棕色。HSP70在被膜和小梁以及血管内皮细胞不着色,网状细胞和髓窦窦壁内皮细胞呈淡黄色。对照组和运输应激2 h组在淋巴小结和髓索的淋巴细胞胞质呈黄色,运输6 h后淋巴细胞胞质呈淡黄色。HSP90在对照组淋巴小结和髓索中的淋巴细胞胞核和胞质呈淡黄色,运输处理2h后,淋巴细胞胞核和胞质呈黄色,运输持续6 h时呈棕色(图5)。
2.2.2脾脏 免疫组织化学结果显示,HSP27在脾脏的被膜、小梁以及血管内皮细胞胞质呈黄色,对照组脾小结和边缘区有散在淋巴细胞胞核呈棕色,外套区淋巴细胞胞核呈棕色,红髓部分淋巴细胞胞核呈黄色,运输2 h组红髓淋巴细胞表达明显,大部分淋巴细胞胞核呈棕色,运输6 h组HSP27的表达情况与对照组类似。HSP70在脾脏的被膜、小梁以及血管内皮细胞胞质不着色,对照组在脾小结的淋巴细胞胞质呈黄色,外套区几乎不着色,边缘区有散在的淋巴细胞胞质呈棕色,运输处理2 h,脾小结阳性表达淋巴细胞减少,只有散在的淋巴细胞胞质呈淡黄色,运输6 h组与2 h组的HSP70表达情况相似。HSP90在脾脏的被膜、小梁及血管内皮细胞不表达,对照组脾小结和边缘区淋巴细胞胞质呈淡黄色,有少数在胞核呈淡黄色,外套区几乎不着色,运输2 h组和6 h组脾小结外套区淋巴细胞出现表达,胞核呈黄色,且与对照组相比,脾小结阳性表达淋巴细胞数量增多(图6)。
2.3 热休克蛋白在淋巴结和脾脏的定量表达
2.3.1淋巴结 Western blot结果显示,山羊淋巴结HSP27蛋白表达量在对照组、运输2 h和6 h组间无显著性差异(P>0.05)。运输2 h组HSP70蛋白表达量与对照组相比显著升高(P<0.05),而运输6 h 组HSP70蛋白表达量与2 h组相比下降,与对照组和2 h组均无显著性差异(P>0.05)。运输2 h和6 h组HSP90蛋白表达量均显著高于对照组(P<0.05),而2 h和6 h组间HSP90蛋白表达量无明显差异(P>0.05)。
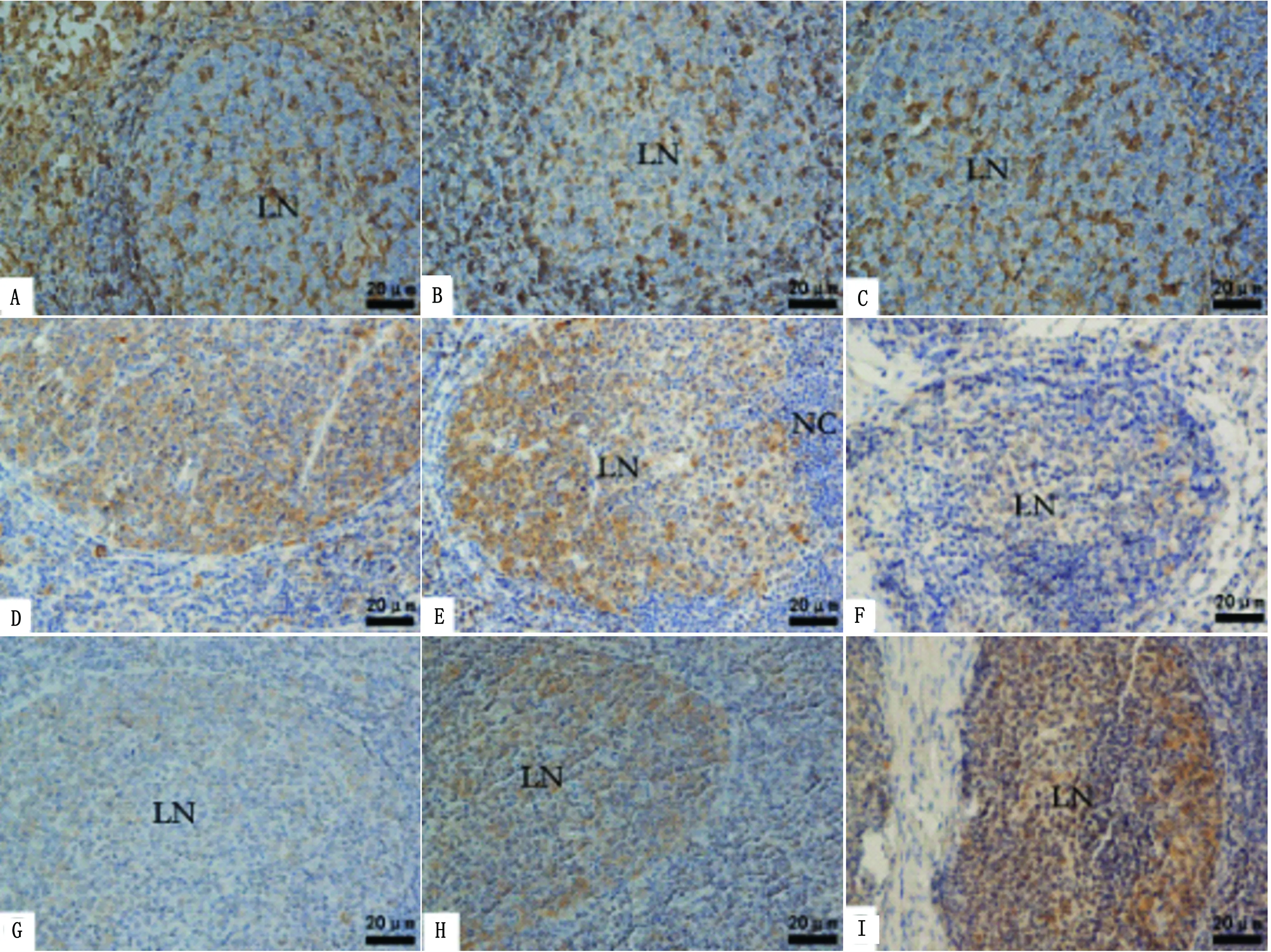
图5 HSP27、HSP70和HSP90在山羊淋巴结内表达 A~C.HSP27表达情况;D~F.HSP70表达情况;G~I.HSP90表达情况。A,D,G.对照组;B,E,H.运输2 h组;C,F,I.运输6 h组。LN.淋巴小结;NC.小结帽
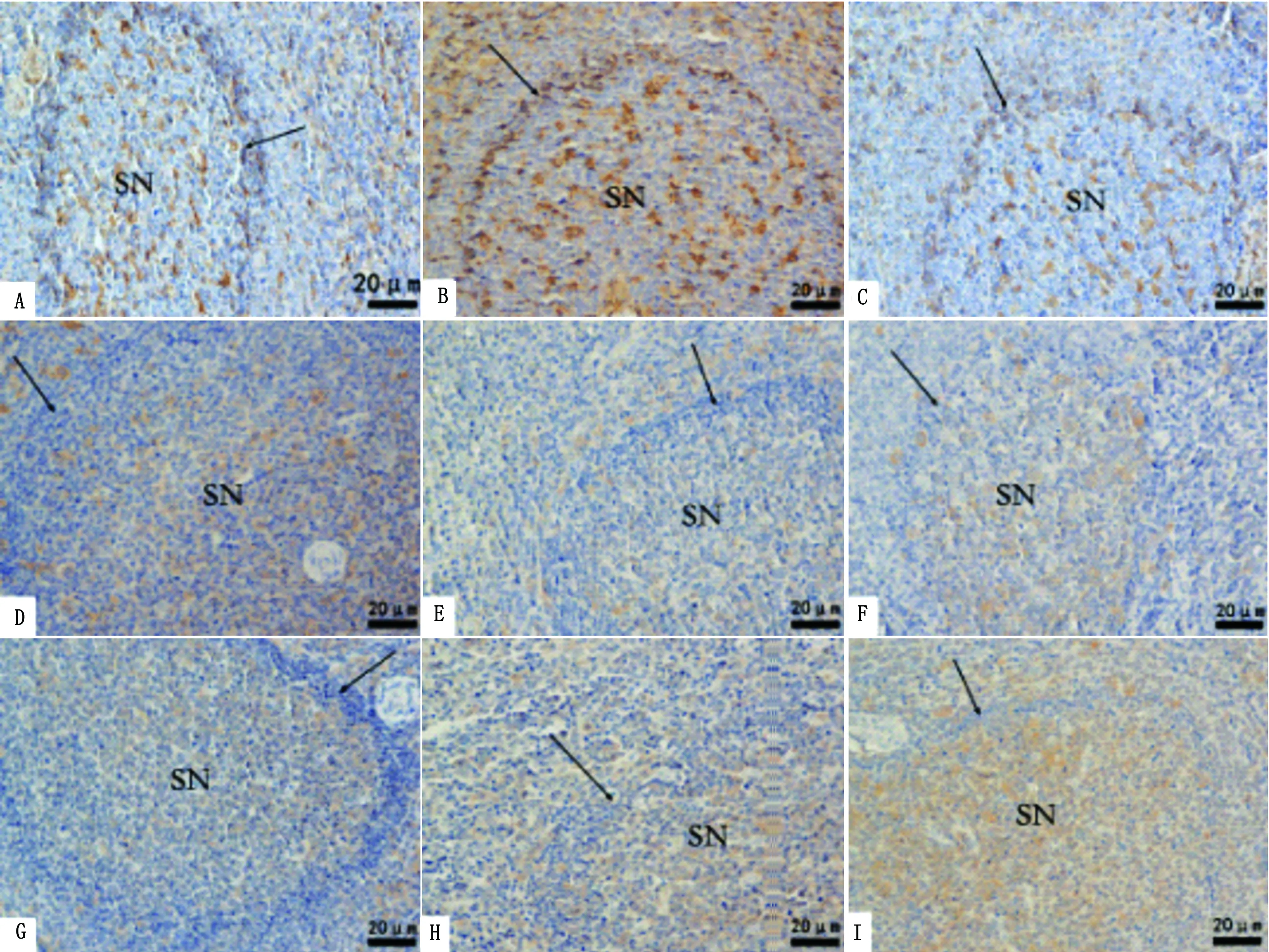
图6 HSP27、HSP70和HSP90在山羊脾脏内的表达 A~C.HSP27表达情况;D~F.HSP70表达情况;G~I.HSP90表达情况。A,D,G.对照组;B,E,H.运输2 h组;C,F,I.运输6 h组。SN.脾小结;黑箭头.外套区
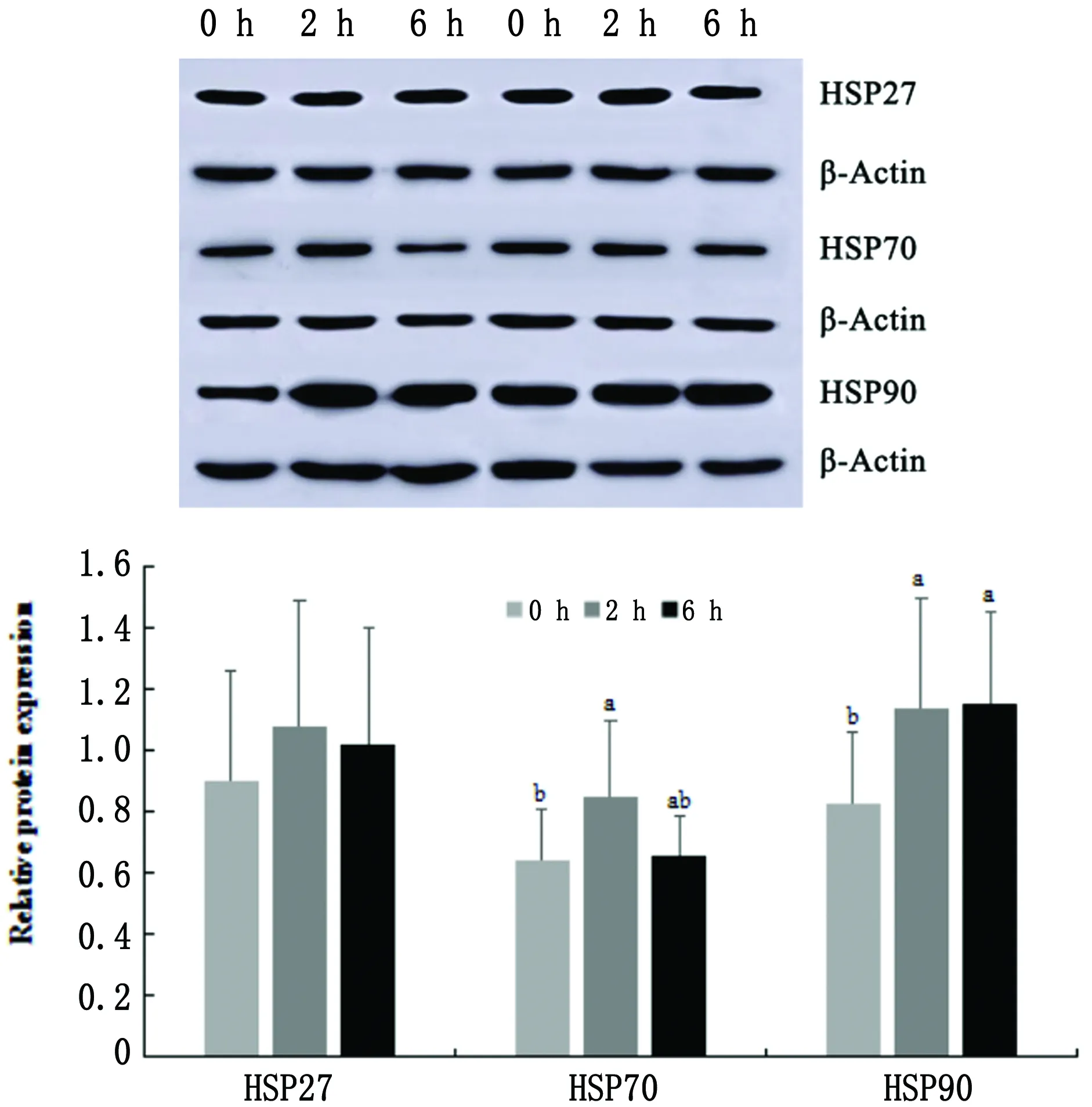
图7 运输应激2 h组、6 h组与对照组山羊淋巴结HSP27、HSP70和HSP90的相对表达量 同一蛋白3个组间不同小写字母表示差异显著(P<0.05),相同小写字母表示差异不显著(P>0.05)
2.3.2脾脏 Western blot结果显示,运输2 h组山羊脾脏HSP27蛋白表达量与对照组相比明显升高(P<0.05),运输6 h组HSP27蛋白表达量比运输2 h组下降,但与对照组和运输2 h组间无显著性差异(P>0.05)。与对照组相比,运输2 h组HSP70蛋白表达量下降,但无显著差异(P>0.05),但运输6 h组HSP70蛋白表达量极显著低于对照组(P<0.01),与2 h组之间无显著性差异(P>0.05)。运输2 h 和6 h组HSP90蛋白表达量均极显著高于对照组(P<0.01),而2 h和6 h组之间HSP90蛋白表达量无明显差异(P>0.05)。
3 讨论
运输是动物生产过程中的一个重要环节,运输质量的好坏不仅关乎动物经济价值,还是有关动物福利的一个重要因素。有研究表明,尽量减少运输时间,可以减少动物应激损伤从而保障动物福利[7]。运输时间的延长,对动物而言虽初期装载和运输环境的心理压力有所缓解,但疲劳、代谢损害和脱水等对它们的健康造成进一步的负面影响[8]。DE LA FUENTE等[9]对羔羊研究发现,运输30 min的羔羊血液中皮质醇和乳酸脱氢酶的浓度明显高于运输5 h,提示运输应激导致机体损伤在运输前期比较明显,随着运输时间的延长,损伤可能得到缓解。同时也暗示不同运输时间对动物机体造成的应激性损伤有所不同。
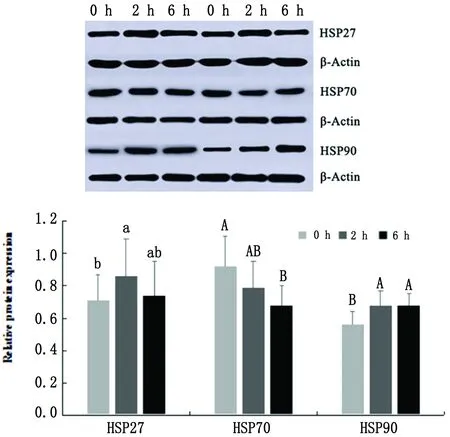
图8 运输应激2 h组、6 h组与对照组山羊脾脏HSP27、HSP70和HSP90的相对表达量 同一蛋白3个组间不同大写字母表示差异极显著(P<0.01),不同小写字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05)
本研究发现,运输2 h时,山羊的淋巴结和脾脏中的淋巴小结及脾小结增生明显,运输时间持续到6 h时,淋巴小结和脾小结的淋巴细胞都有核碎片,淋巴细胞线粒体肿胀呈空泡化,核膜凹陷,核内出现包涵体,网状细胞粗面内质网脱颗粒,脾脏中的中性粒细胞微绒毛消失,核膜出现破裂。以上淋巴结和脾脏的病理变化,与山羊的免疫功能密切相关。淋巴结和脾脏是机体重要的外周免疫器官,是淋巴细胞聚集和生成的场所,2 h的运输刺激尚未超过机体的自我调节能力,能使山羊免疫器官动员起来,代偿性增生免疫细胞,提高免疫机能,以应对不良应激。张彩霞等[10]通过稀释运输2 h后的猪血清,发现能够促进正常猪的外周淋巴细胞的增殖,也验证了这一观点。然而机体的代偿是有一定限度的,超过其承受能力,极易诱导不完全代偿甚至是失代偿的情况发生。在对山羊长途运输12 h后,发现环境因素诱导淋巴细胞、中性粒细胞和嗜酸粒细胞减少,导致机体免疫受到抑制[11];小鼠处于冷应激时,前期机体处于积极抵抗状态,后期机体的抵抗力是消极的[12]。结合本试验结果说明,淋巴细胞的增殖在运输条件下具有时效性[13],随着运输时间的增加,代偿能力受损,机体开始出现免疫抑制。
热休克蛋白(HSPs)是Ritossa在果蝇中发现的,自此引起了国内外学者的广泛关注。其作为一种天然的生理工具,无论是它们在新生蛋白中的伴侣功能还是细胞应激后的治疗作用都引起了研究者们极大的兴趣[14]。按照相对分子质量的大小,热休克蛋白可分为HSP110、HSP90、HSP70、HSP60和小分子热休克蛋白sHSP五个家族。其中报道较多的是HSP90、诱导型HSP70(也称为HSP72)和小热休克蛋白HSP27[15]。这3种蛋白与关键的凋亡因子有关,是功能强大的抗凋亡蛋白,能不同程度地阻断细胞死亡[16],是增强各种信号蛋白如CDK4、细胞周期激酶、类固醇激素受体和免疫防御反应的主要因素。HSP90占细胞总量的1%~2%,经诱导后从基线水平增加到4%~6%[16-17];HSP70作为分子伴侣蛋白,通过分子间的相互作用保护已合成的蛋白质免受进一步的损伤,且能够区分是应该修复细胞损伤并抑制细胞凋亡,还是在细胞损伤无法治疗时允许凋亡发生[18-19];HSP27具有较强的细胞保护作用,主要是由于它能在不同阶段阻断细胞凋亡[2]。这3种蛋白在机体受到外来应激时各司其职,协同作用,以促进机体的免疫调节。运输应激时,山羊免疫组织细胞中的热休克蛋白含量也会发生变化,以维持细胞内环境的稳定,协助组织细胞耐过逆境。有研究表明,免疫器官能感知热休克蛋白表达水平的改变,比如香芹酚等就可能通过促进热休克蛋白的生成来支持免疫调节[20]。FAN等[21]证实,肠外补充谷氨酰胺(GLN)联合肠内营养,可上调HSP90的表达,减轻淋巴器官和循环淋巴细胞的凋亡,增强免疫力,提高烧伤大鼠的成活率。对患脓毒症动物添加脱氢表雄酮时,可以上调肺部和脾脏HSP70的表达量,从而增强细胞免疫;对鸡的硒缺乏症研究发现,在鸡的脾脏和胸腺中HSP70和HSP90明显上升,进而改善免疫状态[22-23]。此外,HSP27、HSP70和HSP90在鸡的免疫器官中显著升高,并在氧化应激条件下表现出保护作用[24]。本研究结果显示,对山羊运输应激处理后,HSP90在淋巴结和脾脏中表达量显著升高,而HSP70和HSP27在运输6 h后,相比运输2 h分别在淋巴结和脾脏中出现表达下降的趋势,并且免疫组织也开始出现一些不可逆性的损伤。这可能与淋巴小结、脾小结中HSP70和弥散淋巴组织中HSP27的表达下调有一定的相关性,而HSP90的上调可能是为了缓解免疫组织的压力。HSP70在脾脏中的下调可能由于应激时其储备量被用来缓解压力,消耗与合成还未形成正比。运输应激2 h时,脾小结大量增生与HSP70的保护作用是分不开的。运输应激6 h时,脾脏中淋巴细胞数量减少,虽然HSP90上调发挥保护作用,但随着运输时间的延长,应激对机体的损害进一步累加,HSP70的消耗量也大大增加,在这种失衡条件下,机体形成不可逆的病理损伤。总之,运输应激可导致山羊免疫器官的组织损伤以及3种热休克蛋白表达水平的变化。

