高容量血液滤过联合前列地尔治疗新生儿感染性休克合并急性呼吸窘迫综合征的效果
熊伶俐
四川大学华西广安医院儿科,四川成都 638000
感染性休克部分患者则可能导致继发出现急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是临床上严重威胁新生儿健康安全的重症疾病[1]。ARDS 指以肺毛细血管通透性增加、血管弥漫性损伤为主要病理基础[2]。有研究指出,感染性休克合并ARDS 属于全身炎性反应综合征的肺部表现[3]。有学者指出,连续性肾脏替代治疗方案是目前治疗感染性休克合并ARDS 的重要手段,可有效清除体内炎症介质因子而起到调控炎性反应目的[4]。高容量血液滤过(high volume hemofiltration,HVHF)是近年来在连续性肾脏替代治疗基础上发展的新型治疗方案,在临床应用中通过该增加置换液量提高清除大中分子溶质的能力[5]。前列地尔是目前临床中较为常见的治疗并改善微循环状态药物[6],但其在治疗感染性休克合并ARDS 中的应用仍鲜有报道。笔者选取四川大学华西广安医院(以下简称“我院”)收治的新生儿感染性休克合并ARDS 患儿作为研究对象,分析HVHF 联合前列地尔的联合应用价值及对患儿血清高迁移率族蛋白B1(high mobility group box 1,HMGB1)、基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)水平的影响。
1 资料与方法
1.1 纳入及排除标准
纳入标准:①我院出生的新生儿,出生12 个月内;②符合感染性休克诊断标准[7];③符合ARDS 诊断标准[8];④治疗后患儿存活;⑤法定监护人对本研究知情并签署知情同意书。排除标准:①合并出血症状;②对使用药物过敏;③存治疗禁忌证;④法定监护人主动申请退出本研究。
1.2 一般资料
将2016 年1 月~2018 年6月我院收治的80 例新生儿感染性休克合并ARDS 患儿依照随机信封法分为观察组及对照组,每组40 例。观察组中男27 例,女13 例;出生时间(5.83±1.32)个月;APACHEⅡ评分(27.38±3.19)分;SOFA 评分(15.56±2.01)分;感染类型:肺部感染24 例,血行感染11 例,尿路感染4 例,其他1 例。对照组中男26 例,女14 例;出生时间(5.91±1.40)个月;APACHEⅡ评分(27.41±3.07)分;SOFA 评分(15.63±2.14)分;感染类型:肺部感染23 例,血行感染10 例,尿路感染5 例,其他3 例。两组患儿一般资料比较,差异无统计学意义(P >0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.3 方法
所有患儿均进入ICU 病房,给予禁饮禁食、胃肠减压、解痉、生长抑素抑制胰酶分泌、抗感染及对症支持治疗,并依照患儿气血分析和呼吸状态给予机械通气、气管插管、高流量面罩吸氧干预。在常规治疗干预基础上入院后24 h 内行血液滤过方案干预治疗,采取股静脉置管,采用AK96 型血液透析机干预,使用AN69HF 空心纤维滤器。采用低分子肝素(扬子江药业集团江苏龙凤堂中药有限公司,生产批号:20151206)抗凝,并采用前稀释法进行稀释处理,对照组采用35 mL/(kg·h)的速率进行滤过,且持续滤过干预72 h,观察组每日采用6~8 h 的85 mL/(kg·h)速率的高容量血液进行滤过,后依照对照组速率进行干预治疗,持续性滤过72 h,且观察组采用前列地尔注射液(哈药集团生物工程有限公司,生产批号:20151121)干预治疗,使用10 mL 生理盐水溶解10 μg 前列地尔,静脉注射2 次/d,连续治疗7 d。
1.4 观察指标
统计两组治疗基本情况包括呼吸机通气时间、ICU 住院时间。记录两组患儿呼吸功能指标变化情况,包括呼吸频率(RR)、动脉氧分压(PaO2)、吸入氧浓度(FiO2)、氧合指数(OI)、呼气末正压(PEEP)、气道阻力(AR),并记录患儿血中炎性反应指标变化水平,包括降钙素原(PCT)、C 反应蛋白(CRP)、白细胞介素-6(IL-6)及CD4+/CD8+水平。并采用酶联免疫吸附试验法检测患儿血中HMGB1、MMP-9 水平。
1.5 统计学方法
采用SPSS 19.0 统计学软件进行数据分析,计量资料用均数±标准差()表示,组间比较采用t 检验,组内比较采用重复测量的方差分析,进一步两两比较采用LSD-t 检验;计数资料采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 患儿治疗一般情况调查结果
观察组呼吸机通气时间及ICU 住院时间均短于对照组,差异有统计学意义(P <0.05)。见表1。
表1 两组患儿治疗一般情况比较(d,)
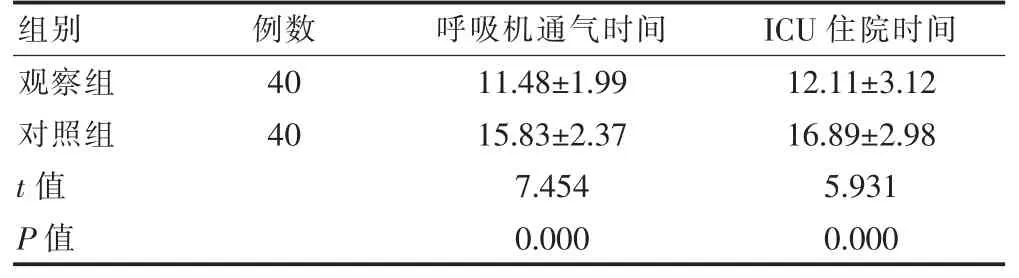
表1 两组患儿治疗一般情况比较(d,)
2.2 两组呼吸功能监测结果
两组治疗前及治疗1 d 时RR、PaO2、FiO2、OI、PEEP 及AR 比较,差异无统计学意义(P >0.05),治疗3 d 及治疗6 d 时观察组RR、FiO2、PEEP、AR 均低于对照组,PaO2及OI 水平均高于对照组,差异有统计学意义(P <0.05)。见表2。
2.3 两组患儿血中炎症因子检测结果
两组治疗0 d 及治疗1 d 时PCT、CRP、IL-6 及CD4+/CD8+水平差异无统计学意义(P >0.05);治疗3 d及治疗6 d 时观察组血中PCT、CRP、IL-6 及CD4+/CD8+水平均低于对照组,差异有统计学意义(P <0.05)。见表3。
表2 两组患儿呼吸功能监测结果比较()
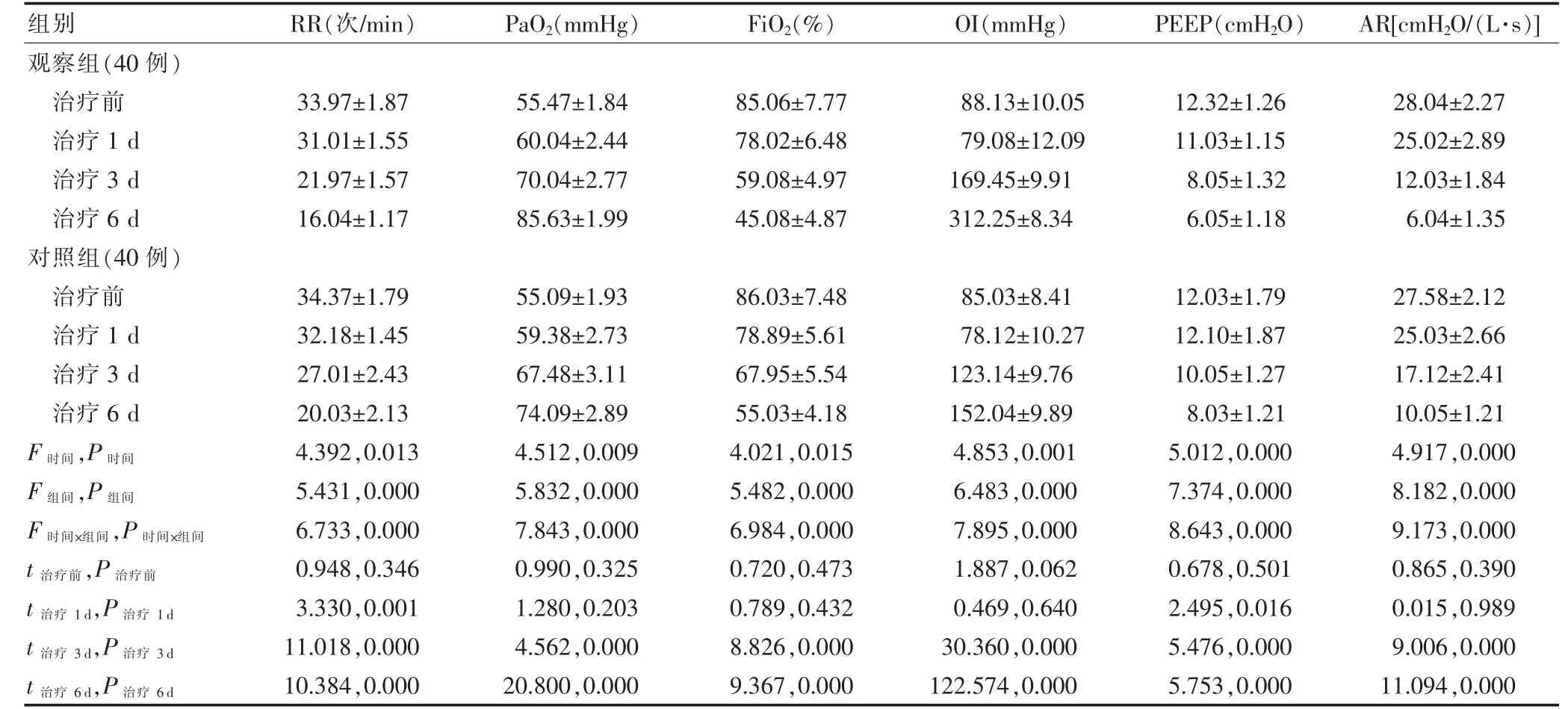
表2 两组患儿呼吸功能监测结果比较()
注:表中t、P 值均为组间比较结果。1 mmHg=0.133 kPa;1 cmH2O=0.098 kPa。RR:呼吸频率;PaO2:动脉氧分压;FiO2:吸入氧浓度;OI:氧合指数;PEEP:呼气末正压;AR:气道阻力
表3 两组患儿血中炎症因子检测结果比较()
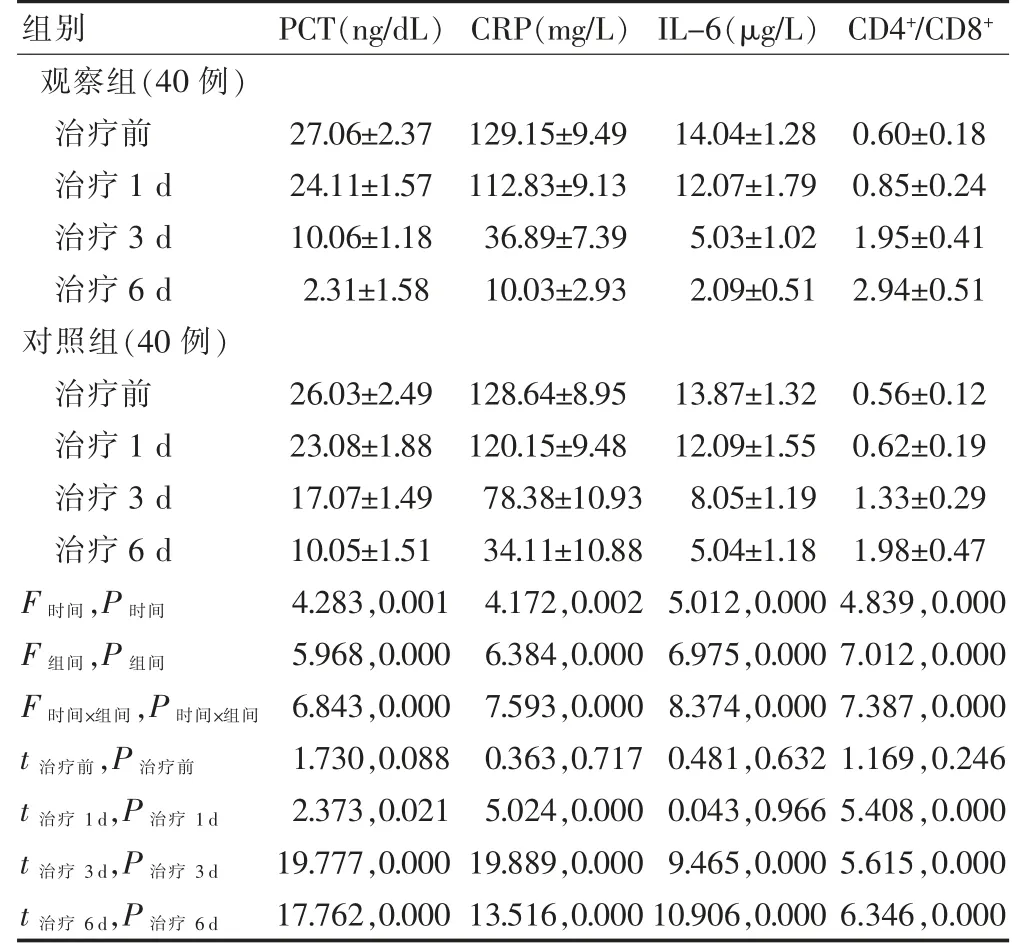
表3 两组患儿血中炎症因子检测结果比较()
注:表中t、P 值均为组间比较结果。PCT:降钙素原;CRP:C 反应蛋白;IL-6:白细胞介素-6
2.4 两组患儿血中HMGB1 及MMP-9 水平检测结果
治疗前及治疗1 d 时两组血中HMGB1 及MMP-9水平差异无统计学意义(P >0.05);治疗3 d 及6 d时观察组血中HMGB1 及MMP-9 水平均低于对照组,差异有统计学意义(P <0.05)。见表4。
3 讨论
ARDS 是临床中常见危重疾病,该病的生理病理基础主要为肺泡上皮细胞受损、血管内皮细胞受损、血管通透性亢进等[9]。胶原组织暴露、血管内皮细胞受损等印度均可能导致血小板附着聚集,并可能进一步激活体内凝血反应链,导致免疫球蛋白及纤维蛋白应激增高,并最终导致微循环障碍并形成血栓[10]。有学者指出,感染性休克、重症感染等因素均可能合并并释放大量炎症因子,并导致血管内皮细胞受损,因而感染性休克患者常合并出现ARDS[11]。
有学者发现在休克患者体内常伴随出现内毒素水平异常,而采用HVHF 对患者干预后可有效去除体内内毒素,并显著改善患者心排出量、动脉压及心室功能[12]。采用HVHF 对患者干预后可有效清除体内水溶性毒素,并有效改善其血液动力学指标[13]。研究发现随着血液置换量的增加患者预后及存活率均显著改善,即采用HVHF 治疗后可显著改善治疗感染性休克合并ARDS 的效果[14]。前列地尔又称为前列腺素E1,有研究指出前列地尔可有效保护肺损伤组织,其机制可能与前列地尔可有效抑制肺内中性粒细胞聚集和活化,且具有较高的选择性有关[15]。此外,前列地尔可有效提高中性粒细胞细胞内炎症因子水平,抑制白细胞介素、肿瘤坏死因子等表达,下调核因子-κB(NF-κB)活性,抑制血小板活化和聚集,减少血栓素A2 产生。前列地尔可有效改善ARDS 患者氧合水平并降低肺动脉压,具有较高的临床应用价值[16]。
表4 两组患儿血中HMGB1及MMP-9 水平检测结果比较(ng/dL,)
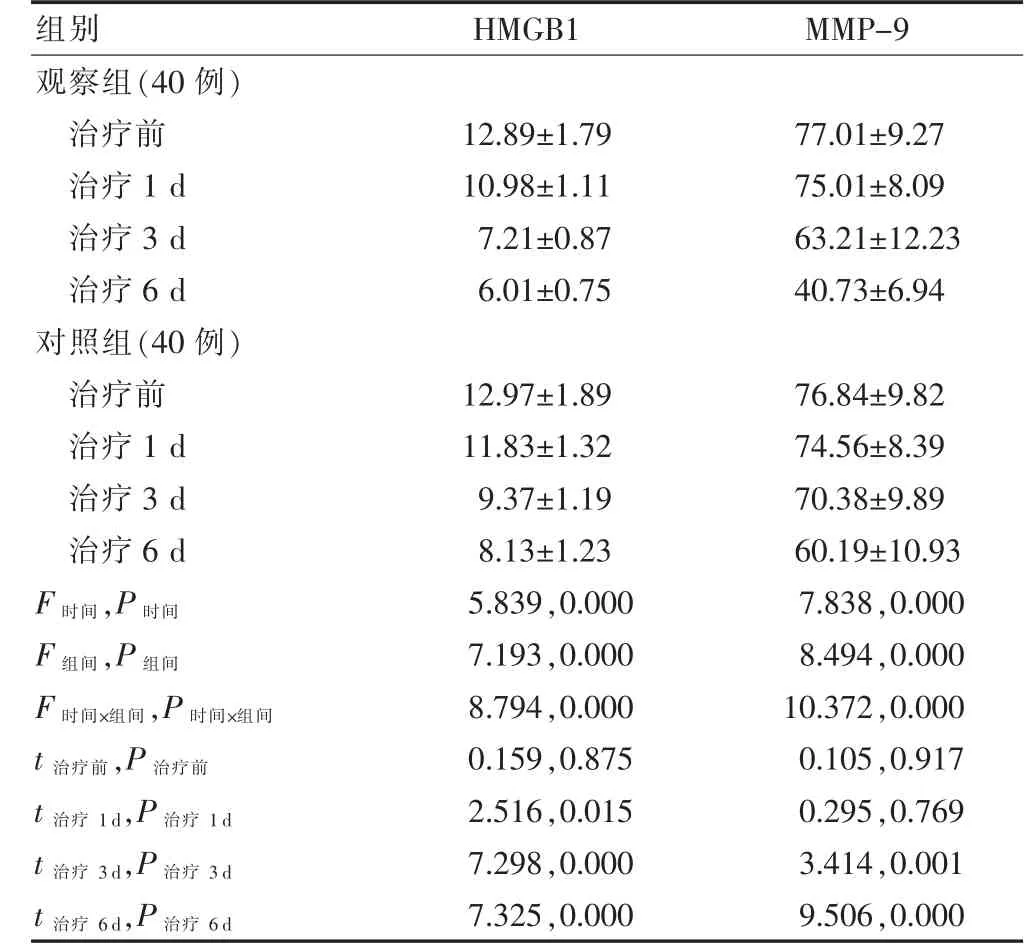
表4 两组患儿血中HMGB1及MMP-9 水平检测结果比较(ng/dL,)
注:表中t、P 值均为组间比较。HMGB1:高迁移率族蛋白B1;MMP-9:基质金属蛋白酶-9
HMGB1 是真核细胞中广泛存在的非组蛋白,也是体内重要的晚期炎症因子,在炎症性疾病发生发展过程中起到十分重要的作用,并可能导致感染性休克、全身炎性反应及ARDS 等疾病的发生发展[17]。新生儿感染性休克合并ARDS 患者体内常处于过度氧化应激状态,导致体内大量单核细胞和上皮细胞被激活,大量合并并分泌HMGB1,进一步激活白细胞介素和肿瘤坏死因子等炎症因子,而炎症因子则可能进一步加速HMGB1 分泌,导致恶性循环[18-21]。MMP-9 是人体内基质金属蛋白酶家族重要成员,在细胞外基质的降解过程中MMP-9 起到十分重要的作用[22-23]。新生儿感染性休克合并ARDS 患者肺组织内MMP-9 表达水平异常增高,将进一步降低肺部血管内皮细胞中明胶酶,导致血管通透性增加,使炎症细胞更易破坏上皮层或基底膜到达炎性部位,导致毛细血管通透性增加,加重患者病情[24]。
观察组呼吸机通气时间及ICU 住院时间均短于对照组,治疗3 d 及治疗6 d 时观察组患儿RR、FiO2、PEEP、AR 均低于对照组,PaO2及OI 水平均高于对照组。此外治疗3 d 及治疗6 d 时观察组患儿血中PCT、CRP、IL-6 及CD4+/CD8+水平均低于对照组,且HMGB1及MMP-9 水平均低于对照组。分析认为,感染性休克合并ARDS 患儿采用HVHF 联合前列地尔治疗后可有效治疗患儿氮质血症,纠正酸碱平衡紊乱,有效维持患儿体内液体平衡,并可快速有效清除体内炎症介质和毒素,调节免疫系统,改善患儿气管损伤及功能障碍等症状,有效降低患儿体内炎症因子水平及肺损伤程度,并降低患儿血中HMGB1、MMP-9 水平。
综上所述,采用HVHF 联合前列地尔治疗新生儿感染性休克合并ARDS 患儿,可有效提高传统方案的临床疗效,并改善患儿肺功能及体内炎症状态,降低血中HMGB1 及MMP-9 水平。

