双氢青蒿素对肝癌细胞氨基酸代谢的影响及机制研究
王惠国 李丹 孙颖超 李雨桐 韩鑫龙 张静莹 唐玲


中图分类号R917;R96
文献标志码A
文章编号1001-0408(2020)02-0132-06
DOI 10.6039/j.issn.1001-0408.2020.02.02
摘要 目的:考察双氢青蒿素(DHA)对人肝癌细胞Huh7、BEL-7402中氨基酸类代谢产物的影响,为阐明DHA参与肝癌细胞代谢的调控机制提供理论基础。方法:采用CCK-8法,测定不同浓度DHA(12.5、25、50、100 μmol/L)作用24、48、72h后对两种细胞活性的影响。将两种细胞分别分为对照组和给药组(DHA,25 μmol/L),加入不合药或含药培养基后培养24h,均平行操作3份。对各组细胞样品进行衍生化处理后,采用气相色谱联用质谱(GC-MS)法检测细胞中氨基酸代谢物含量变化,结合SIMCA-P软件分析和化合物谱库的比对,筛选出两种细胞中的差异代谢物;采用Metaboanalyst 4.0软件对差异代谢物进行通路富集分析。结果:与对照组比较,给药组Huh7细胞或BEL-7402细胞中谷氨酰胺、谷胱甘肽、苯丙氨酸、富马酸、牛磺酸等含量均呈下降趋势。上述两种细胞中分别筛选获得28、29个差异代谢物,两者的共同差异代谢物有10个,包括谷氨酰胺、谷胱甘肽、牛磺酸、富马酸、苯丙氨酸等;两者的差异代谢物分别富集到8、6条通路上,其共同富集通路为氨基酸-tRNA生物合成、天冬氨酸一丙氨酸一谷氨酸代谢、氮代谢、苯丙氨酸代谢、戊糖磷酸途径。结论:DHA能明显降低Huh7细胞和BEL-7402细胞的活性,并能显著降低细胞中谷氨酰胺、谷氨酸、谷胱甘肽、苯丙氨酸等的含量;其可能通过影响天冬氨酸一丙氨酸一谷氨酸代谢通路等机制来调控两种细胞的生长。
关键词 双氢青蒿素;气相色谱一质谱联用技术;肝癌;机制;代谢通路;氨基酸
根据2018年最新数据显示,肝癌病死率在全球癌症患者中已排第3位,仅次于肺癌和胃癌[1]。我国是肝癌发病大国,每年有近50万的新发肝癌患者,其生存率低、复发率高,药物和手术治疗的结局也不理想[2]。随着抗肿瘤治疗的深入研究和近几年代谢组学的迅速发展,越来越多的相关研究围绕肿瘤细胞代谢组学开展。代谢组学又称代谢轮廓分析,是指通过对各种生物样品中小分子化合物(分子量<1 000)的代谢产物进行定性分析和定量测定,以监测不同代谢物的水平及变化,从而全面了解不同生物系统复杂生理和病理状态的一门学科[3]。气相色谱一质谱联用(GC-MS)技术具有灵敏度高、效率高的优点,可选择性地分离和检测大量代谢产物如氨基酸类、糖类、胺类等化合物,近年来在生命科学领域被广泛应用[4]。通过对代谢产物的定性和定量分析,并基于此进行三羧酸循环、尿素循环、糖酵解等途径的分析,是肿瘤代谢组学研究方面的常用方法。双氢青蒿素(Dihydroartemisinin,DHA)为青蒿素的衍生物,属于倍半萜内酯类化合物,其不仅具有抗疟疾、抗炎的药理活性,还具有抗肿瘤、促进细胞凋亡、抑制细胞生长等作用[5]。目前,关于DHA对肝癌细胞的作用的相关研究较少,其对肝癌细胞代谢方面影响的研究更少。基于此,本研究以肝癌细胞Huh7和BEL-7402为研究对象,考察经DHA干预处理后肝癌细胞活性和细胞中氨基酸类代谢产物的变化,旨在了解DHA对肝癌细胞代谢的影响,为阐明DHA参与肝癌细胞代谢的调控机制提供理论基础。
1 材料
1.1 仪器
GC-MS-P2010型GC-MS仪,配备电子轰击离子源(EI)、AOC-20i型自动进样器(日本岛津公司);CENCO型涡旋仪(荷兰Breda公司);Spectra Max 190型酶标仪(美国Molecular Devices公司);5804R型高速低溫离心机(美国Sigma公司);FreeZone@型冷冻干燥机(美国Labconco公司);LS-C0150型二氧化碳恒温培养箱(美国Thermo Fisher Scientific公司);AC2-4S型二级生物安全柜(新加坡Esco公司);DMil型倒置显微镜(德国Lei-ca公司);AMOAFIOOO型自动细胞计数仪(美国Invitro-gen公司);CP324S型电子微量天平(德国Sartorius公司);YM-080S型超声波清洗仪(深圳市方奥威电子有限公司)。
1.2 药品与试剂
DHA(美国Sigma公司,纯度:≥98%);甲氧胺(批号:BCBC344IV)、吡啶(批号:SHBG8498V)、N-甲基-N-(三甲基硅烷基)一三氟乙酰胺(MSTFA,批号:BCBV0257)均购自美国Sigma-Aldrich公司;DMEM培养基(批号:8118199)、胎牛血清(FBS,批号:2010092)、0.25%胰蛋白酶一乙二胺四乙酸溶液(0.25% Tryp-sin-EDTA,批号:1951049)、pH 7.4磷酸盐缓冲液(PBS,批号:8118213)、二甲基亚砜(DMSO,批号:1213C0343)购自北京索莱宝科技有限公司;CCK-8试剂盒(上海碧云天生物技术有限公司);甲醇为色谱纯,其他试剂均为分析纯,水为超纯水。
1.3 细胞
人肝癌Huh7、BEL-7402细胞均购自美国菌种保藏中心(ATCC细胞库)。
2 方法
2.1 细胞培养
取Huh7细胞和BEL-7402细胞,分别在37℃、5%C02条件下培养24h,待细胞生长至对数生长期后用于后续试验。
2.2 DHA对Huh7细胞和BEL-7402细胞活性的影响考察
取“2.1”项下对数生长期的Huh7细胞和BEL-7402细胞,用0.25%胰蛋白酶消化,以800 r/min离心5min,弃去上清液,加入含IO%FBS的DMEM培养基(以下简称培养基)1 mL,细胞计数后,按2 000个/孔加入96孔板,轻晃至细胞均匀平铺于板底即可。次日,待细胞贴壁后将其分为对照组和DHA不同剂量组(DHA终浓度分别为12.5、25、50、100 μmol/L),对照组加入不含药物的培养基,DHA各剂量组加入相应浓度的含药培养基,每组设4个复孔。加药后继续在37℃、5%C02条件下培养24、48、72 h。取出细胞,按CCK-8检测试剂盒方法操作,每孔加入CCK-8试剂20 μL,采用酶标仪于450nm波长处检测各孔吸光度(OD)值,用来表示细胞活性。试验均重复3次。
2.3 GC-MS法测定Huh7细胞和BEL-7402细胞中氨基酸代谢物含量
2.3.1 色谱条件色谱柱:DB-5 MS毛细管柱(30 mx250 μm,0.25 μm);载气:氦气;线性速度:40 cm/s;恒流模式:1.19 mL/min;程序升温(起始温度70℃,保持3mrn后,以5℃/min的速度升至300℃,保持10 min);进样温度:280℃;进样量:1μL;分流比:10:1。2.3.2质谱条件EI离子源;界面温度:300℃;离子源温度:230℃;EI轰击电压:70 eV;周期:0.2 s;检测电压:0.92 kV;扫描范围:质荷比(m/z):33~600 Da;溶剂切割时间:5.5 min。采用全扫描模式,扫描的离子为各个衍生产物的特征离子。
2.3.3 细胞样品预处理取“2.1”项下对数生长的Huh7细胞和BEL-7402细胞,计数后分别以2xl06个/皿接种于10 cm的平皿中,在37℃、5%C02、饱和湿度培养箱中培养24h。每种细胞均随机分为两组,一组加入培养基10mL作为对照组,另一组加入含25 μmol/L DHA的培养基10 mL作为给药组,继续培养24 h,每组均平行操作3份。培养结束后取出细胞培养皿,弃去培养基,以预冷的PBS洗涤3次,每皿加入预冷的甲醇1 mL,用细胞刮铲刮下细胞,转移至5 mL EP管中,涡旋混匀5min,超声处理20 s,再涡旋混匀1min后,静置10 min;在4℃下以13 500 r/min离心15 min后,吸取上清液700 μL至1.5mL离心管中,冻干,备用。取所有样本剩余上清液各20 μL混匀,作为本研究质量控制(QC)样品,冻干,备用。取上述冻干样品,分别加入甲氧胺50 μL,在37℃水浴th,以14 000 r/min离心2min;加入衍生化试剂MSTFA 40 μL,在37℃水浴1h,以14 000 r/min离心10min,再按“2.3.1”“2.3.2”项下色谱和质谱条件进样分析。计算QC样本GC-MS谱图中各成分峰面积RSD,用来评价样品预处理过程和仪器分析的稳定性(RSD≤30%即可)。
2.3.4 数据处理分析建立包含保留时间和特征离子信息的定量峰表,导入GC-MS仪器配置的Postrun Anal-ysis 2.7工作站,对数据进行批量积分处理,获得包含保留时间、特征离子和峰面积的原始峰表,并以总峰面积计算相对峰面积进行校正。
采用SPSS 17.O统计学软件对细胞活性试验数据进行处理;采用GC-MS仪器工作软件、SIMCA-P 11.0软件中的主成分分析(PCA)功能对代谢物含量测定数据进行处理。
3 结果
3.1 不同浓度DHA作用不同时间对Huh7细胞和BEL-7402细胞生长的影响
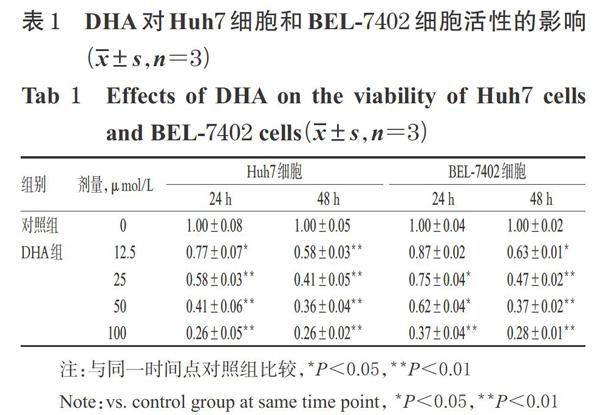
实验结果显示,随着DHA浓度的增加,或随着药物作用时间的增加,Huh7细胞和BEL-7402细胞的活性均呈下降趋势,与对照组比较差异均有统计学意义(P<0.05),表明DHA具有抑制两种肝癌细胞生长的能力,且呈剂量依赖和时间依赖趋势。以对照组细胞活性为基准进行比较,经25 μmol/L DHA作用24h时,Huh7细胞的活性降至58%,BEL-7402细胞的活性降至75%;经该浓度DHA作用48 h时,Huh7细胞的活性降至41%,BEL-7402细胞的活性降至47%。由此表明,25 μmol/LDHA作用24 h起对两种细胞就表现出明显的活性抑制作用,故本研究选择以25 μmol/L的DHA作用24 h進行后续试验,详见表1。
3.2 DHA对Huh7细胞和BEL-7402细胞中氨基酸代谢物的影响
QC样本经GC-MS检测及数据处理后,共得到186个代谢物成分峰(大部分RSD≤30%),对上述成分峰进行匹配并去除峰面积过小、重复性较差的峰数据,共获得70个成分的峰数据。经GC-MS检测并对每组平行操作的3份样品图谱中各代谢物成分峰面积数据进行分析,结果显示,以25 μmol/L的DHA作用于两种细胞24h后,峰面积RSD≤10%的成分共42个,占所有成分总峰面积的比例为60.00%;峰面积RSD为>10%~30%的成分共20个,占所有成分总峰面积的比例为28.57%;峰面积RSD>30%的成分共8个,占所有成分总峰面积的比例为11.43%。其中,RSD≤30%的成分占所有成分总峰面积的比例达88.57%,表明经药物作用后,细胞中大部分代谢物成分的产生情况较为稳定。峰面积RSD≤30%的62个代谢物详见表2。
将表2中的62个代谢物的峰面积经过SIMCA-P软件分析,并与化合物谱库进行分析比对,即获得Huh7细胞和BEL-7402细胞中的差异代谢物。结果显示,与对照组比较,12.5 μmol/L的DHA作用24 h后,Huh7细胞中的差异代谢物有28个,包括Glutamine(谷氨酰胺)、Glutathione(谷胱甘肽)、Alanine(丙氨酸)、Fumaric acid(富马酸)、N- acetyl-serine (N-乙酰丝氨酸)、N-acetyl-as-partic acid(N-乙酰天冬氨酸)等化合物;BEL-7402细胞中的差异代谢物有29个,包括Pantothenic acid(泛酸)、Phenylalanine(苯丙氨酸)、谷胱甘肽、Hypotaurine(牛磺酸)等化合物;Huh7和BEL-7402的共同差异代谢物有10个,包括泛酸、N-乙酰丝氨酸、N-乙酰天冬氨酸、牛磺酸、谷胱甘肽、Gluconic acid(葡糖酸)、富马酸、Erythron-ic acid(赤糖酸)、谷氨酰胺、苯丙氨酸。两种细胞的共有差异代谢物见表3;其相对峰面积见表4、表5。
由表4、表5可知,在有显著性变化的差异代谢物中,DHA给药组Huh7细胞和BEL-7402细胞中的多数代谢物平均含量呈显著降低趋势,表明DHA可能通过下调上述两种肝癌细胞中氨基酸类代谢物的表达,从而影响肝癌细胞的代谢通路。 3.3 Huh7细胞和BEL-7402细胞的差异代谢物富集信号通路
采用Metaboanalyst 4.O软件分别对Huh7细胞和BEL-7402细胞的差异代谢物进行通路富集分析。结果显示,Huh7细胞的差异代谢物富集到8条代谢通路,分别为氨基酸-tRNA生物合成、天冬氨酸一丙氨酸一谷氨酸代谢、氮代谢、苯丙氨酸代谢、三羧酸循环、牛磺酸一精氨酸代谢、半胱氨酸一蛋氨酸代谢、戊糖磷酸途径;BEL-7402细胞的差异代谢物富集到6条代谢通路,分别为氨基酸-tRNA生物合成、天冬氨酸一丙氨酸一谷氨酸代谢、氮代谢、苯丙氨酸代谢、戊糖磷酸途径、泛酸一辅酶A的生物合成,详见图1(注:图中圆点的直径越大,且距离坐标距离越远,则说明富集到代谢通路的差异代谢物越重要)。其中,Huh7细胞和BEL-7402细胞差异代谢物均富集到的通路为氨基酸-tRNA生物合成、天冬氨酸一丙氨酸一谷氨酸代谢、氮代谢、苯丙氨酸代谢和戊糖磷酸途径。
4 讨论
一直以来,青蒿素及其衍生物被人们熟知主要是因为其抗疟疾作用。而作为青蒿素的衍生物,DHA具有高效、安全、低毒等特点。近年来,越来越多研究表明其不仅具有抗疟疾作用,还具有促进肿瘤细胞凋亡、调控细胞周期等抗肿瘤作用[6-10],但目前尚未见从代谢组学方面阐述DHA对肝癌细胞影响的研究报道。本课题组前期对9种肝癌细胞系(包括Huh7、SMCC-7721、HepG2、MHCC97H、Huh6、SNU389等)采用細胞活性试验进行考察,选择出对DHA较为敏感的Huh7细胞和BEL-7402细胞进行后续研究。氨基酸是生命活动最重要的物质代谢基础,是细胞增殖分裂过程中的必需营养物质,肿瘤细胞对氨基酸的需求远大于正常细胞[11]。本课题组前期预试验结果显示,DHA对氨基酸代谢通路的影响最为明显,因此本研究采用GC-MS技术测定DHA作用后两种细胞中氨基酸代谢产物的变化,重点分析DHA对肿瘤细胞氨基酸代谢途径的影响。
GC-MS分析结果显示,用DHA干预处理后,两种肿瘤细胞中谷氨酰胺、富马酸、牛磺酸等氨基酸代谢物含量均呈明显下降趋势。对于正常细胞,谷氨酰胺是非必需氨基酸,但肿瘤细胞通过自身合成谷氨酰胺无法满足其快速增殖的要求,往往需要从外界摄人大量的谷氨酰胺,这意味着谷氨酰胺是肿瘤细胞的“必需氨基酸”[12-14],故肿瘤细胞对谷氨酰胺的摄取率均高于其他氨基酸。肿瘤细胞中的谷氨酰胺主要会被谷氨酰胺酶催化转变为谷氨酸,进一步又被谷氨酸脱氢酶催化形成酮戊二酸,最后进入三羧酸循环,实现对三羧酸循环的“回补”作用[15]。谷氨酰胺是血液和体内游离氨基酸池中含量最丰富的氨基酸,可在细胞内氧化并为其他氨基酸、蛋白质的合成提供氮源,而且参与了机体还原剂谷胱甘肽的合成[16-18]。因此,DHA对谷氨酰胺含量的降低作用可能使肿瘤细胞的生长受到抑制。富马酸也是三羧酸循环中的关键氨基酸[15],本研究中两种肿瘤细胞中富马酸含量的降低表明DHA可能通过三羧酸循环抑制肝癌细胞的生长。有文献报道,牛磺酸具有抗氧化、促进细胞生长、调节免疫功能的作用[19-20],本研究中两种肿瘤细胞中牛磺酸的含量降低明显,表明DHA可能通过下调该氨基酸从而抑制肝癌细胞的生长。
综上所述,DHA能明显降低Huh7细胞和BEL-7402细胞的活性,并能显著降低细胞中谷氨酰胺、谷胱甘肽、苯丙氨酸等的含量;两种肿瘤细胞的差异代谢物均富集到的通路为氨基酸-tRNA生物合成、天冬氨酸一丙氨酸一谷氨酸代谢、氮代谢、苯丙氨酸代谢、戊糖磷酸途径,提示DHA可能通过影响天冬氨酸一丙氨酸一谷氨酸代谢通路等机制来调控两种细胞的生长。然而,由于目前的研究证据不足,本研究仅重点探讨了某一条通路的相关作用机制,后续研究将根据相应氨基酸含量的变化进一步探索DHA对肿瘤细胞其他代谢通路的影响。
参考文献
[1] COSTES L,DUCREUX M, BOIGE V Systemic treatmentof hepatocellular carcinoma[J]. Oncologie, 2008, 10(3):191-196.
[2] ZHENG R, QU C, ZHANG S,et al. Liver cancer mci-dence and mortality in China: temporal trends and projec-tions t0 2030[J]. Chin,Cancer Res,2018, 30 (6):571-579.
[3]李鑫,王猛,代谢组学技术在肺癌早期诊断方面的研究进展[J].医学综述,2019,25(13):2605-2610.
[4]孙强,林翠华,探究色谱联用技术在药物分析中的应用特点和新趋势[J].临床医药文献电子杂志,2019,6(64):176-177.
[5]刘丹,孙洪胜,青蒿素及其衍生物的抗肿瘤作用研究进展[J].山东医药,2016,56(18):99-102.
[6]朱文赫,陈丽红,许娜,等,双氢青蒿素诱导人肝癌细胞SMMC-7721凋亡及其分子机制研究[J].中国药学杂志,2018,53(3):187-192.
[7]
CAO JT, MO HM, WANG Y, et al.Dihydroartemisinin-in-duced apoptosis in human acute monocytic leukemiacells[J]. Oncol Lett, 2018,15(3):3178-3184.
[8] JIANG LB, MENG DH, LEE SM, et al.Dihydroartemi-sinin inhibits catabolism in rat chondrocytes by activatingautophagy via inhibition of the NF-kappaB pathway[J].Sci Rep,2016. DOI: 10.1038/srep38979.
[9] ODAKA Y, XU B, LUO Y, et al. Dihydroartemisimn m-hibits the mammalian target of rapamycm-mediated signal-ing pathways in tumor cells[J]. Carcinogenesis,2014, 35(1):192-200.
[10]
MI YJ, GENG GJ, ZOU ZZ, et al.Dihydroartemisinin in-hibits glucose uptake and cooperates with glycolysis inhi-bitor to induce apoptosis in non-small cell lung carcinomacells[J]. PL oS One, 2015. DOI: 10.1371/j ournal.pone.012-0426.
[11]刘权焰,贺银成,氨基酸与肿瘤生长:文献综述[J].国外医学外科学分册,2000,27(3):158-161.
[12]
TSUN ZY, POSSEMATO R.Amino acid management incancer[J]. Semin CeH Dev Biol, 2015. DOI: 10.1016/j.semcdb.2015.08.002.
[13] CHA YJ, KIM ES, KOO JS, et al.Amino acid transportersand glutamine metabolism in breast cancer[J]. Int t, MolSci, 2018. DOl: 10.3390/ijms19030907.
[14]
ENGSKOG MK, ERSSON L, HAQLOF J, et al. p-N-Me-thylamino-L-alanine (BMAA) perturbs alanine, aspar-tate and glutamate meta- bolism pathways in human neu-roblastoma cells as determined by metabolic profiling[J].Amino Acids,2017 ,49(5):905-919.
[15] WANG M, YU F,Ll P,et al.Circular RNAs: characteris-tics, function and clinical significance in hepatocellularcarcinoma[J]. Cancers: Basel, 2018. DOI: 10.3390/can-cers10080258.
[16]
NEIS EP, SABRKHANY S,HUNDSCHEID I, et al.Hu-man splanchnic amino-acid metabolism[J]. Amino Acids,2017,49(1):161-172.
[17]
MARCHESE L, NASCIMENTO J,DAMASCENO F, eta1. The uptake and metabolism of amino acids, and theirunique role in the biology of pathogenic trypanosoma-tids [J]. Pathogens, 2018. DOI: 10.3390/pathogens7020036.
[18]
CHEN H, ZHENG YL, ZHAN J, et al. Comparative meta-bolic profiling of the lipid-producing green microalgachlorella reveals that nitrogen and carbon metabolic path-ways contribute to lipid metabolism[J]. Biotechnol Bio- fuels,2017. DOl: 10.118 6/s13 068-017-0839-4.
[19]向枭,曾本和,周兴华,等.不同脂肪条件下添加牛磺酸对鲤生长性能、体成分、肝胰脏生化指标及抗氧化能力的影响[J].水产学报,2018,42(12):1927-1939.
[20]赵晓芳,梁健,朱朝阳,等,天然牛磺酸联合中藥对肝星状细胞的影响[J]中国医学工程,2016.24(12):5-9.
(收稿日期:2019-03-14修回日期:2019-12-05)
(编辑:段思怡)
△基金项目:国家自然科学基金资助项目( No.81573661);广东医科大学帮扶专项资金项目( No.4SG19044G,No.4SG19057G)
*副教授,博士。研究方向:天然产物活性成分分离及药理作用。E-mail: 171087155@qq.com
#通信作者:教授,硕士生导师,博士。研究方向:中药及复方药效物质基础及作用机理。E-mail: tangyuling6688@163.com

