新型冠状病毒肺炎治疗中应关注肝损伤及防治中药概述
褚扬 周王谊 吴江 乔淼 王婉琦 马晓慧 周水平 郝海平
摘要 较大比例的新型冠状病毒感染者在接受抗病毒治疗过程中出现了肝功能异常现象,进而导致脓毒症或感染性休克的发生,需引起临床工作者的关注。多年来,中医药在临床用于肝损伤保护方面发挥了重要作用,其功效得到了普遍的肯定。本文将从新型冠状病毒所致肝损伤的机制、病毒和药物所致肝损伤的病理变化以及常用防治肝损伤的中药及其制剂进行综述,以期为新型冠状病毒肺炎(NCP)患者的肝损伤防治提供参考支持。
关键词 新型冠状病毒;肺炎;肝损伤;病理机制;炎性反应;中草药;中成药;中药药理
Abstract A large proportion of patients with severe acute respiratory syndrome coronavirus 2 infection showed abnormal liver function during the antiviral treatment,which led to sepsis or septic shock,thus causing widespread concern among clinicians. Over the years,traditional Chinese medicines (TCMs) have played an important role in the clinical application of liver injury protection,and its efficacy has been widely recognized. The paper reviewed the mechanism of liver injury caused by 2019-nCoV,the pathological changes of liver injury caused by viruses and drugs,and the TCMs and preparations commonly used to prevent and cure liver injury,in order to provide reference support for the prevention and treatment of liver injury in patients with Novel Coronavirus Pneumonia (NCP).
Keywords 2019-nCoV; Pneumonia; Liver injury; Pathological mechanism; Inflammation; Chinese herbal medicines; Chinese patent medicines; Pharmacology of Traditional Chinese medicines
中图分类号:R254.3;R256.19;R512.99文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.02.002
近期爆发于武汉并在全国蔓延的新型冠状病毒感染肺炎(Novel Coronavirus Pneumonia,NCP),是由一种全新的病原体所致,国际病毒分类委员会已将该病毒分类名为严重急性呼吸综合征冠状病毒2(Severe Acute Respiratory Syndrome Coronavirus 2),世界衛生组织(WHO)将由此病毒导致的疾病正式命名为新型冠状病毒疾病(Coronavirus Disease 2019,COVID-19),又称NCP。国家组织大量科研专家及工作者努力投入,对疾病认识和诊疗经验在不断深入,目前针对该病毒尚无临床确认的特效药物。针对COVID-19的防治方案仍在结合疾病的救治不断优化完善。
《柳叶刀》于2020年1月30日发文报道,在99例COVID-19患者中,有43例患者出现了不同程度的肝功能异常,其ALT与AST值分别比正常水平高出28%和35%,甚至有1例患者发生了严重的肝损伤(ALT 7 590 U/L,AST 1 445 U/L)[1]。另外,最新发布的《新型冠状病毒感染的肺炎诊疗方案(试行第五版)》中[2],已将抗病毒治疗纳入一般治疗原则,包括“试用α-干扰素雾化吸入、洛匹那韦/利托那韦,或加用利巴韦林”,同时也强调,“要注意洛匹那韦/利托那韦相关腹泻、恶心、呕吐、肝功能损害等不良反应”,提示在COVID-19患者的抗病毒治疗中可能发生药物性肝损伤。对于重型、危重型NCP患者,脓毒症是其的常见并发症,而肝损伤则是加重脓毒症和感染性休克的关键因素。
在2003年非典型肺炎(Severe Acute Respiratory Syndrome,SARS)的临床治疗中,也发现较多病例出现不同程度肝脏受损。一项研究追踪了294例SARS患者,发现24%患者入院时血清丙氨酸转氨酶(ALT)升高,近7成患者在随后的病程中ALT升高[3]。介于存在的肝损伤影响,《传染性非典型肺炎(SARS)诊疗方案(续)2004》中指出,病情监测中需定期查肝功能,有肝功能损害者,应采取对应治疗。此外还提到,部分SARS患者在出院后遗留有肝肾功能损害[4]。
无论是新型冠状病毒本身导致的肝损伤,还是在抗病毒治疗中所导致的药物性肝损伤,都需要针对患者尽早介入保肝治疗。传统中医学根据肝损伤的临床表现,将其归为“胁痛、癥积、黄疸、鼓胀”等范畴。中药以中医理论为指导,具有抗病毒、抗纤维化、退黄、降酶、改善肝功能、调节免疫功能等功效,在保肝方面发挥了重要作用[5]。本文将从新型冠状病毒所致肝损伤的机制、病毒和药物所致肝损伤的病理变化以及常用防治肝损伤的中草药及制剂进行综述,以期为COVID-19患者的肝损伤防治提供参考支持。
1 新型冠状病毒所致肝损伤的机制
新型冠状病毒感染属于免疫发病机制,病变开始主要在肺部,但随着病程进展全身器官均可累及。新型冠状病毒引起的炎性细胞因子风暴综合征是一种危及生命的疾病,促炎细胞因子中的肿瘤坏死因子(TNF)、白细胞介素-18(IL-18)可导致肝脏、肌肉、心脏和肾脏等多器官损伤。在此次COVID-19的临床救治中,上海援鄂专家也发现:COVID-19患者后期会很快启动炎性反应因子风暴,进入一种多器官功能衰竭的状态,而一旦进入这种状态将很难纠正,实际很多患者死于肺外多器官衰竭。
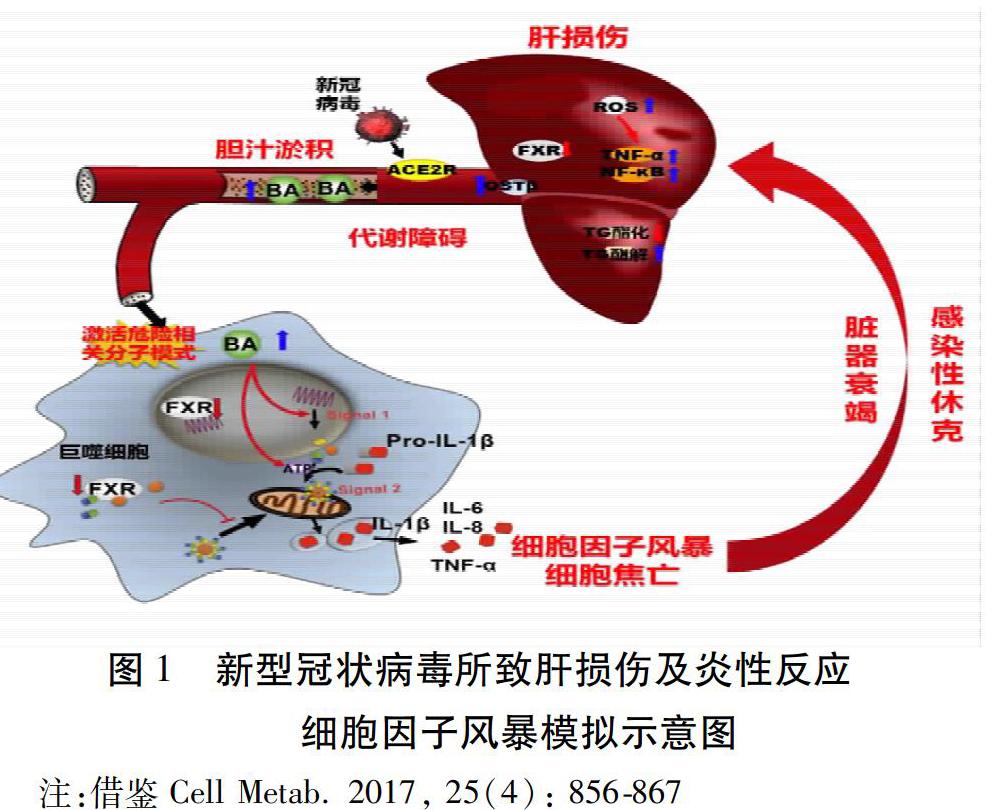
2020年2月3日,复旦大学生物医学研究院蓝斐,樊嘉等[6]教授在bioRxiv在线发文表明,新型冠状病毒可能直接与ACE2阳性胆管细胞结合。该发现表明SARS和新型冠状病毒患者的肝异常可能不是由于肝细胞损伤,而是胆管细胞功能障碍和其他原因,例如药物诱导的和全身性炎性反应引起的肝损伤。胆管作为肝脏内主要管道之一,其细胞占肝脏细胞总数的3%左右。胆管细胞是内衬于胆管树内表面的上皮细胞,负责将胆汁传输至胆囊及肠道。其具有细胞因子、炎性反应趋化因子、生长因子和血管生成因子等受体,可以与其他肝脏细胞如肝细胞、星状细胞和内皮细胞进行广泛的串话作用。胆管细胞损伤后会直接造成相关胆管病变,胆管病变继而导致肝脏的损伤。2019年,Aizarani等[8]在Nature杂志报道了来自9名肝脏捐献者的1万余个肝脏细胞测序的数据,该研究发现,肝细胞只有大约2.6%会表达ACE2,且表达的水平较低,而胆管细胞不仅表达ACE2的比例高,而其表达水平是肝细胞的20倍,和AT2细胞基本相当[8]。新型冠状病毒很可能像SARS和中东呼吸综合征(MERS)病毒一样,通过直接攻击胆管而导致肝损伤,而且胆管还影响着肝脏的免疫功能,这又有可能为免疫系统抗击肺炎带来不利的影响。
中国药科大学团队的研究显示[9],胆汁瘀积性肝损伤是脓毒症的常见并发症,也是加重脓毒症和感染性休克的关键因素。胆汁瘀积是胆管病变的重要临床发病原因,胆汁瘀积形成过程中,胆管细胞明显增生,增殖的胆管细胞通过直接的上皮-间质转变或间接激活其他肝脏细胞可以诱导肝损伤[10]。肝来源的胆汁酸可激发巨噬细胞的炎性反应小体NLRP3,DAMPs,也是导致炎性反应风暴的核心机制。
因此,可推测COVID-19引起的肝脏损伤由新型冠状病毒病毒感染引起机体炎性反应,新型冠状病毒与ACE2阳性胆管细胞结合可能引起胆汁瘀积,进一步激发炎性反应,继而进一步造成肝脏损伤、甚至是细胞因子风暴、引发脏器衰竭。见图1。
2 肝损伤的病理机制概述
肝脏在机体生命活动中发挥着重要的作用,不仅参与了蛋白质、糖及脂类的代谢,还参与了药物、乙醇等物质的体内代谢过程。同时肝脏也是各种致病因子或疾病常累及的器官,如病毒感染、药物、遗传性疾病(血色沉着病、威尔逊氏病、囊泡性纤维症)以及其他因素(包括胆结石、Budd-Chiari综合征、原发性硬化性胆管炎)等均可造成肝脏损伤[11]。而炎性反应是这些肝脏损伤的共同基础。
炎性反应是机体抵抗外界损伤因子所发生的防御性反应。多种激素、体液因子(炎性反应递质、促炎或抗炎因子)以及細胞黏附因子之间的相互作用共同构成了复杂的炎性反应调控网络[12]。其反应通路可概括为诱导物、感受细胞、炎性反应递质和靶组织4个步骤。在肝脏炎性反应中诱导物主要是病毒、药物及各种有害毒物。感受细胞包括库普弗细胞、中性粒细胞、内皮细胞等。这些感受细胞可通过不同的受体识别各种毒物,如病毒、病原体,继而通过c-jun氨基端激酶(JNK)、丝裂原活化蛋白激酶(MAPK)、蛋白激酶C(PKC)等信号通路启动和促进炎性反应因子的表达,其中NF-κB起主导作用。在炎性反应递质中,肿瘤坏死因子(TNF)-α及IL-1均可诱导NF-κB的表达,从而促进更多炎性反应递质生成,炎性反应细胞募集,活性增强,从而启动瀑布式炎性反应级联反应[13]。
尽管“炎性反应细胞浸润”是肝脏损伤的共同特征,但不同致病因素的发病机制及病理改变仍存在差异。免疫反应介导的肝细胞损伤是病毒性肝炎发病的主要机制。药物所致肝脏炎性反应则分为免疫性损伤和非免疫性损伤;当药物与体内成分结合成具有抗原性的新成分,引起部分人群过敏反应则导致免疫性损伤;当机体摄入过量的药物超过肝脏代谢能力,或机体药物代谢酶缺乏、酶活性较弱而引起的肝细胞损伤则为非免疫性损伤。
总之,肝脏炎性反应可见于几乎所有原因所致的肝损伤,并贯穿肝脏疾病病程始终。因此,抗炎保肝是肝病综合治疗的一部分,与抗病毒治疗相辅相成,互为优势。同时在治疗方式方面,也应从“治愈”向“治预”转变,早期的保肝预防及治疗尤为重要。
3 常用防治肝损伤的中药概述
保肝药物对肝损伤的治疗作用有多种不同的途径和机制,治疗效果也不尽相同。现代药理研究证实,很多中草药可通过调节线粒体功能、提高免疫调节、抗脂质过氧化、降低细胞中自由基、保护肝细胞膜等机制发挥保肝功效[14]。本文根据近年来国内外的相关研究,选择以下在肝损伤防治方面有代表性的中草药进行概述。
3.1 常用的单味中药及相关制剂
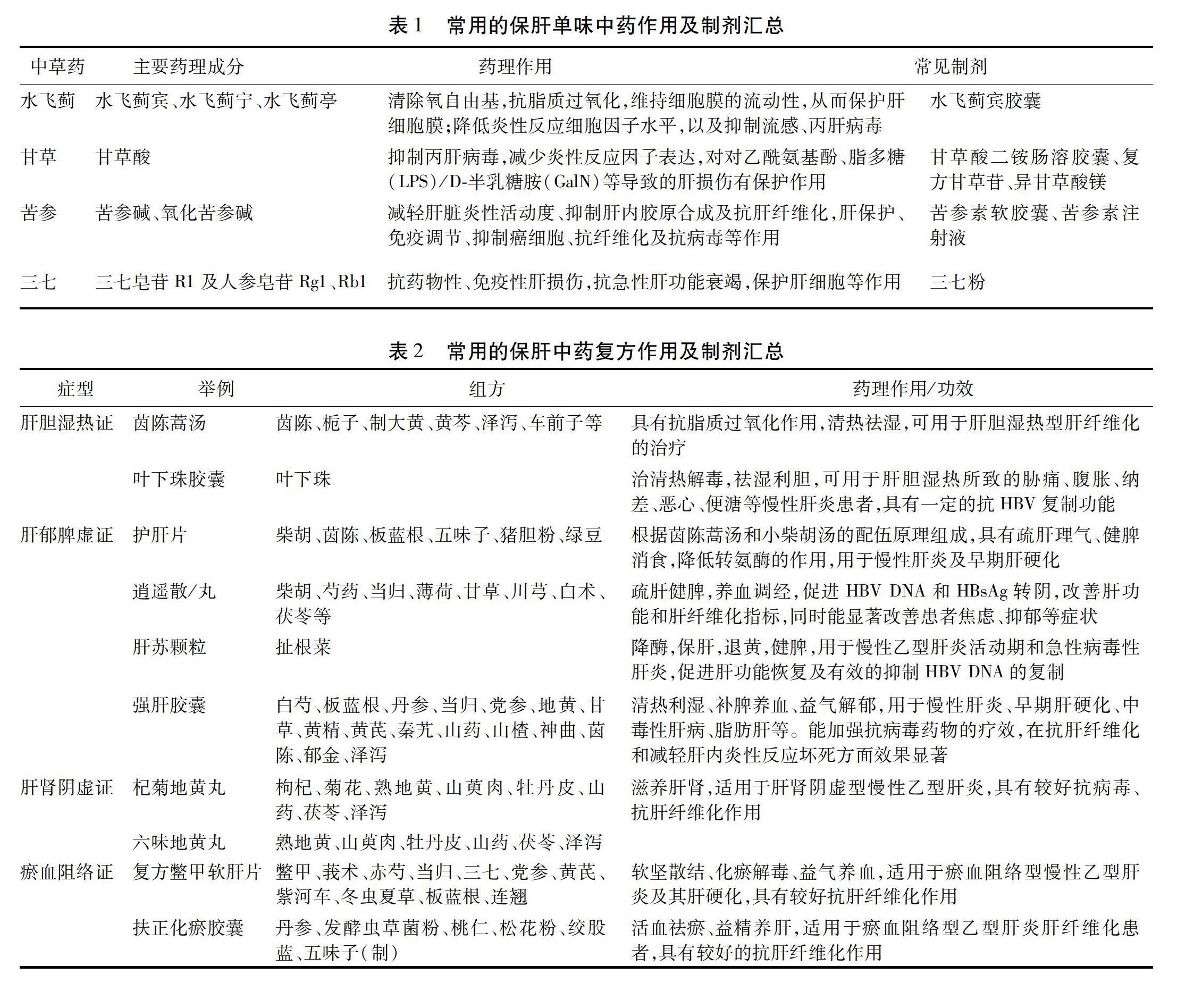
3.1.1 水飞蓟 水飞蓟素是从菊科植物水飞蓟果实中提取的总黄酮,含有水飞蓟宾、水飞蓟宁、水飞蓟亭、水飞蓟丁等成分,是目前公认具有保肝作用的中药,可通过抗脂质过氧化反应,维持肝细胞膜流动性,保护肝细胞膜;同时能够抑制中性粒细胞中超氧阴离子的释放,并直接抑制细胞因子对肝星状细胞的激活,起到抗肝纤维化作用。此外,活性成分水飞蓟宾还可通过抑制NF-κB降低多种炎性反应细胞因子水平,发挥抗炎作用;2013年一项针对水飞蓟宾衍生物的抗流感病毒研究结果表明,水飞蓟宾衍生物可抑制甲型流感病毒(IAV)感染。进一步研究表明,水飞蓟宾衍生物可以抑制Atg12-Atg5/Atg16异三聚体的形成和IAV感染引起的自噬升高。抑制IAV感染诱导的几种机制包括,降低氧化应激、细胞外信号调节激酶(ERK)/p38丝裂原激活蛋白激酶(MAPK)和IB激酶(IKK)通路的激活,以及自噬基因的表达[15]。此外,还有多篇文献证明水飞蓟宾及其衍生物对H1N1型流感病毒、丙肝病毒等具有明显的抑制作用[16-17]。水飞蓟制剂已被多部肝病诊疗指南列为抗炎保肝治疗药物,如水飞蓟宾胶囊用于急慢性肝炎、脂肪肝的肝功能异常的恢复[18]。
3.1.2 甘草 主要活性成分为甘草酸,甘草酸能够以剂量依赖的方式减少丙肝病毒浓度,且和干扰素联用具有协同作用,减小肝损伤,降低肝硬化和肝癌的发生率,发挥保肝作用。此外,甘草酸对对乙酰氨基酚所致肝损伤、CCL4所致肝损伤、脂多糖(LPS)/D-半乳糖胺(GalN)所致肝损伤具有一定的保护作用,能显著抑制ALT增加,减少炎性反应因子的表达[19]。活性成分甘草酸的分离提纯技术的更新将其应用逐渐推向现代化,最新一代的甘草酸制剂为新型口服甘草酸(甘草酸二铵肠溶胶囊),复方甘草酸苷,以及纯α体甘草酸制剂(异甘草酸镁)。不同甘草酸制剂作用机制基本一致,均具有明确的抗炎和保肝等作用,临床用途与水飞蓟制剂基本一致,还可用于肝硬化、肝衰竭及自身免疫性肝病的治疗[20]。
3.1.3 苦参 研究表明,苦参中具有保肝作用的活性成分为苦参碱与氧化苦参碱它们分别通过抑制肝星状细胞的增殖和下调肿瘤坏死因子、血清HA等途径发挥抗肝纤维化的作用。此外,苦参还具有肝保护、免疫调节及抗病毒等功能[21-22]。临床制剂有主要治疗肝炎的苦参素软胶囊、苦参素注射液等[23]。
3.1.4 三七 三七的保肝作用主要包括以下几个方面:1)抗肝纤维化作用[24]:三七皂苷可通过减少线粒体DNA ATP酶6、8亚基的突变,抑制线粒体中ATP的含量下降,进而延缓肝纤维化发生与发展;2)抗药物性肝损伤作用[25]:临床研究显示,三七与三苯氧胺联合应用能够显著降低患者ALT、AST及血脂水平,从而有效地保护肝功能;3)抗免疫性肝损伤作用[26]:三七总皂苷、总黄酮及三七多糖对免疫性肝损伤有明显的保护作用;4)抗急性肝功能衰竭作用[27]:三七皂苷可减轻AHF急性期肝损伤,促进肝细胞的增生修复及组织重构;5)保护肝细胞作用[28]:临床研究表明,三七总皂苷(PNS)对肝细胞病理患者的血流动力学参数均有一定程度的改善且优于常规观察组,充分说明PNS对肝细胞保护的作用以及预后观察中具有重要的应用价值;6)促进肝细胞再生[29]:研究发现三七皂苷通过激活小鼠PI3K/AKT/mTOR细胞增殖通路,调节AKT/Bad细胞信号通路,促进肝细胞再生。见表1。
3.2 常用的中药复方及制剂 此外,中医古籍以及多部肝病诊疗指南或专家共识中的中药复方主要通过以下途径起到肝脏保护作用[30-31]:1)清熱解毒利湿:代表药物有茵陈蒿汤、叶下珠胶囊、茵栀黄注射液等;2)疏肝理气:代表药物有护肝片、逍遥散、肝苏颗粒、强肝胶囊、芍药甘草汤等;3)滋肝补肾,益气养血:代表药物如杞菊地黄丸、六味地黄丸等;4)活血化瘀:代表药物如扶正化瘀胶囊、复方鳖甲软肝片等。现根据不同症型归纳如下。见表2。
4 小结
截止2020年2月13日23时,全国新型冠状病毒感染肺炎确诊59 907例,死亡1 368人。目前有关抗新型冠状病毒药物的研发,主要包括疫苗、化学药及中药等3个方面,但疫苗和化学药物的研发难度较大,周期过长,难解燃眉之急。而中医药在我国古代防治“疫病”斗争中,发挥了非常重要作用。特别是近十余年来,中医药在抗击SARS、禽流感、埃博拉等病毒性疾病过程中,发挥着特色优势作用,做出了举世公认的突出贡献[32]。
目前研究推测,NCP引起的肝损伤是由新型冠状病毒感染引起机体炎性反应,新型冠状病毒与ACE2阳性胆管细胞结合引起胆汁瘀积,进一步激发炎性反应,继而进一步造成肝脏损伤,甚至是细胞因子风暴,从而引发脏器衰竭。减轻炎性反应、保护肝脏对NCP患者应该是有益的,肾上腺皮质激素的应用就是为了减轻炎性反应,但皮质激素有许多不良反应,也并无保肝作用,因此只能选择性应用。此外,目前尚无明确可用于临床治疗肝损伤的化学或生物药物,常采用休息、饮食调节及维生素补充等方式予以干预,以避免肝损伤进一步加重。
我国的传统中医药在预防和治疗肝损伤方面的应用历史悠久,具有多组分、多靶点起效,不良反应较小等特点,因而备受临床青睐。近年来,大量药理研究也表明,如水飞蓟、甘草、苦参等中草药或相关复方制剂,均有不同程度的抗炎、抗纤维化、保护肝细胞等功效,临床应用可改善患者的肝脏生化指标。本文提示中药可能在COVID-19治疗过程中在肝损伤的防治方面起到积极作用,并应在治疗早期即给予保肝干预,值得临床探索。
参考文献
[1]Chen N,Zhou M,Dong X,et al.Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan,China:a descriptive study[J].The Lancet,2020,395(10222):391-393.
[2]国家卫生健康委员会.新型冠状病毒感染的肺炎诊疗方案(试行第五版)[EB/OL].(2020-02-05)[2020-02-04].http://www.nhc.gov.cn/yzygj/s7653p/202002/3b09b894ac9b4204a79db-5b8912d4440.shtml.
[3]Chan HL,Kwan AC,To KF,et al.Clinical significance of hepatic derangement in severe acute respiratory syndrome[J].World J Gastroenterol,2005,11(14):2148-2153.
[4]中华医学会,中华中医药学会.传染性非典型肺炎(SARS)诊疗方案(续)[J].现代实用医学,2004,16(3):172-183.
[5]郭伟锋,梁彦彦.中药治疗病毒性肝炎的疗效观察[J].中国医药指南,2011,9(31):184-185.
[6]Chai X,Hu L,Zhang Y,et al.Specific ACE2 Expression in Cholangiocytes May Cause Liver Damage After 2019-nCoV Infection[J].bioRxiv,(2020-02-15)[2020-01-13].https://www.instrument.com.cn/download/shtml/932534.shtml.
[7]Roberts S K,Larusso NF.Pathobiology of biliary epithelia[J].Biochimica Et Biophysica Acta,1994,10(5):526-533.
[8]Aizarani N,Saviano A,Mailly L,et al.A human liver cell atlas reveals heterogeneity and epithelial progenitors[J].Nature,2019,572(7768):199-204.
[9]Hao H,Cao L,Jiang C,et al.Farnesoid X Receptor Regulation of the NLRP3 Inflammasome Underlies Cholestasis-Associated Sepsis[J].Cell Metab,2017,25(4):856-867.
[10]Robertson H,Kirby JA,Yip WW,et al.Biliary epithelial-mesenchymal transition in posttransplantation recurrence of primary biliary cirrhosis[J].Hepatology,2007,45(4):977-981.
[11]Wallace K,Burt AD,Wright M C.Liver fibrosis[J].Biochem J,2008,411(1):1-18.
[12]王伯瑤,黄宁,吴琦.炎性反应Toll信号传导通路[J].中国病理生理杂志,2000,16(6):567-571,576.
[13]Lee LK,Bryant KJ,Bouveret R,et al.Selective inhibition of human group IIA-secreted phospholipase A2 (hGIIA) signaling revealsarachidonic acidmetabolism is associated with colocalization ofhGIIA to vimentin in rheumatoid synoviocytes[J].J Biol Chem,2013,288:15269-15279.
[14]梁丽,毕倩,董金材,等.具有保肝作用的天然药物开发进展[J].生物资源,2018,40(2):148-158.
[15]Ikeda T,Abe K,Kuroda N.The inhibition of apoptosis by glycyrrhizin in hepatic injury induced by injection of lipopolysaccharide/D-galactosamine in mice[J].Arch Histol Cytol,2008,7(3):163-178.
[16]Dai JP,Wu LQ,Li R,et al.Identification of23-(S)-2-Amino-3-Phenylpropanoyl-Silybin as an Antiviral Agent for Influenza A Virus Infection In Vitro and In Vivo[J].Antimicrob Agents Chemother,2013,57(9):4433-4443.
[17]Radek G,Kate P,Marhol P,et al.Antioxidant and antiviral activities of silybin fatty acid conjugates[J].Eur J Med Chem,2010,45(3):1059-1067.
[18]水飞蓟制剂肝病临床应用专家委员会.水飞蓟制剂肝病临床应用专家共识[J/CD].中华实验和临床感染病杂志(连续型电子期刊),2016,10(5):517-521.
[19]Lee CH,Park SW,Kim YS.Protective Mechanism of Glycyrrhizin on Acute Liver Injury Induced by Carbon Tetrachloride in Mice[J].Biol Pharm Bull,2007,30(10):1898-1904.
[20]甘草酸制剂肝病临床应用专家委员会.甘草酸制剂肝病临床应用专家共识[J].临床肝胆病杂志,2016,32(5):844-852.
[21]张明发,沈雅琴.氧化苦参碱治疗肝纤维化的临床评价研究进展[J].药物评价研究,2019,42(12):2484-2491.
[22]桑秀秀,王睿林,韩延忠,等.氧化苦参碱通过免疫调节保护刀豆蛋白A诱导的小鼠免疫性肝损伤[J].中国实验方剂学杂志,2017,23(6):125-130.
[23]陈德永,郝延如.苦参素(沃森干泰)软胶囊治疗慢性病毒性肝炎的优势[J].传染病信息,2005,18(z1):57.
[24]李剑瑜,刘鹏年,张霞,等.三七皂甙Rg1、Rb1对肝纤维化大鼠线粒体DNA三磷酸腺苷酶6、8亚基的作用机制研究[J].环球中医药,2014,7(8):591-595.
[25]黄梅,童彩玲,李本珊.三七对三苯氧胺相关肝损伤影响的临床研究[J].新中医,2011,43(3):39-41.
[26]韦维,黄永秩,梁柳丹,等.三七有效成分对免疫性肝损伤的保护作用[J].天津医药,2014,42(9):893-895.
[27]任龙海,乐瑛,陈林,等.三七皂苷促进急性肝功能衰竭大鼠肝脏修复的实验研究[J].中国药业,2007,16(15):20-21.
[28]禹白絮.三七总皂苷对肝细胞保护作用机理[J].医学信息,2014,27(2):132-133.
[29]Zhong H,Wu H,Bai H,et al.Panax notoginseng saponins promote liver regeneration through activation of the PI3K/AKT/mTOR cell proliferation pathway and upregulation of the AKT/Bad cell survival pathway in mice[J].BMC Complem Altern Medicine,2019,19(1):122-130.
[30]中国中西医结合学会肝病专业委员会.肝纤维化中西医结合诊疗指南(2018年版)[J].现代医药卫生,2019,35(15):2424.
[31]刘峘,王融冰,谢雁鸣,等.护肝片临床应用专家共识[J].中国中药杂志,2019,44(14):2943-2946.
[32]田景振,杨振宁.中医药抗病毒研究思路理论创新与基本路径[J].山东中医杂志,2018,37(6):439-444.
(2020-02-14收稿 责任编辑:王明)

