白刺链霉菌(Streptomyces albospinus)CT205产环己酰亚胺含量测定方法的建立
王小姣,李梦雅,王世梅
(南京农业大学资源与环境科学学院 江苏省固体有机废弃物资源化高技术研究重点实验室 江苏省有机固体废弃物协同创新中心教育部资源节约型肥料工程技术研究中心,江苏 南京 210095)
白刺链霉菌(Streptomycesalbospinus)CT205是本实验室分离保存的1株拮抗放线菌,其生防制剂防控黄瓜枯萎病、草莓根腐病等效果显著[1-2]。孙敏等[3]对S.albospinusCT205发酵液中活性物质物质进行了分离纯化,并借助色谱分析,确定活性物质为环己酰亚胺 (Cycloheximide),又称放线酮。在农业应用上,环己酰亚胺主要用于植物病虫害的防控[4-6],在医学及分子生物学领域,环己酰亚胺主要作为蛋白质合成抑制剂,应用于蛋白表达、细胞凋亡机制等代谢调控方面的研究[7-9]。建立定量、快速检测菌株CT205发酵产生的活性物质环己酰亚胺含量的方法,是亟需解决的问题。本研究利用高效液相色谱法(HPLC)、生物活性法及分光光度法等检测手段分别测定菌株CT205发酵上清液及粗提物中活性物质的含量,以期建立合适的检测方法,为菌株CT205的开发利用提供技术支持。
1 材料与方法
1.1 材料
1.1.1菌株 白刺链霉菌(Streptomycesalbospinus)CT205;啤酒酵母(Saccharomycescerevisiae),本实验室分离保存[2]。
1.1.2 培养基 ①PDA培养基:马铃薯200.0 g(去皮),葡萄糖20.0 g,琼脂20.0 g,去离子水定容至1 000 mL,pH值自然;②种子培养基: 黄豆粉30.0 g,葡萄糖45.0 g,酵母粉5.0 g,CaCO35.0 g,去离子水1 000 mL,pH值7.5;③发酵培养基:可溶性淀粉30.0 g,蔗糖20.0 g,黄豆粉8.0 g,CaCO33.0 g,蛋白胨2.0 g,NaCl 2.0 g,MgSO4·7H2O 0.5 g,K2HPO4·7H2O 0.5 g,去离子水1 000 mL,pH 8.0。
1.1.3 试剂与仪器 环己酰亚胺标准品(北京索莱宝科技有限公司),甲醇、乙酸乙酯(色谱纯),其他试剂均国产分析纯试剂(国药集团化学试剂有限公司)。1260 Infinity Ⅱ高效液相色谱仪(柱子ZORBAX Eclipse Plus C18,4.6 mm×100 mm,3.6-Micron,Agilent公司),离心机 (Eppendorf-5424 R,德国 Eppendorf 公司),酶标仪(Spectra Max i3x,美谷分子(上海)仪器有限公司),Greiner Bio-one 96孔板(UV-STAR Microplate 96 Well,格瑞纳生物科技(上海)有限公司)。
1.2 方法
1.2.1 菌株CT205液体发酵及活性物质粗提物制备 取菌株CT205新鲜斜面,用接种环刮取1~2环CT205孢子接种于含50 mL种子培养基的250 mL的三角瓶中,28 ℃、170 r/min培养48 h,镜检观察菌丝形态。将新鲜的液体种子按10% (体积分数)接种量接种于含200 mL发酵培养基的1 000 mL三角瓶中,28 ℃,170 r/min 培养96 h,4 ℃,8 000 r/min离心10 min,取上清液备用。取100 mLV(上清液)∶V(乙酸乙酯)=1∶1混合,震荡萃取,8 000 r/min离心5 min,取酯相,旋转蒸发仪浓缩至干,3.0 mL甲醇洗脱溶解所得物质为活性物质粗提物。
1.2.2 环己酰亚胺标品制备 精确称取100.0 mg环己酰亚胺标准品,先用少量无菌去离子水溶解,然后加入无菌去离子水配置成1 mg/mL的标准母液。取50 mL容量瓶9只,向各瓶内分别加入不同量的1 mg/mL的标准品母液,去离子水定容至刻度,制备含环己酰亚胺10、20、30、40、50、60、70、80、90 μg/mL系列梯度的标准品稀释液。
1.2.3 高效液相色谱法(HPLC)测定环己酰亚胺含量 取系列浓度的环己酰亚胺标准品,使用高效液相色谱仪,在柱温30 ℃,流动相V(MeOH)∶V(H2O)= 55∶45条件下,等度洗脱,检测波长215 nm,进样量5 μL,分析时间10 min,记录峰面积,横坐标X轴为环己酰亚胺浓度,纵坐标Y轴为峰面积,绘制标准曲线,计算线性回归方程。并在该条件下测定粗提物及发酵上清液中活性物质的含量。
1.2.4 生物活性法测定环己酰亚胺含量 ①指示菌啤酒酵母菌悬液制备:将酵母菌接种于PDA液体培养基(不加琼脂)中,28 ℃、170 r/min 培养48 h,显微计数并调整细胞浓度为108个/mL,备用。②双层平板制备:取直径150 mm,高30 mm的培养皿,下层倒入50 mL 2%的水琼脂保证底部平整,取2 mL的酵母菌(108个/mL)加入100 mL PDA培养基(55~60 ℃)混匀,倒入底层平板上,制备双层平板。在双层平板上等距离均匀放置无菌牛津杯,分别加入200 μL系列浓度的标品溶液,无菌去离子水作为空白对照,28 ℃培养,5次重复试验。③抑菌圈测量记录:待双层平板上出现抑菌圈后,测量抑菌圈直径大小,以不同浓度环己酰亚胺为横坐标,抑菌圈直径为纵坐标,绘制标准曲线,计算线性回归方程。并用此法测定粗提物及发酵上清液中活性物质的含量。
1.2.5 分光光度法测定环己酰亚胺含量 取1.2.2中制备的系列浓度的标准品,分别取200 μL加入96孔板中,在酶标仪λ=215 nm处测得各稀释液的吸光度(A),以不同浓度环己酰亚胺为横坐标,吸光度(A)为纵坐标,绘制标准曲线,计算线性回归方程。并用此法测定粗提物及发酵上清液中活性物质的含量。
2 结果与分析
2.1 HPLC测定环己酰亚胺含量方法的建立
环己酰亚胺经紫外扫描在λ=215 nm处有最大吸收峰[3](图1),1 mg/mL环己酰亚胺标样HPLC图谱见图2,在215 nm波长下可分离得到4个峰,多次重复实验发现,在相同的HPLC条件下,环己酰亚胺均出现相同的4个峰,由表1可见2.417 min出现的最大吸收峰,峰面积占98.23%,1.053、2.034 min出现的2个小峰可能是溶剂峰,可以确定环己酰亚胺的出峰时间为2.417 min。从表2可以看出,环己酰亚胺系列稀释液的出峰时间均在2.41 min左右,0~90 μg/mL环己酰亚胺的峰面积与浓度建立的回归方程:Y= 4.083 6 x+ 16.513,R2= 0.999 2,二者间呈现较好的线性关系(图3)。说明HPLC法测定环己酰亚胺的可行性。
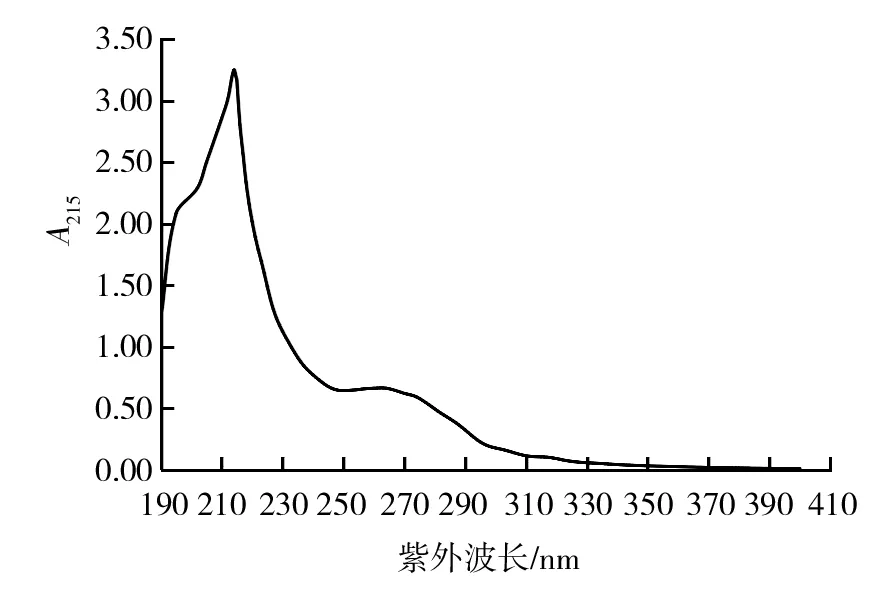
图1 环己酰亚胺紫外吸收光谱图Fig.1 Ultraviolet absorption spectra of Cycloheximide
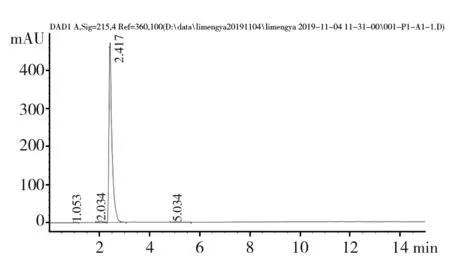
图2 1 mg/mL环己酰亚胺标样HPLC图谱Fig.2 HPLC spectrogram of 1 mg/mL Cycloheximide standard sample
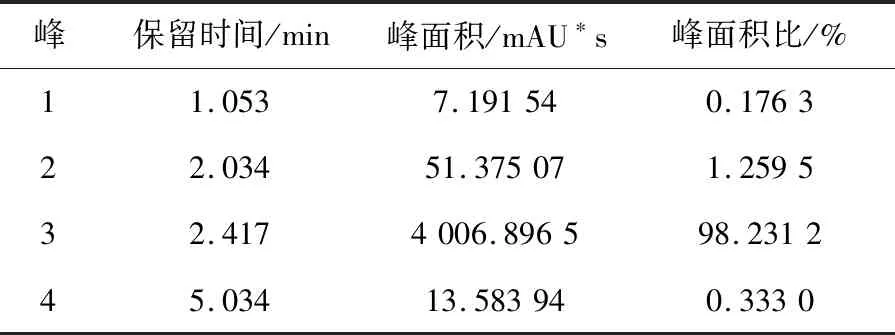
表1 HPLC检测环己酰亚胺标品出峰情况
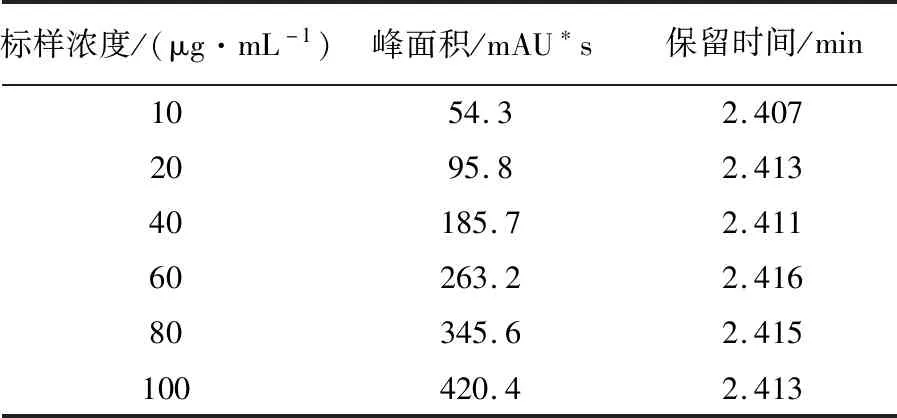
表2 HPLC检测系列浓度环己酰亚胺的峰面积值

图3 HPLC测定环己酰亚胺标准曲线Fig.3 The determination of Cycloheximide content standard curve by HPLC method
在相同条件下,菌株CT205发酵上清液经HPLC检测,在2.413 min出现吸收峰(与标样的出峰时间2.417 min相差0.04 min),峰面积314.1 mAU*s。粗提物经HPLC检测,在2.396 min出现吸收峰(与标样的出峰时间2.417 min相差0.021 min),峰面积6 369.4 mAU*s。将数值分别带入回归方程,计算上清液活性物质的含量为72.87 μg/mL,粗提物中活性物质的含量为1 555.70 μg/mL。
2.2 生物活性法测定环己酰亚胺含量方法的建立
生物活性测定法检测抗生素含量能反映真实的生物学效应。由表3和图4可见,当环己酰亚胺标样质量浓度在0~90 μg/mL时与酵母菌拮抗圈直径呈现较好的线性关系,重复实验发现线性稳定,建立环己酰亚胺标准曲线方程:Y=0.029 3x+1.755 6,R2=0.993 7。
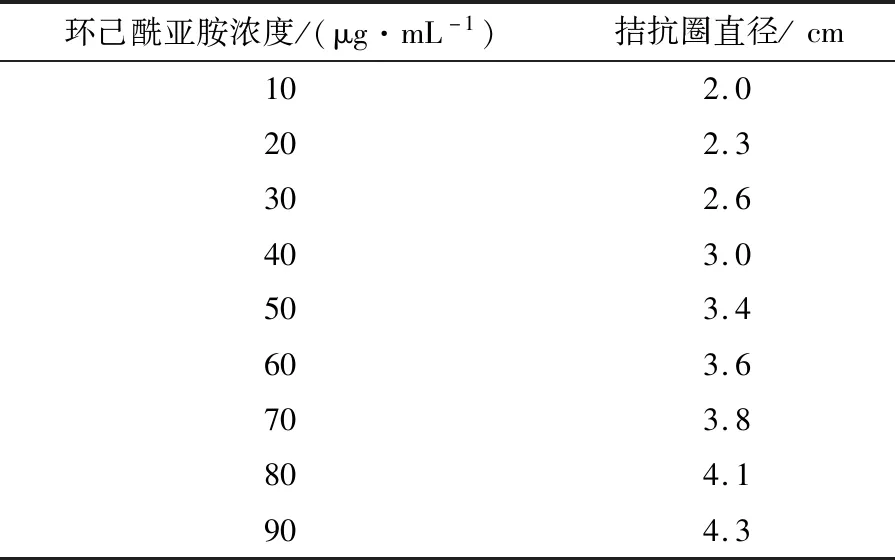
表3 不同系列浓度环己酰亚胺对应的拮抗圈直径
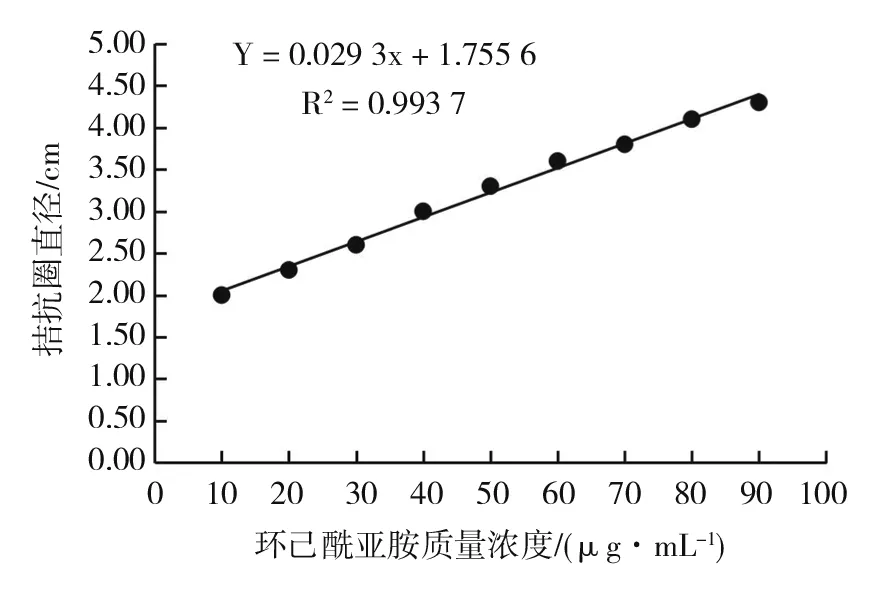
图4 生物活性法检测环己酰亚胺的标准曲线Fig.4 The standard curve of Cycloheximide by bioactivity method
利用生物活性法检测菌株CT205发酵上清液及粗提物中活性物质的含量,粗提物用无菌水稀释20倍,量取对酵母菌的拮抗圈直径,分别带入回归方程,计算出上清液活性物质的平均含量为66.15 μg/mL,粗提物中活性物质的含量为1 259.00 μg/mL。
2.3 分光光度法测定环己酰亚胺含量方法的建立
环己酰亚胺的最大紫外吸收峰在λ=215 nm处,由表4和图5可以看出,0~90 μg/mL系列浓度的环己酰亚胺与其在215 nm的吸光度(A)有较好的线性关系,建立的回归方程为Y=0.004 8x+0.000 5,R2=0.996 5。取菌株CT205发酵上清液及粗提物进行紫外扫描,在215 nm处均没有典型吸收峰出现,CT205发酵上清液紫外吸收图谱见图6。
从图6可以看出,CT205发酵上清液在215 nm处没有典型吸收峰,说明发酵上清液中杂质较多、活性物质的含量较低。同样,测定粗提取物紫外吸收图谱,发现粗提取物在紫外吸收区域亦无典型吸收峰。因此,不能直接用分光光度法测定发酵上清液与粗提取物中活性物质的含量。

表4 不同浓度的环己酰亚胺对应的吸光度(A215)

图5 紫外分光光度法测定环己酰亚胺的标准曲线Fig.5 The standard curve of Cycloheximide measured by UV spectrophotometry
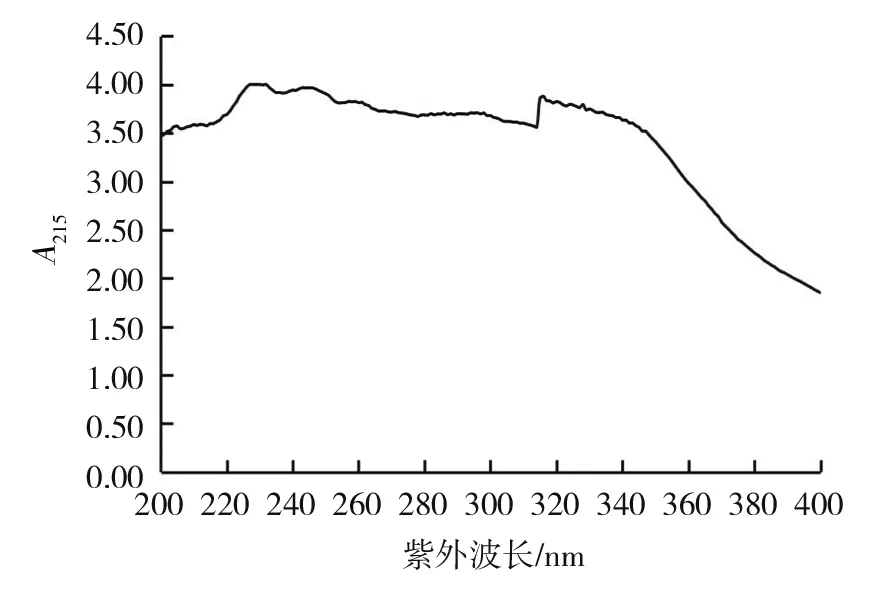
图6 CT205发酵上清液紫外吸收图谱Fig.6 Ultraviolet absorption spectrum of fermentation supernatant from strain CT205
2.4 HPLC和生物活性法检测环己酰亚胺含量方法比较
取离心得到的菌株CT206发酵上清液用HPLC和生物活性法检测环己酰亚胺含量,由表5可以看出上清液HPLC及生物法检测到环己酰亚胺的含量分别为72.87、66.15 μg/mL。两种测定方法得到的结果存在一定的误差,实验发现HPLC测定结果与生物标线法测定结果误差为+6.72 μg/mL。理论上HPLC测定方法较生物标线法准确性高,灵敏度也高,但无法消除仪器设备的客观影响,多次实验发现,相同的样品在不同时间段测定,样品出峰时间存在一定偏差,如标品出峰时间2.417 min,样品2.413 min,甚至2.396 min,但误差均在实验允许时间误差间(±0.1 min),因此测定样品时,一般先测定标品,再测定样品。两种测定方法平行6次检测发酵液中环己酰亚胺含量,两种测定方法的相对标准偏差RSD顺序依次为RSD生物活性法>RSDHPLC法,说明HPLC测定结果具有更好的重现性、更高的可信度。经统计学t检验法发现两种测定方法实际测定同一样品时环己酰亚胺的含量间存在显著差异,需要根据实验需求选择合适的测定方法。

表5 HPLC及生物活性法测定CT205菌株发酵液中环己酰亚胺含量方法比较Table 5 Comparison of HPLC and bioactivity method for the determination of Cycloheximide in the fermentation
3 讨 论
放线菌是重要的抗生素产生菌,其代谢产物中具有抗生活性的物质多达10 000余种,是新型抗生素开发的宝贵资源库[10]。环己酰亚胺又名放线酮,是一种戊二酰类化合物,早在1948年由德国化学家Ford和 Leach从灰色链霉菌(S.griseus)中分离并鉴定出结构[11],后期也有学者在不同链霉菌发酵产物中检测到[12-13]。环己酰亚胺作为广谱抗生素在体外可以抑制大多数真核生物蛋白的合成,在防治农作物真菌病害上应用广泛[14-15]。抗生素的检测方法主要有生物法、色谱法、化学法[16-18]等。不同抗生素因其特有的特性官能团,实际使用的检测方法也千差万别,同种抗生素可由不同生物产生,产量也存在差异,选择适当检测手段,可以加快研究进展。
本研究用三种方法检测了菌株CT205发酵上清液及粗提物中活性物质环己酰亚胺含量,三种方法检测环己酰亚胺标样均呈现较好的线性关系,其中HPLC法相关系数R2=0.999 2,较生物活性法与分光光度法具有更好地检测吻合度。HPLC法具有灵敏度高,分离性能好,检出限低等优点,但实际分析样品时,需要有高效液相色谱仪(HPLC),需要提前准备流动相、平衡柱压,实验结束后冲洗柱子等,操作步骤繁琐。生物活性测定法,选用酵母菌作为指示菌,其生长繁殖迅速,可一次性检测多个样品,抑菌圈能反映真实的生物学效应,不需特殊设备,操作简便,但不同实验人员操作存在差异,与HPLC测定结果相比精确度不高。分光光度法操作简单,检测快速,但是不适合用在特定波长没有典型吸收峰,含有杂质较多的样品。
从方便实用的角度看,生物活性法适用于比较多批次菌株CT205发酵液中活性物质含量及评估,如菌株的诱变筛选及发酵条件优化等,准确度要求不高;HPLC法精确度高,可以精准测定发酵液及粗提物中活性物质含量,用于准确定量测定;分光光度法仅适用纯度较高的样品测定。