糖苷水解酶7家族蛋白在纤维素降解中作用的研究进展
高小晓,孟 虹,李 蓉,李宪臻
(大连工业大学 生物工程学院,辽宁 大连 116034)
天然纤维素是由葡萄糖单元以β-1,4-键连接组成的一类大分子多糖物质,结构上具有无序(不定形)和高度有序(结晶)区域。近几年来,提倡通过绿色环保的生物法降解纤维素,将其转化为可发酵的糖,并被微生物发酵产生乙醇,作为化石燃料的替代品。在生物降解中,纤维素的降解是通过不同纤维素酶复合酶制剂协同进行的[1]。糖苷水解酶7家族(glycoside hydrolases 7 family, GH7)是来源于真菌的纤维素水解酶,包括内切葡聚糖酶和外切葡聚糖酶。此家族具有共同的蛋白结构特征,多个loop区围绕反向平行的β-折叠形成的β-三明治结构的催化结构域[2]。近年来,有17个GH7蛋白的晶体结构得到解析,可帮助确定酶的催化活性位点、底物识别及结合位点,从而明确酶的结构与功能之间的关系,对GH7成员、分类和序列以及三维结构特点与催化纤维素降解功能关系的研究进展进行阐述。
1 GH7的分布及组成
目前已报道的GH7蛋白常见于真菌以及部分线虫体内,如尖孢镰孢菌(Fusariumoxysporum)、里氏木霉(Trichodermareesei)、哈茨木霉(Trichodermaharzianum)、烟曲霉(Aspergillusfumigatus)、稻瘟病菌(Humicolagrisea)、裸露腐霉(Humicolainsolens)和盘基网柄菌(Dictyosteliumdiscoideum)等[3-8],部分成员除了含有GH7催化结构域外,还含有碳水化合物结合结构域(Carbohydrate-Binding Domain,CBD)。
GH7成员酶蛋白根据其作为底物结合催化区域不同,可分为作用于不定形区随机水解β-1,4-键的内切葡聚糖酶(endo-β-1,4-glucanase, EC 3.2.1.4)和作用于结晶区的纤维素链末端以持续水解切割纤维二糖单元的外切葡聚糖酶(又称纤维二糖水解酶,cellobiohydrolase, EC 3.2.1.91)两大酶类。
1.1 GH7内切葡聚糖酶
内切葡聚糖酶广泛存在,根据其保守序列和结构特征分类,其存在于16个糖苷水解酶家族中[9-10],属于GH7的内切葡聚糖酶,具有广泛的底物特异性,对纤维素、大麦β-葡聚糖、地衣多糖、海带多糖和木聚糖均具有催化活性,在各种工业应用中具有潜在的吸引力[11-12]。例如,来源于Asperillufumigatus的GH7内切葡聚糖酶对羧甲基纤维素、β-葡聚糖和木葡聚糖均有催化活性,且在极端pH范围(3.0~8.0)内保持高度稳定性,55 ℃热稳定性高达72 h。协同Celluclast®1.5 L混合鸡尾酒法可提高对天然纤维素甘蔗渣、玉米芯、稻草和豆秸的水解效率,使其在第二代生物燃料生产以及其他生物精炼工艺中的复配酶制剂方面具有重要的应用前景[5]。
1.2 GH7外切葡聚糖酶
GH7成员外切葡聚糖酶存在于许多降解纤维素真菌中,是其分泌的降解纤维素酶系中的主要组成部分,可作用于结晶纤维的还原端,通过持续性水解单个纤维素链而反复释放纤维二糖,在纤维素降解过程中起着关键的作用[13-15]。同其他糖苷水解酶一样,该酶能有效加快晶体纤维素中糖苷键的水解速率,可提高约1017倍,使其是目前已知的最高效的催化剂之一。来源于Trichodermareesei的TrCel7A 是研究最为广泛的外切葡聚糖酶,也是目前商品化复配纤维素酶制剂的主要成分之一[15]。来源于Penicilliumoccitanis菌株的GH7外切葡聚糖酶则具有更高比活性,预处理玉米秸秆和微晶纤维素在24~96 h内转化率比TrCel7A的作用提高1.3~1.5倍,同时对纤维二糖和木质素衍生化合物的敏感性较小,具有更大的应用潜力[16]。
2 GH7蛋白序列特点
相比较于其他的糖苷水解酶家族,GH7成员进化具有非常高的保守度。GH7蛋白在真菌和一些低端真核生物,例如变形虫及甲壳动物等中被发现,但在原核生物中至今没有发现[8]。经过十多亿年间的分化,生物之间序列仍保持着40%的同源性。同源序列多与底物结合区域及活性口袋相关[8]。Segato等[17]通过研究曲霉来源的2个外切葡聚糖酶,确定Trp38、Tyr168、Asp170、Glu209、Asp211、Glu214、Trp371和Trp380等催化相关残基和底物通道相关氨基酸是完全保守的。GH7成员中,内切葡聚糖酶与外切葡聚糖酶相比具有较高序列多样性,导致其具有较大的结构变异,因此GH7内切葡聚糖酶对多种多糖底物有催化能力,具有广泛的底物特异性。
GH7成员含有多个半胱氨酸且形成大量的二硫键。例如来源于Talaromycesemersonii的TeCel7A酶序列中的10个半胱氨酸分别组成5个二硫键:Cys4-Cys72、Cys54-Cys191、Cys190-Cys200、Cys243-Cys375和Cys266-Cys320(图1)[18]。多个二硫键有助于维持蛋白结构的稳定性,因此GH7成员最适反应温度多为45~65 ℃,且具有较高的热稳定性。如Chaetomiumthermophilum与Acremoniumhermophilum来源的 GH7蛋白最适反应温度为60~65 ℃;TeCel7A的最适反应温度为55 ℃,在60 ℃孵育20 h后仍保持90%酶活性;TeCel7A酶在80 ℃,68 min后,可保持50%的酶活性[19-20]。

图1 来源于T.emersonii的TeCel7A蛋白结构[18]Fig.1 The three-dimensional structure of TeCel7A from the T.emersonii[18]
3 GH7蛋白结构与功能
目前,PDB数据库(Protein Data Bank, http://www.rcsb.org/pdb/)已保存了17个GH7成员的结晶结构,尽管表达GH7成员蛋白的生物种类繁多,但GH7酶的整体折叠具有相似性。GH7蛋白一般含有1个催化结构域,又称GH7保守结构域(Conserved Domain,CD)和1个CBM(Carbohydrate-Binding Module,CBM)结合模块(一般是由35个左右具有很强的序列相似性的氨基酸形成的多肽链)[3]。 GH7蛋白催化结构域是由多个loop区围绕反向平行的β-折叠形成的β-三明治结构组成。GH7成员内切葡聚糖酶和外切葡聚糖酶均含有此催化结构域,但是这两种酶具有完全不同的水解特性。催化中心的不同结构导致酶与底物结合方式及催化过程不同[21]。通过对多个GH7成员的晶体结构解析,发现GH7成员内切葡聚糖酶和外切葡聚糖酶主要因为存在于活性中心以外的一些loop区以及表面区域的微小的差异,而影响到酶与底物的结合[3,21-22]。如来源于Trichodermareesei的外切葡聚糖酶TrCel7A在活性中心外含有loop区,形成封闭的隧道状活性位点,而内切葡聚糖酶TrCel7B缺少活性中心位点上的loop区,使催化中心成开放的裂缝区,这使得内切葡聚糖酶能够进入纤维素内部区域并将纤维链切割成较短的片段成为纤维寡糖,释放出更多的自由端(图2)。

图2 来源于Trichoderma reesei的外切葡聚糖酶TrCel7A(A)和TrCel7B(B)蛋白结构[23]Fig.2 The structures of GH7 enzymes from Trichoderma reesei[23]TrCe17A(A) (PDB Code:4C4C) 和 TrCe17B(B) (PDB Code:1EG1)中重要的loop区The major loops of TrCel7A (PDB code:4C4C) and TrCel7B (PDB code:1EG1)
CBM结合模块在空间结构上通过2~3个二硫键稳定其三维构象,利用CBM结合模块的平面上所含有的保守芳香族氨基酸残基(酪氨酸、色氨酸或组氨酸)与底物纤维素表面结合[24-25]。但是CBM并不是必须的,部分GH7蛋白有CBM结合模块。例如Aspergillus菌属菌株中同时存在含有CBM结合模块和无CBM结合模块的两种GH7外切葡聚糖酶的现象[2]。 Segato等[26]对同一来源的两个不同GH7外切葡聚糖酶进行了研究,结果表明,这两种酶具有高度保守的催化结构域和相似的催化性能,并发现CBM会影响酶与底物的识别和结合,含有CBM的Cbh1为与底物结合酶,而未含有CBM的CelD为非结合底物酶,且热稳定性高于CelD,并降低葡萄糖的抑制敏感性。
4 GH7蛋白降解纤维素的作用机制
随着科学技术的发展,越来越多的研究者通过分子动力学模建以及透射电子显微镜(TEM)和原子力显微镜(AFM)等新型技术及仪器可视化研究GH7蛋白降解纤维素的作用过程[27-28]。GH7外切葡聚糖酶作用于纤维素链的还原端,经过一系列反应水解单纤维素链,如图3所示,水解过程:①GH7外切葡聚糖酶通过其含有的CBM结合模块吸附于结晶纤维素表面;②促使纤维素解聚,形成纤维素单链,进入酶分子内部空腔并与酶的底物结合位点结合;③通过活性中心催化三联体“EXDXXE”中的Glu212和Glu217,并分别作为亲核试剂和酸/碱试剂催化糖苷键断裂,释放二糖产物;④酶与底物分离。水解过程是一个重复性的循环,通过②和③循环作用,GH7外切葡聚糖酶持续水解单纤维素链,释放纤维二糖直至单纤维素链水解完全。GH7内切葡聚糖酶降解纤维素的作用过程与外切葡聚糖酶的过程较一致,不同之处在于底物无需进入内切葡聚糖酶分子内部空腔,因为内切葡聚糖酶活性口袋表面缺少封闭的loop区,促使其采用开放的结合位点,可快速与底物结合并催化水解产生寡糖产物。 Liu等[29]利用AFM揭示了GH7外切葡聚糖酶TrCel7A通过其CBM1结合模块与结晶纤维素疏水面结合,降解纤维素表面单个纤维链后,使纤维素表面缺少并留下类似路痕的痕迹的过程。这与内切葡聚糖酶作用有着很大的不同。Wang等[30]通过AFM观察GH7内切葡聚糖酶TrCel7B作用纤维素后发现,纤维素表面粗糙度增加并且纤维体积减少,这揭示了其优先水解非结晶区纤维,从而暴露结晶微纤维并为外切葡聚糖酶提供纤维素结合作用部位——微纤维末端。
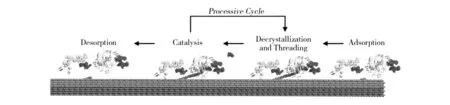
图3 GH7外切葡聚糖酶降解纤维素的作用过程[23]Fig.3 The complete processive cycle of cellulose degradation by GH7 CBH[23]
5 展 望
纤维素是地球上最丰富的可再生资源。利用内切葡聚糖酶、外切葡聚糖酶以及β-葡聚糖酶的多酶体系协同作用于纤维素降解,将其高效转化为可利用的小分子糖,对于解决目前的资源、环境和能源危机具有重大意义。近几年来,从高效降解纤维素的霉菌菌株中发现其存在着大量的GH7成员,已成为目前复配纤维素酶制剂制备生物燃料的现代工业酶的重要基础。通过对不同来源GH7成员蛋白的克隆表达、酶学性质及蛋白结构等方面进行研究,发现了其结构特点和关键氨基酸对其催化和稳定性方面的关联,但现有的酶制剂在催化活性和催化稳定性等方面仍难以达到工业应用的水平。随着研究的发展以及不断对酶的结构与催化机理的深入了解,未来通过改造可得到更加适应工业生产的复合纤维素酶制剂。