脂氧素受体激动剂BML-111对大鼠急性肝损伤的干预作用及其机制*
胡泉东, 杨玉娟, 余珊珊
((1. 绍兴职业技术学院, 绍兴 312000; 2. 南昌大学基础医学院病理生理学教研室, 南昌 330006; 3. 中国科学院大学遗传与发育生物学研究所, 北京 100101)
脂氧素(lipoxin, LXs)是重要的内源性脂质抗炎递质,被称作炎症的“刹车”信号。它由脂加氧酶(lipoxygenase)催化花生四烯酸而成,能发挥广泛的抗炎促炎症消退作用[1]。但由于其半衰期短,易降解等特点,使得其很难应用于动物实验。而其受体激动剂BML-111(5(S),6(R),-trihydroxyheptanoic acid methylester)具有与甲酰肽受体2(formyl peptidereceptor 2, FPR2,为主要的脂氧素作用受体)一致的特点,且性质稳定,商业化易获得,故广泛应用于动物实验研究中[2]。已有研究证实,BML-111在多种疾病中都发挥保护作用[2-6]。课题组前期研究已经证实了BML-111对LPS/D-GalN诱导的急性肝损伤具有保护作用[6]。RAAS相关成分的含量在肝脏发生损伤时,会发生明显变化[7],而且ACE、Ang II浓度的增高与肝损伤程度呈现出一定的正相关[8]。研究表明Ang II促进肝纤维化与脂肪肝的进展[9-10],而Ang- (1-7)抑制肝脏炎症反应[11]。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem, RAAS)在肝脏疾病的发生发展过程中具有重要作用。研究表明脂氧素对急性肝损伤具有保护作用,但具体机制尚待阐明。因此为了进一步明确脂氧素在大鼠急性肝损伤的保护机制,本研究利用CCL4诱导的大鼠急性肝损伤模型为研究对象[12],首先观察脂氧素对急性肝损伤是否对急性肝损伤具有保护,然后通过检测各实验组相关RAAS含量的变化,观察脂氧素在发挥保护效应时是否通过调节RAAS而发挥对急性肝损伤的保护,期望为临床治疗急性肝损伤提供更多的切入点。
1 材料与方法
1.1 实验动物
清洁级SD大鼠40只,雌雄各半,购自南昌大学动物科学实验中心,体重(200 ±20) g。大鼠在适应条件下(温度(23±2)℃,湿度55%±10%)饲养,自由进食进饮。
1.2 主要试剂
BML-111购自美国Enzo Life Sciences公司,BOC-2购自GenScript公司,CCL4购自成都市科龙化工试剂厂,MPO、ALT、AST试剂盒均购自南京建成生物工程研究所;Ang-(1-7)、ACE2 ELISA试剂盒购自上海西塘生物科技有限公司;ACE、Ang II ELISA试剂盒购自武汉云克隆科技股份有限公司。BCA蛋白定量试剂盒购自武汉博士德生物有限公司。β-actin抗体购自美国Abcam公司,Ang II抗体,Ang-(1-7)抗体购自美国Cloud-Clone Corp。
1.3 主要实验试剂配制
BML-111储存液:2.5 mg BML-111加入DMSO 0.25 ml混匀,超净台中操作,-20℃保存备用。
BML-111工作液:0.5 ml储存液加入4.5 ml PBS,现配现用。
BOC-2储存液:0.5 mg BOC-2加入0.25 ml DMSO和0.25 ml PBS混匀,超净台中操作,保存于 -20℃。(注:因DMSO对细胞有毒,所以在可以充分溶解的情况下尽量减少DMSO用量。)
BOC-2工作液:0.5 ml储存液加入9.5 ml PBS,现配现用。
40%CCL4橄榄油溶液:40 ml CCL4加入80 ml橄榄油, 超净台中操作,搅拌过夜。
1.4 大鼠分组及肝损伤模型的建立
将大鼠随机分为4组,每组6只,即正常对照组(CON)、肝损伤模型组(CCL4)、治疗组(BML-111)和阻断剂组(BOC-2)。正常对照组:皮下注射橄榄油,剂量1.8 ml/kg模型组:皮下注射40% CCL4油剂(橄榄油为溶剂),剂量3 ml/kg。BML-111治疗组组:皮下注射Lipoxin受体激动剂BML-111,剂量1 mg/kg,30 min后处理同模型组。BOC-2阻断剂组组:皮下注射Lipoxin受体阻断剂BOC-2,剂量50 μg/kg,30 min后处理同BML-111组。
1.5 标本收集
血 清:各组大鼠造模24 h后用戊巴比妥钠麻醉,腹主静脉取血并收集血液约5 ml于离心管中,静置30 min,4 000 r/min离心20 min,小心吸取上层上清,放入-80℃冰箱备用。
肝组织:取出肝脏,冰PBS洗涤4次,于冰上切取大小约1.0×1.0×2.0 cm左右的组织块,迅速浸泡于10%甲醛中,分装约200 mg组织块若干于1.5 ml EP管中,连同剩余肝组织一起放入-80℃冰箱备用。
1.6 肝脏大体形态观察及HE染色
切取1.0×1.0×2.0 cm左右的组织块,浸泡于10%甲醛中。常规苏木素-伊红(HE)染色,光镜下观察肝组织形态学变化。
1.7 血清AST和ALT活性检测
收集以后的血清4℃、4 000 r/min离心20 min,留取上清。按照试剂盒说明书(南京建成生物工程研究所)步骤测定血清中丙氨酸转氨酶(alanine transaminase, ALT)和天冬氨酸转氨酶(aspartate transaminase,AST)的含量。
1.8 检测血清Ang II、ACE、Ang-(1-7)、ACE2含量
制备血清后,按说明书(武汉云克隆科技股份有限公司)要求进行ELISA检测血清Ang II、ACE、Ang-(1-7)、ACE2含量。
1.9 肝组织匀浆液的制备
准确称取100 mg肝组织,用冰PBS清洗三次。加入1 ml冰PBS,在匀浆器中研磨充分。-80℃速冻,42℃解冻,反复冻融两次。10 000 r/min,4℃离心15 min。取上清,-80℃保存或置于冰上继续后续实验。
1.10 髓过氧化物酶(MPO)活性检测
取离心上清液100 μl,按照试剂盒说明书(南京建成生物工程研究所)步骤测定血清中髓过氧化物酶(MPO)。
1.11 免疫蛋白印迹法检测组织Ang II、Ang-(1-7)蛋白表达
取肝组织匀浆液,进行蛋白浓度测定(BCA法),定量。配制10%分离胶(10 ml)和5%浓缩胶(3 ml)。100℃煮待检测蛋白样品5 min,于冰上冷却10 min。先加入预染蛋白Marker 4 μl,然后按事先设定顺序加入蛋白样品各40 μg,以恒压60 V电泳30 min,然后恒压100 V电泳直至所需蛋白分离。然后蛋白经湿转、封闭和孵育第一抗体、辣根过氧化物酶标记的二抗工作液室温孵育1 h ;TBST清洗后用辣根过氧化物酶发光液,于Image Lab凝胶成像系统曝光,用Image-Pro Plus 6.0软件进行灰度分析。
1.12 统计学处理
2 结果
2.1 BML-111对CCL4诱导的大鼠急性肝脏损伤和炎症细胞浸润的影响
肝脏大体外观显示,CCL4组大鼠肝脏色泽变黄,肝组织呈颗粒状,表面可见片状瘀斑和多处出血点,质地稍硬; BML-111治疗的大鼠肝脏较CCL4组有明显的改善,质地颜色与CON组较接近;而BOC-2组肝脏可见散在瘀斑和出血点(图1A)。
光学显微镜下可见CCL4组大鼠肝脏小叶中心部明显坏死,坏死区域周围可见肝细胞水肿,炎性细胞浸润,脂肪变性。BML-111组肝细胞病变症状明显减轻,BOC-2组肝细胞水肿、变性及空泡样变,上述提示, BML-111抑制CCL4诱导急性肝损伤,减少炎症细胞浸润(图1B,图1见彩图页Ⅳ)。
2.2 BML-111对血清MPO及ALT/AST活性的影响
检测结果显示:与对照组相比,模型组大鼠肝脏MPO及ALT/AST活性明显升高(P<0.01);与模型组对比,BML-111治疗组MPO及ALT/AST活性明显下降(P<0.01)。与BOC-2阻断剂组相比,BML-111治疗组MPO及ALT/AST活性明显下降(P< 0.01,表1)。

Tab. 1 Changes of MPO activity and serum ALT/AST in each n=6)
2.3 BML-111对血清ACE、Ang II、ACE2、Ang-(1-7)含量的影响
实验采用酶联免疫吸附法检测各组血清中ACE、Ang II、ACE2、Ang-(1-7)的含量。与对照组相比,模型组ACE、Ang II、ACE2、Ang-(1-7)含量明显升高(P<0.01);与模型组对比,BML-111治疗组ACE、Ang II含量明显下降(P<0.01,P<0.05),ACE2、Ang-(1-7)含量明显升高(P<0.01);与BOC-2阻断剂组相比,BML-111治疗组ACE、Ang II含量下降(P<0.05),ACE2、Ang-(1-7)明显升高(P< 0.01,P<0.05,表2)。
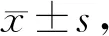
Tab. 2 Changes of ACE, Ang II, ACE2 and Ang-(1-7) in each group(ng/ml, n=6)
2.4 BML-111对肝组织中Ang-(1-7)、AngII含量的影响
肝组织中Ang-(1-7)、Ang II的蛋白表达水平通过Western-blot进行检测。结果显示: 与正常组对比,模型组Ang-(1-7) 、Ang II 含量明显升高;与模型组相比,BML-111治疗组Ang-(1-7) 含量明显升高,Ang II含量明显降低;与BOC-2阻断剂组对比,BML-111治疗组Ang-(1-7) 含量明显升高,Ang II含量明显下降(图2,表3)。

Fig. 2 The contents of Ang II and Ang(1-7) in liver tissue were assessed by Western blot

Tab. 3 Analysis of Ang II and Ang(1-7) in liver tissue in each n=5)
3 讨论
脂氧素是一种重要的脂质调节因子,在炎症反应过程中通过特殊G-蛋白偶联受体(ALX),发挥抗炎以及促炎症消散作用[13]。而课题组前期实验结果表明脂氧素受体激动剂BML-111抑制LPS/D-GalN诱导炎症细胞的浸润,而且应用脂氧素受体阻断剂BOC-2对肝脏无直接损伤[6]。本实验在用CCL4诱导急性肝损伤时,发现血清中ALT,AST活性明显升高,而BML-111降低这些反应肝功能指标的酶活性。有实验研究表明非酒精性脂肪肝损伤中ALT、AST、IL-6、IL-17 水平明显升高[14]。在大鼠糖尿病性肝硬化损伤和纤维化发生中,AST和ALT显著升高,钙敏感受体(calcium-sensing receptor, CaSR)和胶原Ⅰ(COⅠ)、胶原Ⅲ(COⅢ)、基质金属蛋白酶1(MMP1)、基质金属蛋白酶2(MMP2)、基质金属蛋白酶9(MMP9)蛋白表达上调[15]。髓过氧化物酶(myeloperoxidase,MPO)是一种血红素蛋白,富含于中性粒细胞中,由粒细胞进入循环之前在骨髓内合成并存储于噬天青颗粒内。外界刺激可导致中性粒细胞聚集,从而释放髓过氧化物酶。有研究表明急性肺损伤时MPO活性增高,而BML-111在发挥急性肺损伤的保护作用时与降低MPO活性有关[16]。本实验模型组中MPO活性明显升高,而BML-111能够降低MPO活性。从实验结果来看BML-111能够抑制CCL4诱导急性肝损伤时的炎症细胞浸润,而且此结果与(图1B)HE染色结果一致。BML-111的抗急性损伤作用的确与降低MPO活性有关[6-7]。
肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem, RAAS)的主要成分包括ACE、Ang II、ACE2、Ang-(1-7);这些成分在体内广泛分部,主要存在于肝、肺等器官;当肝、肺受到损伤时,体内ACE、Ang II、ACE2、Ang-(1-7)含量发生变化[17-18]。本研究采用酶联免疫吸附法检测血清中ACE、Ang II、ACE2、Ang-(1-7)含量。结果显示ACE、Ang II在模型组中含量明显升高,而ACE2、Ang-(1-7)同样会升高。而BML-111治疗组在降低ACE、Ang II含量的同时还能够进一步升高ACE2、Ang-(1-7)含量。表明急性肝损伤时BML-111对ACE、 Ang II、ACE2、Ang-(1-7)进行了重新调整。有研究报道肝损伤程度与Ang II、ACE浓度正相关,应用ACE抑制剂明显减轻了CCL4诱导的氧化应激压力和炎症反应[19]。有研究表明敲除ACE2基因会导致肝细胞内的氧化压力和炎症损伤程度加重,造成肝损伤[20]。由此推测,模型组ACE2、Ang-(1-7)含量的升高可能是一种应激性的保护反应。
实验结果表明模型组中ACE、Ang II含量高于正常组,而BML-111能降低ACE、Ang II的表达,在一定程度上减轻炎症细胞的浸润,抑制炎症反应。有研究发现Ang II对肝损伤的机制可能与下调miR-590-5p表达,增加内质网的氧化应激压力有关,炎症细胞在Ang II诱导下,加速在肝损伤部位的浸润[21],亦有研究表明抑制ACE合成,能够减轻炎症反应[22]。已有研究表明Ang-(1-7)在急性肺损伤时,含量升高,而且在加用Ang-(1-7)后有较好的抗急性肺损伤作用[23]。
本实验证实脂氧素受体激动剂BML-111具有一定的抗急性肝损伤作用,而且ACE、Ang II、ACE2、Ang-(1-7)含量在肝损伤时发生了变化。实验结果提示脂氧素受体激动剂BML-111可能通过调节ACE、Ang II、ACE2、Ang-(1-7)的含量发挥一定的抗急性肝损伤作用。

