原花青素提高鱼藤酮诱导的帕金森模型细胞活力的研究*
许逸岚, 徐 炀, 李鸿飞, 沈铄恒, 阮文丽, 郭晓欢, 赵镘娜, 韩瑜颖, 张 衡
((绍兴文理学院医学院基础医学部, 浙江 绍兴 312000)
帕金森病(Parkinson’s disease, PD)是一种常见的与年龄相关的神经退行性疾病,目前已成为中老年人健康的“第三杀手”,它主要的病理改变为大脑中黑质纹状体多巴胺神经元的进行性改变和细胞内路易体的积累,表现为静止性震颤、肌僵直、运动迟缓和姿势平衡障碍等[1]。目前临床上使用的药物为苯海索等抗胆碱药物、溴隐亭等多巴胺受体激动剂以及左旋多巴,然而他们只能缓解临床症状却不能延缓疾病的进程,同时还存在着许多副作用[2]。因此,只有从PD的具体发病机制出发,才有可能研制出真正延缓PD的进程的药物。王汝欢等[3]人通过实验发现,血管性认知功能障碍的大鼠海马区氧化应激水平升高,通过使用抗炎抗氧化的药物可使大鼠体内的超氧化物歧化酶(SOD)的水平显著提高,从而改善其认知障碍。Wahba等[4]人发现,纳米抗氧化剂GAL@Ce-HAp可以下调阿尔茨海默症(Alzheimer’s disease, AD)大鼠脑中的氧化应激标记物,抑制其海马中的神经元退化。这表明氧化应激能够损伤神经细胞,促进神经细胞的凋亡,在诸多神经退行性疾病的进程中起到了重要的介导作用[5]。原花青素(proanthocyanidins,PC)是存在于许多种植物中的天然酚类化合物,具有明显的抗氧化作用[6]。有研究表明,PC对AD模型大鼠脑组织有一定保护作用,可以通过清除氧自由基来减少脂质的过氧化物反应,从而减轻ROS对脑组织的损伤[7-8]。一项历时20年的流行病学调查表明,较多摄入富含PC的食物的实验参与者患PD的概率较低,这可能与PC能够抑制PD的发病有一定关系[9],但其具体机制仍有待进一步探索。因此本研究选用人神经母细胞瘤细胞SH-SY5Y构建PD细胞模型,通过观察原花青素对鱼藤酮构建的PD细胞模型的氧化应激损伤的影响,并探讨具体机制,为PC用于PD的临床抗氧化治疗提供理论依据。
1 材料与方法
1.1 仪器
二氧化碳培养箱(上海力申科学仪器有限公司,HF90),荧光倒置显微镜(MODEL IX70-S1F2,日本OLYMPUS公司),磁力搅拌器(上海志威电器有限公司,85-1),酶标仪(美国BIO RAD公司,iMark),流式细胞仪(美国Beckman Instruments公司,CytoFLEX)。
1.2 试剂
胎牛血清(Gibco公司),DMEM 培养基(Hyclone公司)、胰蛋白酶(biosharp公司),青霉素及链霉素(上海吉诺公司),二甲基亚砜DMSO(碧云天公司),噻唑蓝溴化四唑(MTT试剂,阿拉丁公司),活性氧检测试剂盒(碧云天公司),鱼藤酮粉末(上海百舜生物科技有限公司),原花青素粉末(上海源叶生物科技有限公司)
1.3 细胞培养
人神经母细胞瘤细胞SH-SY5Y(来源于浙江大学孙秉贵教授实验室)细胞接种于含有10% 胎牛血清和 1% 双抗(青霉素 100 000 U/L,链霉素 100 000 U/L)的 DMEM培养基中,放入37℃,5% CO2培养箱中培养。当细胞贴壁生长到 80%~90% 后用胰蛋白酶消化传代至新的培养瓶中。
1.4 PD细胞模型的构建与MTT法细胞活力检测
取处于对数生长期的SH-SY5Y细胞,用磷酸盐缓冲液洗涤,经胰酶消化后,用含有 10% 胎牛血清和 1% 双抗的DMEM培养液悬浮细胞,并将细胞的密度调整为1×105cells/ml,分别接种于96孔细胞培养板中(100 μl/well),将细胞置于37℃,5% CO2培养箱中培养。细胞过夜培养至合适密度,分别用溶于终浓度0.1%DMSO中的不同浓度的鱼藤酮(终浓度为1、2.5、5、10 μmol/L)处理细胞,构建PD细胞模型。每个浓度分别设置6个复孔,另设空白对照组与DMSO对照组(加入等量培养液处理细胞、终浓度0.1%DMSO处理细胞),各设置6个复孔。加药后24 h时,向各个培养孔中加入MTT溶液(5 mg/ml) 10 μl/孔,37℃孵育4 h,弃去上清后,每孔加入150 μl DMSO,用酶标仪检测490 nm处吸光度值(OD)。
1.5 相差显微镜观察细胞数量与形态
将处于对数生长期的SH-SY5Y细胞的密度调整为2×104cells/ml,接种于24孔细胞培养板中(500 μl/well),将细胞培养至合适密度后,用溶于0.1% DMSO的浓度为10 μmol/L的鱼藤酮作用于细胞,另设对照组(加入等量培养液处理细胞),各设置4个复孔。培养处理24 h后,置于IX70-S1F2显微镜下观察,每个复孔选定10个视野观察区域(每组共计40个区域,n=40)统计分析不同组别单个视野观察区域细胞的平均数目,用于表征细胞数量,并进行统计分析。
1.6 流式细胞仪检测细胞周期变化
将处于对数生长期的SH-SY5Y细胞的密度调整为105cells/ml,分别接种于6孔细胞培养板中(2 ml/well),将细胞培养至合适密度,用浓度为10 μmol/L的鱼藤酮作用于细胞,另设对照组(加入等量培养液处理细胞),各设置3个复孔,在培养箱中培养24 h后,用胰酶消化细胞,用移液管将细胞和细胞培养液收集至离心管中,1 500 r/min离心4 min,去除上清后加入1 ml预冷的磷酸盐缓冲液(PBS),再次离心沉淀细胞,再次去除上清后,加入1 ml预冷的70%乙醇,4℃ 固定24 h。固定结束后,离心沉淀细胞后去除上清,加入1 ml预冷的PBS,重悬细胞后,再次离心沉淀细胞,去除上清,最终加入配制好的碘化丙啶染色液,并于37℃ 细胞培养箱中避光孵育30 min。最后,使用流式细胞仪进行检测。
1.7 原花青素处理与MTT法检测细胞活力
将处于对数生长期的SH-SY5Y细胞的密度调整为1×105cells/ml,分别接种于96孔细胞培养板中(100 μl/well),将细胞培养至合适密度后,用溶于0.1%DMSO中浓度为10 μg/ml的原花青素预孵育SH-SY5Y细胞4 h后,加入浓度为10 μmol/L的鱼藤酮继续处理24 h,此组设置6个复孔,另设置对照组(加入等量培养液处理细胞),原花青素(原花青素终浓度为10 μg/ml)单独处理组,鱼藤酮(鱼藤酮终浓度为10 μmol/L)单独处理组,各设置6个复孔处理24 h后,通过MTT法用酶标仪检测490 nm处吸光度值(OD)。
1.8 流式检测检测细胞内ROS变化
将处于对数生长期的SH-SY5Y细胞的密度调整为105cells/ml,分别接种于6孔细胞培养板中(2 ml/well),将细胞培养至合适密度,用溶于浓度为10 μg/ml的原花青素预孵育SH-SY5Y细胞4 h后,加入浓度为10 μmol/L的鱼藤酮继续处理24 h,此组设置3个复孔,另设对照组(加入等量培养液处理细胞),鱼藤酮(终浓度为10 μmol/L)单独处理组,各设置3个复孔,处理24 h后,吸去孔板中培养液,收集细胞至离心管后,在每管中加入浓度为10 μmol/L的 DCFH-DA探针150 μl,置于37℃细胞培养箱内避光孵育20 min后,用无血清细胞培养液洗涤细胞2次,最后进行流式细胞仪检测。
1.9 统计学处理
统计处理用GraphPad Prism 5.0软件进行分析,各组采用单因素方差(one-way ANOVA)分析,并用Newman-Keuls检验进行两两比较,两组之间比较采用t检验。
2 结果
2.1 鱼藤酮抑制SH-SY5Y细胞活力
MTT法结果显示(表1),与对照组相比,较低浓度的鱼藤酮对SH-SY5Y细胞的活性无明显影响,当鱼藤酮浓度达到2.5 μmol/L时,细胞的活力明显受到抑制,鱼藤酮的浓度越高对SH-SY5Y细胞活力的抑制作用越明显。根据实验结果选择10 μmol/L作为后续实验处理细胞的鱼藤酮浓度。同时,与对照组相比,0.1%DMSO处理组无明显差异,表明此浓度下DMSO对细胞活力无影响,故后续实验不再设置 0.1%DMSO组。
2.2 鱼藤酮使SH-SY5Y细胞数量减少
鱼藤酮处理后,置于相差显微镜下观察对照组与鱼藤酮处理组细胞,与对照相比,10 μmol/L鱼藤酮处理组细胞的数量大幅度减少(表1,图1)。
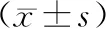
Tab. 1 Effects of different concentrations of rotenone on cell viability

Fig. 1 Effect of rotenone on cell number(uncoulored ×200)
2.3 鱼藤酮对SH-SY5Y细胞周期的影响
流式细胞仪检测结果显示(表1,图2),与对照组相比,10 μmol/L鱼藤酮处理组的SH-SY5Y细胞在G0/G1期比例明显增加,G2/M期的比例明显下降, 两者S期比例无明显差别。这表明鱼藤酮能够抑制SH-SY5Y细胞的生长,使其主要停滞于G0/G1期。

Fig. 2 Effect of rotenone on cell cycle
2.4 原花青素对PD细胞模型活力的影响
MTT法结果显示(表2),与对照组相比,原花青素可以明显提高神经细胞的活力。鱼藤酮处理组细胞活力相对于对照组明显下降,表明鱼藤酮明显抑制细胞生长。而SH-SY5Y细胞预孵育原花青素后,细胞活力明显升高,表明原花青素能够缓解鱼藤酮造成的细胞损伤。
2.5 原花青素抑制鱼藤酮诱导的PD模型细胞ROS的产生
经过DCFH-DA探针染色后,使用流式细胞仪检测各组ROS的含量(表2,图3),与对照组相比,鱼藤酮单独处理组细胞的ROS含量大幅度增加;与鱼藤酮单独处理组相比,预孵育原花青素组ROS含量明显下降。

Tab. 2 Proanthocyanidins inhibits the effect of rotenone on cell viability

Fig. 3 Proanthocyanidins inhibits rotenone-induced ROS production
3 讨论
帕金森病作为常见的一种神经退行性疾病,其致病机制与线粒体功能障碍、炎症反应、兴奋性毒性、蛋白质错误折叠等多种因素密切相关[10]。但目前有许多研究表明, PD的发生与氧化应激存在一定关系[11-12]。本研究显示鱼藤酮诱导的帕金森细胞模型的ROS含量大幅度上升,细胞活力和数量有明显下降,表明PD患者的神经元在一定程度上发生了凋亡,同时实验结果显示帕金森细胞模型的细胞周期也发生改变,处于G0/G1期的细胞比例增加,处于G2/M期的细胞比例减少,这进一步表明ROS的产生在一定程度上会抑制细胞增殖,氧化应激反应可能是PD发病的一大原因。可能是PD患者体内不平衡的氧化应激反应导致细胞内产生了大量ROS,而ROS能够直接损伤蛋白质、 DNA、脂质等生物大分子[13-14],进而导致神经细胞凋亡和缺失。Huang等人发现,经过药物诱导的PD细胞模型存在细胞凋亡与ROS水平上调的现象,且敲除PD相关基因后,ROS含量明显下降[15]。Han等人研究表明,氯霉素能够有效降低PD模型的ROS含量,并且显著提高了其多巴胺能神经元的活力[16]。这些证据都表明,通过减少PD发病过程中ROS的产生有可能会减缓PD的发病进程,从而达到治疗PD的目的。
原花青素是一种存在于许多种植物中的天然酚类化合物,林琨等人通过实验证明,原花青素可以减轻陶瓷磷酸三钙磨损颗粒诱发的氧化应激反应,从而减少骨溶解[17]。龚频等人研究发现,原花青素能够通过有效清除自由基,达到预防和有效治疗糖尿病并发症的目的[18]。这些都证明了原花青素有抗炎,抗氧化作用,在诸多方面有其独特的应用价值。我们的研究结果显示,原花青素能够提升细胞活力,同时有效降低PD细胞模型中的ROS含量,故我们推测原花青素可以通过抑制PD模型细胞ROS的生成来延缓疾病的进程。然而,由于PD发病机制的复杂性,原花青素是否还通过其他生物分子或信号网络而对PD有效,仍需要深入研究。

