抗甲状腺药物诱发抗中性粒细胞胞质抗体相关性血管炎5例并文献分析
蒋文艳,原海燕
(1.中南大学湘雅二医院药学部,长沙 410011;2.桂林医学院第二附属医院药学部,广西桂林 541199)
抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎(ANCA-associated vasculitis,AAVs)属异质性、多系统疾病,以中小血管出现炎症和坏死为特征,包括伴多血管炎的肉芽肿病(granulomatosis with polyangiitis,GPA,又称韦格纳肉芽肿病)、显微镜下多血管炎(microscopic polyangiitis,MPA)和伴多血管炎的嗜酸性粒细胞增多症(eosinophilic granulomatosis with polyangiitis,EGPA,又称Churg-Strauss综合征)等一组疾病[1-2]。丙硫氧嘧啶(propylthiouracid,PTU)和甲巯咪唑(methimazole,MMI)属硫脲类抗甲状腺药,是目前治疗甲状腺功能亢进症(甲亢)最常用的药物。自1992年Stankus等[3]和1993年Dolman等[4]相继报道PTU引起AAVs后,由抗甲状腺药物(anti-thyroid drugs,ATDs)引起的AAVs逐渐受到临床工作者的重视。现将临床药师发现并整理的5例ATDs引起的AAVs临床和病理特点报道如下,并复习相关文献,以提高对本病的认识。
1 材料和方法
1.1 病例选择 5例均为中南大学湘雅二医院2017年1月—2018年12月收治的Graves病住院病人,均系PTU或MMI治疗后出现ANCA阳性小血管炎,并排除系统性红斑狼疮、类风湿性关节炎、GPA及其他结缔组织病。
1.2 ANCA及其靶标检测 采用间接免疫荧光法(ⅡF)检测ANCA,采用抗原特异性酶联免疫吸附法(ELISA)检测血清抗髓过氧化物酶(myeloperoxidase,MPO)和抗蛋白酶3(proteinase-3,PR3)抗体,检测试剂盒均购自美国Zeus公司,正常值均<150 U/ml。
2 结 果
2.1 病人一般情况 5例病人均为女性,年龄21~63岁,4例服用PTU,1例服用MMI。服用ATDs时间为3~60个月,病例3、4、5间断服药。
2.2 临床表现 病人一般情况及主要临床表现见表1。
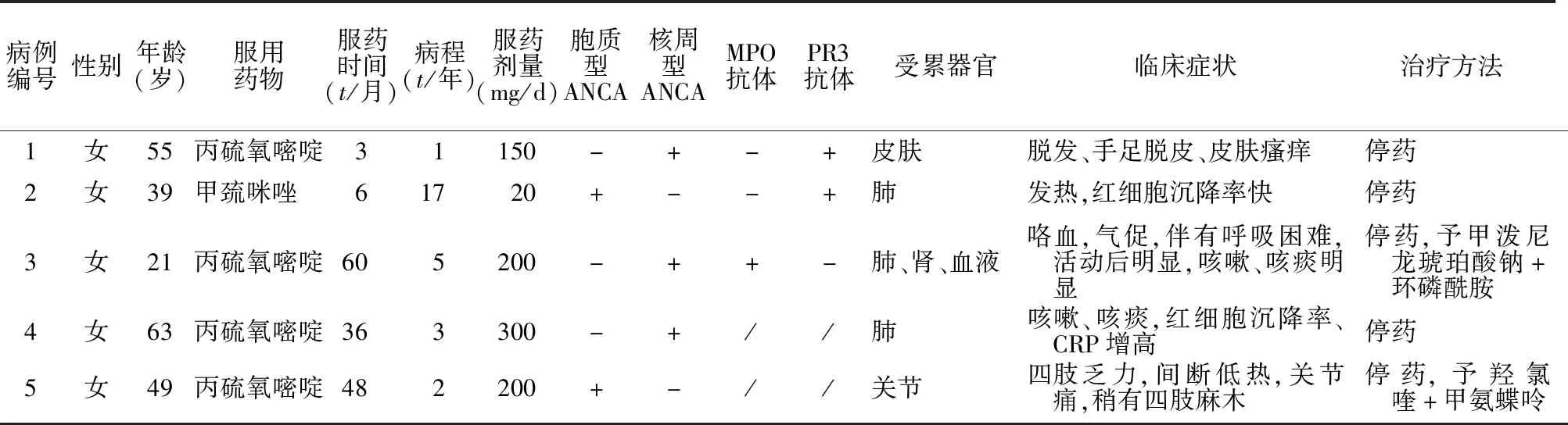
表1 5例病人的一般情况及主要临床表现Table 1 General conditions and main clinical manifestations of 5 patients
2.3 ANCA实验室检查 3例病人为核周型ANCA(p-ANCA),2例病人为胞质型ANCA(c-ANCA);1例为MPO抗体(MPO-ANCA)阳性,2例为PR3抗体(PR3-ANCA)阳性,2例未检测。
2.4 治疗及预后 5例病人均立即停用ATDs。1例病人(病例3)加用甲泼尼龙琥珀酸钠80 mg,ivgtt,治疗3 d后减量至40 mg,qd,ivgtt,并联合环磷酰胺400 mg,ivgtt(每月2次)治疗。1例(病例5)予羟氯喹200 mg,qd,联合甲氨蝶呤7.5 mg(3片),qw治疗。5例病人临床症状均缓解。
2.5 典型病例 病例3,女,21岁,因“反复气促伴呼吸困难1周”于2018-02-23入院。病人有甲亢病史5年,间断服用PTU 100 mg,bid,po治疗;既往有小肠出血史1年。入院后完善相关检查。查甲状腺功能:游离三碘甲状腺原氨酸(FT3)1.69 pg/ml,游离甲状腺素(FT4)0.009 6 ng/ml,促甲状腺素(TSH)0.98 μU/ml。c-ANCA阴性,p-ANCA阳性,MPO 121.28 U,PR3 4.17 U。查血常规:白细胞计数2.73×109/L,红细胞计数2.56×1012/L,血红蛋白60 g/L。CRP 11.7 mg/L;红细胞沉降率100 mm/h;D-二聚体1.05 mg/L FEU(纤维蛋白原等量单位)。尿常规:尿隐血++。大便常规:隐血试验+。尿沉渣:尿隐血+++;24 h尿总蛋白753.44 mg,尿蛋白/尿肌酐1 651.1 mg/g,24 h尿白蛋白519.8 mg,尿白蛋白/尿肌酐1 139.2 mg/g,尿N-乙酰-β-葡萄糖苷酶(NAG)/尿肌酐42.1 U/g。补体:C3 0.66 g/L,C4 0.16 g/L。骨髓细胞学检查:骨髓增生活跃,粒系占55%,红系占34%。甲状腺彩超:甲状腺实质弥漫性病变。肺部CT血管造影(CTA)示:双肺多发渗出性病变,考虑感染。根据病人有长期服用PTU史,p-ANCA阳性,MPO阳性,且检查提示有中度贫血、低蛋白血症、血尿、蛋白尿、消化道出血等多系统受累的表现,诊断为:(1)ANCA相关性血管炎(丙硫氧嘧啶相关可能性大), 继发肺病变、继发肾脏病变、血液系统受累;(2)肺部感染;(3)甲亢治疗后;(4)急性扁桃体炎;(5)中度贫血。立即停用PTU,并予甲泼尼龙琥珀酸钠80 mg,qd,ivgtt,治疗3 d后减量至40 mg,qd,ivgtt,联合环磷酰胺400 mg,ivgtt(每月2次)治疗。肺部CT复查示:双肺多发渗出性病变较前改善。病人无明显咯血,无胸闷、气促,无咳嗽、咳痰,临床症状缓解。
3 讨 论
3.1 诱发AAVs的药物 研究表明,药物诱发的AAVs可能是病人先前服用的某些药物引起的并发症,并且可能还存在许多未报告和/或未确诊的病例[5]。国内外已报道的诱发AAVs的药物有:(1)抗生素,如头孢噻肟、米诺环素等;(2)ATDs,如PTU、MMI、卡比马唑等;(3)肿瘤坏死因子(TNF-α)类,如阿达木单抗、依那西普、英夫利昔单抗(infliximab)等;(4)抗精神病药物,如氯氮平、硫利达嗪等;(5)其他药物,如别嘌醇、D-青霉胺、肼苯哒嗪、左旋咪唑、苯妥英钠、柳氮磺吡啶等[5]。其中ATDs是常见的诱发药物,已发表的相关研究中最常涉及的药物是 PTU[5]。据报道,ATDs诱发AAVs的患病率为4%~46%[6]。本文报道的5例均为甲亢病人,服用PTU和MMI治疗,治疗期间均出现了AAVs。AAVs的发生概率与服用ATDs的剂量和时间呈正相关[5],病情较轻者,停用PTU后预后较好[7]。
3.2 药物致AAVs的作用机制 ANCA是一种天然的抗MPO和抗PR3抗体,具有免疫特性[8]。MPO是p-ANCA的主要靶标,PR3是c-ANCA的主要靶标[10]。在中国系统性血管炎病人中,ANCA的靶标抗原是MPO而非PR3,即便是有GPA临床症状谱的病人,MPO-ANCA阳性者也占多数[11]。大多数药物诱发AAVs的病人都有抗MPO抗体,针对多种ANCA抗原的自身抗体阳性可能是药物诱发的AAVs的特征。虽然本组PR3-ANCA阳性病例(2例)多于MPO-ANCA阳性(1例),但因病例数较少,且还有2例未检测,故此结果不具说服力。药物诱发AAVs的发病机制可能涉及多种因素,包括遗传因素、环境暴露、感染、先天性和获得性免疫系统的特征以及损伤的强度和持续时间等[11]。PTU是一种使用广泛的ATDs,接受PTU治疗的病人中约15%~64%的病人血清ANCA为阳性,但其中只有1/4的病人有临床血管炎表现[8]。因此,药师认为在监测药物诱发的AAVs时,应特别注意那些血清ANCA为阳性但没有临床血管炎表现的病人。
3.3 AAVs的临床表现 在接受ATDs治疗的甲亢病人中,AAVs的临床表现极其多变,因为小血管炎可能影响所有器官。肾脏、肺和皮肤是受疾病影响最常见的器官。由于肾小球肾炎的发展,肾脏受累可导致血尿和中度蛋白尿。在这些病人中,肾活检经常表现出新月体毛细血管扩张。如果肺部受累,肺泡出血通常由咯血以及坏死的血管紫癜病变引起。经常观察到的AAVs一般症状包括发热,关节疼痛,肌痛,体质量减轻,巩膜炎,耳、鼻、喉、神经系统受累和消化道溃疡等[12]。另外,一些罕见的临床表现也有病例报道,例如感觉神经性听力损伤、心包炎、坏疽性脓皮病、中枢神经系统血管炎(表现为认知症状和脑瘫痪性脑膜炎)[13]。仔细区分药物诱发的ANCA阳性病例与实际临床疾病(血管炎)将变得越来越重要。正如服用有些药物可以产生抗核抗体,但不会导致药源性系统性红斑狼疮(drug-induced lupus erythematosus,DILE)一样,有些药物可以诱发ANCA,但不能诱发血管炎。明确哪些因素可以区分对药物耐受的病人与进展为血管炎或其他自身免疫性疾病的病人,可加深对药物引起的AAVs的认识[14]。药师建议,长期服用ATDs的病人若出现发热不适、呼吸困难、关节痛、肌痛、体质量减轻、皮肤瘙痒等临床症状,应警惕药物诱发的AAVs的可能。若未及时发现并予相应处理,病人可能出现组织或器官的受累,严重者甚至危及生命,应予以高度重视。
3.4 药物诱发的AAVs的临床诊断 AAVs可致重要器官损害,因此及时识别并诊断相关药物诱发的AAVs至关重要。然而,药物诱发的AAVs的诊断是复杂和困难的,其原因有:(1)医师对药物诱发AAVs的认识不足;(2)不同药物诱发的AAVs出现临床症状的时间无规律,易漏诊、误诊;(3)无确切的实验室指标和侵入性检查来诊断。本文中5例病人服用ATDs发生AAVs后表现出不同的临床症状。药物诱发的AAVs的诊断基于临床上明显的血管炎与相关药物之间的时间关系,并排除其他血管炎类型的疾病[13]。对于AAVs的诊断,药师认为必须获得病人的全面用药史。根据药品不良反应(ADRs)因果相关性分析,有文献提出PTU致AAVs的临床诊断要点如下:(1)有服用PTU史,停药后症状及体征缓解,抗体滴度下降;(2)p-ANCA检测呈阳性或滴度升高;(3)伴发热、乏力及体质量下降等全身表现;(4)有多脏器损害表现,如皮肤、关节、肾脏、肺及血液系统等;(5)组织活检可见血管炎表现;(6)可发生多克隆免疫反应,产生识别多种靶抗原的ANCA,也可同时产生抗核抗体(ANA)。符合以上第(1)、(2)和/或第(5)点者即可确诊为PTU所致的AAVs[15]。本文所观察到的5例病人均符合以上条件,临床药师对其ADRs的关联性评价为“很可能”。
3.5 AAVs的治疗 对于药物诱发的AAVs的治疗没有标准方案。目前AAVs的治疗主要集中在使用皮质类固醇和更强的免疫抑制剂如环磷酰胺或利妥昔单抗诱导缓解,不推荐单独应用糖皮质激素治疗,主张联合治疗。糖皮质激素联合环磷酰胺是目前公认且循证医学证据最充足的治疗方案,能使90%以上病人临床症状显著缓解。对于患有严重和活跃器官受累的病人,强化免疫抑制治疗如皮质类固醇和/或免疫抑制剂可以改善器官功能并防止发展为严重的、不可逆的疾病。由于ATDs参与了AAVs发病机制,因此在诊断后立即停用相关药物至关重要,可使临床症状快速改善[12]。治疗应基于药物诱发的AAVs病人的个体化评估。建议:(1)发生非特异性临床症状时,仅停用相关药物;(2)发生器官损伤时,用糖皮质激素和/或免疫抑制剂治疗;(3)发生严重器官受累(如坏死性肾小球肾炎、弥漫性肺泡出血)时,首选甲泼尼龙冲击疗法,其次联合皮质类固醇和免疫抑制剂治疗;(4)大量肺出血时,进行血浆置换治疗。本文中5例病人使用ATDs发生AAVs后均立即停药,临床症状均缓解,1例病人停药后予甲泼尼龙琥珀酸钠联合环磷酰胺治疗后病情较前缓解。因此,对于药物诱发的AAVs,药师应发挥药学专业特长,与医师共同制订个体化治疗方案。
3.6 AAVs的监测 ANCA的监测可作为药物诱发AAVs可能性的警告,IgG检测是常规实验室检测指标。对于药物诱发的AAVs,应特别注意监测病人血清ANCA及慢性潜在血管炎的出现[5]。由于PTU诱发的AAVs病人累及肾脏临床症状轻微且停用PTU可显著降低药物相关的免疫反应,如PTU诱发的AAVs中抗MPO抗体具有较低的亲合力并缺乏IgG3亚类,因此PTU诱发的AAVs病人预后良好。
对于PTU诱发的AAVs,药师应做好药学监护。建议:(1)避免长期使用能够诱发AAVs的药物,应密切监测长期使用这些药物治疗的病人;(2)确诊药物诱发的AAVs后,立即停用相关药物;(3)应根据器官受累的严重程度启动个体化免疫抑制治疗;(4)详细记录病人病历中的严重ADRs,以避免再次发生。

