降解甲醛微生物的分离鉴定及其降解与代谢特性研究
王 茹,冯 永,李昆志,王 晋,许 永,田丽梅,缪恩铭,耿咏勤,蒋次清,陈建华,魏玉玲,唐 萍,李雪梅,陈丽梅,张承明*
(1.云南中烟工业有限责任公司 技术中心,云南 昆明 650023;2.昆明理工大学 生命科学与技术学院,云南 昆明 650500)
甲醛(FA)是所有脂肪醛中最简单的一种有机化合物,其化学式为HCHO。在室温下,FA是一种无色、易溶、有刺激性气味的气体[1]。长时间暴露在甲醛中可引起一系列慢性呼吸道疾病,包括上呼吸道黏膜肥大或萎缩、慢性咽炎、鼻炎、鼻窦炎和鼻咽炎等[2]。研究发现几乎所有有机化合物都能不同程度地被微生物降解和转化,甲醛作为一种天然存在的有机物也不例外。随着甲醛的广泛应用,由此带来的甲醛污染问题受到越来越多的重视。
Azachi等[3]在使用甲醛生产胶水的工厂附近的土壤中分离出1株Halomonassp. MA-C,研究发现其能在甲醛浓度为75~100 mg/L的环境下生长良好。杨郁等[4]从活性污泥中分离出1株能降解甲醛的苏云芽孢杆菌,其在含1.2 μg/mL甲醛的培养基上生长36 h后,对甲醛的去除率达到72%。
目前,针对降解甲醛的微生物,国内外做了较多研究,主要涉及的降解微生物是甲基营养菌及部分非甲基营养型细菌、酵母及真菌[5]。非甲基营养型细菌包括甲基球菌属(Methylococcus)、盐单胞菌属(Halomonas)、红球菌属(Rhodococcus)、胃分枝杆菌属(Mycobacteriumgastri)、假单胞菌属(Pseudomonas)、醋酸菌属(Acetobacter)、芽孢杆菌属(Bacillus)、鞘氨醇单胞菌(Sphingomonas)等。真菌包括拟青霉(Paecilomycessp.)、曲霉(Aspergillussp.)和木霉(Trichodermasp.)等[6-7]。
微生物对甲醛的代谢途径主要分为将甲醛转化为细胞组分的同化途径和将甲醛分解为 CO2和水的异化途径。甲醛同化途径包括丝氨酸途径、核酮糖单磷酸途径、木酮糖单磷酸途径;甲醛异化途径分为两大类,一类是甲醛与各种辅因子结合形成加合物进而进入代谢链,另一类是甲醛的环状氧化途径[8]。
应用传统的以微生物为基础的活性污泥去除有机污染物,不仅难满足现代工业的处理需求,而且其所携带的病原菌、寄生虫、重金属等有害物质还会对环境带来更严重的污染。因此我们首先从受甲醛污染的实验室废水污泥和普通野外河泥中特定培养驯化出能降解高浓度甲醛及有机污染物的微生物,并对其进行了初步形态及分子学鉴定。此外国内学者对于微生物的研究多集中于对微生物的筛选和降解特性的研究阶段,未能深入了解这些菌的降解和代谢特性,不利于环境应用的研发。我们进一步考察了微生物对不同浓度甲醛的降解效果,以及通过13C-NMR核磁图谱初步分析了筛选菌对甲醛的代谢特性,以期为后续实验提供一定的理论依据。
1 材料与方法
1.1 活性污泥的获取及包埋
本研究中活性污泥分别来源于昆明理工大学呈贡校区捞鱼河的河泥与生科院植物组温室污水处理池中的池泥。将收集的活性污泥与水混合,确保活性污泥的含水率在98%~99%;然后使用纱布进行过滤,将其中的碎石等杂物去除;将剩余的泥水混合物与2%的海藻酸钠溶液以1∶1的比例混合,将30 cm×20 cm×0.5 cm低密度海绵浸泡其中,待海绵吸收饱和后,去除海绵表面多余的凝结物及液体,使海绵表面保持平整且有很好的吸附和透气能力;随后将海绵放入含有4% CaCl2的溶液中,浸泡20 min后,取出,放入清水中过夜。
1.2 驯化装置
本研究用气体驯化装置对包埋的活性污泥进行驯化处理,该装置如图1所示。处理箱由收纳盒改装而来,在收纳盒底部开有10 cm×10 cm的正方形开口,并安装离心风扇。在收纳箱内部正方形开口上方固定一块漏网状支撑板,这样在处理箱底部就构建了一个空气间隔室,离心风扇可将外界气体吹入处理箱中。将包埋好河泥和池泥的海绵卷成大小一致的卷,放置于处理箱漏网状支撑板上。包埋河泥和池泥的海绵卷共18个,其摆放方式如图1所示:在处理箱内部左侧放3层河泥海绵卷,每层3个;在处理箱内部右侧放3层池泥海绵卷,每层3个。为了保持海绵的湿度,使用蛭石和湿润纱布覆盖于海绵最上层。将驯化装置组装好后放入密闭玻璃箱进行甲醛气体处理。处理温度保持在20~30 ℃,每天添加适量清水,使海绵含水量保持在30%~40%。
1.3 活性污泥的驯化
将处理箱放入密闭玻璃箱进行甲醛驯化处理。向玻璃箱中添加甲醛,使其甲醛浓度从1 mg/m3起逐天递增至最终的15 mg/m3,连续闷曝15 d。
1.4 筛菌培养基的配制
筛菌培养基配方为: KH2PO40.5 g、K2HPO41 g、(NH4)2SO42.6 g、MgSO4·7H2O 0.2 g、CaCl20.01 g、FeSO4·7H2O 0.001 g、酵母膏1.6 g、琼脂1.5%[9]。使用5 mmol/L甲醇作为添加碳源,经0.2 μm滤膜过滤,加入到高压灭菌冷却的培养基中。
1.5 菌种的富集与培养
收集两种包埋活性污泥的海绵进行菌株富集与培养。每条海绵只剪取5 cm左右,并将其剪碎,置于200 mL三角瓶中,使用不含有琼脂的液体无机盐培养液进行菌种富集,于28 ℃摇床上振荡培养7 d。之后取出海绵,将剩余液体离心去上清,得到菌体,然后用500 μL无菌水悬浮,分别涂布在固体筛菌培养基上。于28 ℃培养,直到长出肉眼可见的菌落。挑选长势良好且形态不同的菌落进一步划线分离,从而获得单菌落。
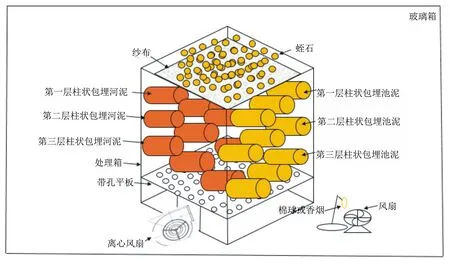
图1 驯化装置示意图
1.6 结晶紫染色
用接种针挑取少许菌落,涂布于干净的载玻片上并用清水稀释,自然晾干或用酒精灯火焰烘干。用0.1%结晶紫溶液染色1 min,用干净水流清洗。再用碘液媒染1 min,水洗。使用95%乙醇脱色30 s,至无色。使用番红复染2~3 min,水洗,吸干。用显微镜观察分离菌株细胞的形态和大小。
1.7 16s rRNA基因测序
将纯化好的菌落,送至北京硕擎生物科技有限公司进行16s rRNA基因测序。其16s rRNA基因引物为1492R:TACGGCTACCTTGTTACGACTT;27F:AGAGTTTGATCCTGGCTCAG。
1.8 甲醛处理
将甘油保存的筛选菌液以1%(v/v)接种于含有酵母膏的液体无机盐培养基中,于28 ℃摇床培养,待其OD600值达到0.5时备用。分别配制甲醛浓度为4、8、10、15和20 mmol/L的无机盐溶液。使用之前培养得到的OD600达到0.5的菌液,以1%(v/v)接种于含有不同浓度甲醛的培养基中,于28 ℃摇床培养。分别在培养后不同时间点(8、12、24、36、48、60、72 h)取样。离心后取上清,使用Nash法[10]测定甲醛浓度。
1.9 菌株H13CHO标记实验
为了分析H13CHO在菌体中的代谢途径,用20%的H13CHO配制成浓度为4 mmol/L的处理液[5 mmol/L KHCO3、28 μL H13CHO、0.1% MES (w/v, pH 5.7)]100 mL,取3 g左右菌体,浸没于处理液中,于25 ℃持续光照,摇床振荡培养(100 r/min);再以8000 r/min离心15 min,收集每个时间点的菌体及处理液;将菌体用清水清洗2~3次,离心收集菌株。加入2 mL蒸馏水,超声破碎15 min(超声5 s、停止8 s,反复循环),以1000 r/min离心,收集菌体上清并进行真空干燥,用0.5 mL无菌水溶解,加入5 μL去离子甲酰胺(5 mmol/L)作为内参,与处理液分别进行13C-NMR分析。
1.10 13C NMR分析
使用Bruker DRX 500-MHz(Bruker Biosciences Corporation, Billerica, MA)进行NMR分析。数据参数为:宽带质子去耦5 μs(90Ω)脉冲,光谱宽度37594 Hz,采集时间0.5 s,延滞时间1.2 s。在25 ℃常温下,每个样品采集32000个数据点,进行1200次扫描。数据处理时线宽为4 Hz。所有化学位移以甲酰胺共振峰(166.600 mg/kg)为参照。在对物质积分时,甲酰胺共振峰积分为1,其他物质以此为参照。
1.11 软件使用
使用AutoCAD画图及3D打印技术制作处理箱零部件。将获得的序列提交到NCBI的基因库。通过BLAST,下载相似性较高的相关序列,使用MAGA 5.0软件构建系统进化树。
2 结果与分析
2.1 驯化菌的分离及形态学观察
取位于驯化箱中不同层甲醛驯化包埋的活性污泥,将其所含有的微生物进行富集培养,涂抹在含有2 mmol/L甲醛的筛菌平板上。在池泥包埋活性污泥中,发现1个表面为灰白色的优势菌株。而在河泥包埋活性污泥中,发现1个表面为红色的菌株。将这两种菌种进一步纯化,得到单菌落。
取纯化单菌落,用结晶紫对分离菌株进行染色,在光学显微镜下用油镜放大1000倍,观察菌体细胞的形态,进行初步形态学观察,结果如图2所示。从甲醛驯化的河泥中分离的菌落我们命名其为R1,该菌株的菌落较小且呈圆形,红色,表面光滑湿润。从甲醛驯化的池泥中分离得到的优势灰白色菌落我们命名为Y1,该菌株的菌落为灰白色,不透明,菌落较大。
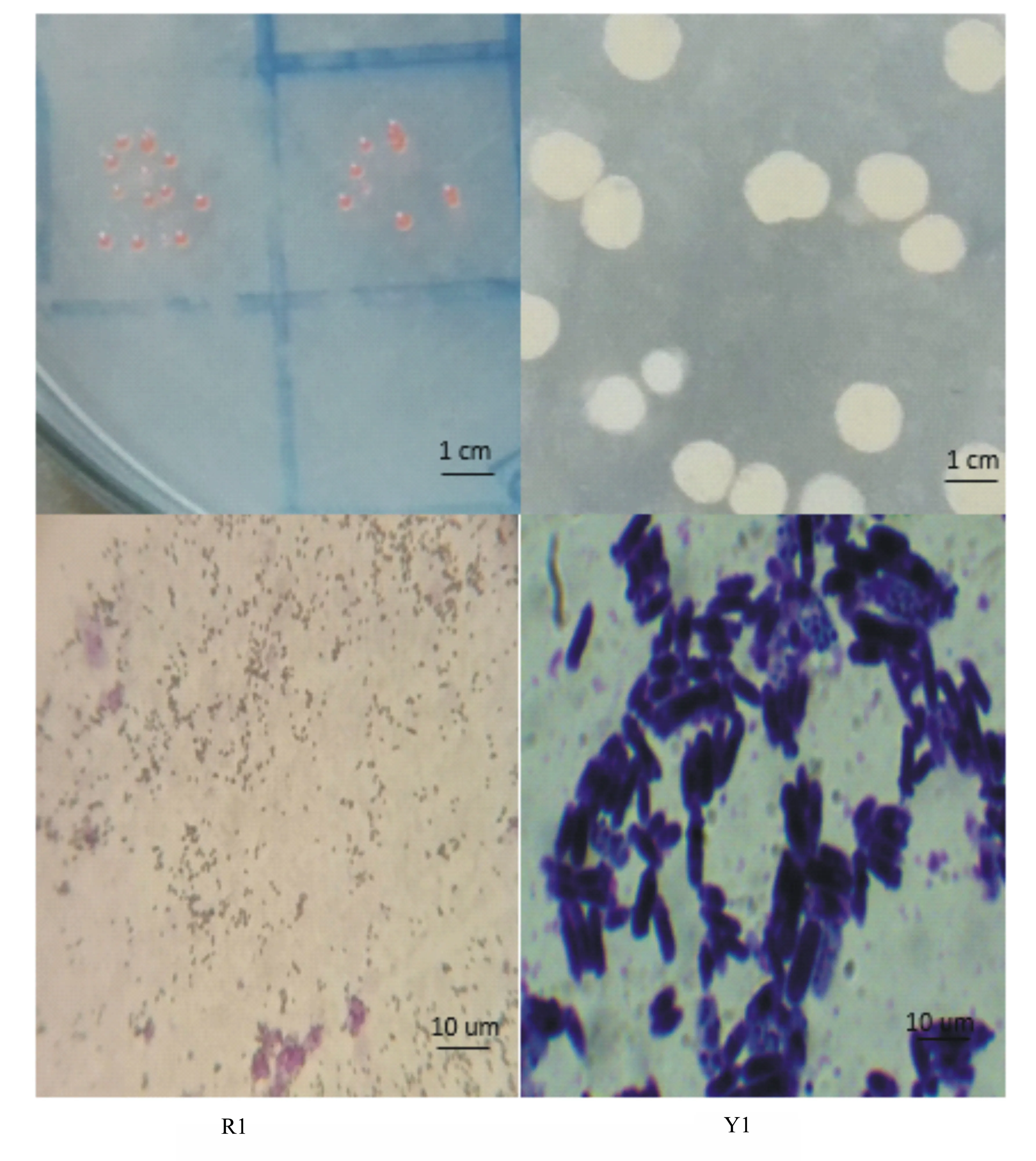
图2 两种分离菌株的菌落形态
2.2 菌株的分子生物学鉴定
将纯化好的R1菌株交由北京硕擎生物科技有限公司进行16s rRNA基因测序。测序长度为1344 bp;通过NCBI数据库进行BLAST比对,结果显示菌株R1与甲基杆菌(Methylobacterium)的同源性达到99%,初步鉴定其为甲基杆菌。进一步通过与其他具有代表性的几株菌株的16s rRNA基因序列的比对,构建菌株R1的系统发育树(图3左),结果表明菌株R1为甲基杆菌,且与甲基杆菌菌株MethylobacteriumzatmaniiDSM 5688的亲缘关系最近。
将纯化好的菌株Y1进行16s rRNA基因测序。测序长度为1341 bp;通过NCBI数据库进行BLAST比对,结果显示菌株Y1与蜡样芽孢杆菌(Bacilluscereus)的同源性达到99%,初步鉴定其为蜡样芽孢杆菌。进一步通过与其他具有代表性的几株菌株的16s rRNA基因序列的比对,构建菌株Y1的系统发育树(图3右),结果表明菌株Y1为蜡样芽孢杆菌,且其与蜡样芽孢杆菌菌株BacillusATCC14579和BacillusJH792233s最为相似。
2.3 筛选菌株对液体甲醛的吸收能力
为了检测菌株R1对甲醛的降解情况,把3 g菌R1分别浸没在含有4、8、10、15和20 mmol/L的甲醛溶液中,在不同时间点取样,测定溶液中剩余甲醛浓度,并以溶液中剩余甲醛浓度占起始甲醛浓度的百分率作图,所得结果如图4所示,随着时间的增加,不同处理液中剩余甲醛浓度都呈逐渐降低的趋势。在72 h时,菌R1能完全清除4、8 mmol/L处理液中的甲醛,而在10 mmol/L处理液中还有9%的甲醛剩余,在15 mmol/L处理液中有30%的甲醛剩余,在20 mmol/L处理液中有36%的甲醛剩余。这表明菌R1可以吸收甲醛,但其对不同浓度的液体甲醛吸收能力不同。菌R1对10 mmol/L以下浓度甲醛的吸收能力较强,对10 mmol/L以上浓度甲醛的吸收能力较差。菌R1对不同浓度液体甲醛的吸收速率可以根据溶液中甲醛挥发量和甲醛的剩余量计算得出,结果如图4所示。菌R1对不同浓度液体甲醛的吸收量与时间呈正相关关系,根据该吸收曲线的斜率可以计算菌R1对不同浓度液体甲醛的吸收速率。在0~12 h期间,菌R1对4、8、10、15和20 mmol/L液体甲醛的吸收速率分别为22.22、42.00、41.67、41.67和50.00 μmol/(L·g·h);在12~36 h期间,菌R1对4、8、10、15和20 mmol/L液体甲醛的吸收速率分别上升为22.22、42.33、48.61、29.17和33.33 μmol/(L·g·h);在36~72 h期间,菌R1对4、8、10、15和20 mmol/L液体甲醛的吸收速率分别为12.59、18.15、26.85、30.28和48.15 μmol/(L·g·h);说明甲基杆菌R1在12 h之内对甲醛的降解效率并不是太高,而在12 h之后其对甲醛的降解速率开始出现较大提升。这可能说明在12 h之前其生长比较缓慢,菌体较少;在12 h之后其逐步进入快速生长的对数期,菌量增多。而在36 h之后其对甲醛的降解速率又下降,可能是因为处理液中甲醛含量减少,导致菌R1可吸收的甲醛量减少。
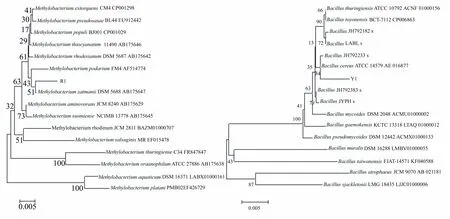
图3 菌株R1和Y1的系统进化树
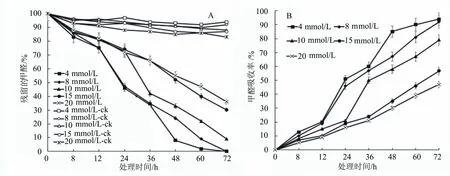
图4 菌株R1吸收不同浓度液体甲醛的动力学曲线
如图5所示,随着时间的增加,不同处理液中剩余甲醛浓度都呈逐渐降低的趋势。在72 h时,菌Y1能完全清除4 mmol/L处理液中的甲醛,而8 mmol/L处理液中还有16%的甲醛剩余,10 mmol/L处理液中还有38%的甲醛剩余,15 mmol/L处理液中有64%的甲醛剩余。这表明菌Y1可以吸收甲醛,但其对不同浓度的液体甲醛的吸收能力不同。菌Y1对不同浓度液体甲醛的吸收量可以根据溶液中甲醛挥发量和甲醛的剩余量计算得出,结果如图5所示。菌Y1对不同浓度液体甲醛的吸收量与时间呈正相关关系,根据该吸收曲线的斜率可以计算菌Y1对不同浓度液体甲醛的吸收速率。在0~12 h期间,菌Y1对4、8和10 mmol/L液体甲醛的吸收速率分别为13.89、22.00和13.89 μmol/(L·g·h);在12~36 h期间,菌Y1对4、8和10 mmol/L液体甲醛的吸收速率分别上升为18.61、35.44和34.72 μmol/(L·g·h),菌Y1对15 mmol/L液体甲醛的吸收速率为12.50 μmol/(L·g·h);这可能是由于在12 h之前菌Y1生长比较缓慢,菌体较少。在36~72 h期间,菌Y1对4、8、10和15 mmol/L液体甲醛的吸收速率分别为17.78、25.33、18.52和19.44 μmol/(L·g·h);以8、10和15 mmol/L液体甲醛的吸收速率结果为例,菌株Y1对液体甲醛的吸收量与时间呈幂函数关系。
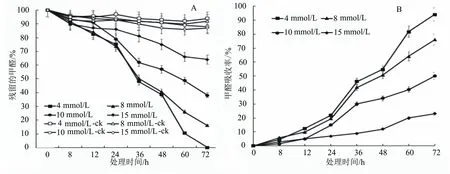
图5 菌株Y1吸收不同浓度液体甲醛的动力学曲线
2.4 菌株R1液体H13CHO代谢图谱分析
为了进一步了解菌R1的H13CHO代谢情况,首先用4 mmol/L液体H13CHO处理菌R1,处理时间分别为4 h和24 h。对菌R1液体H13CHO的代谢谱进行分析,并以未经任何处理的R1的13C NMR代谢谱作为对照。结果如图6所示,在H13CHO胁迫2 h时,大部分物质的信号峰都出现下降趋势;随着H13CHO处理时间的增加,所有物质的信号峰开始回升,最为明显的是[3-13C]Ser和[3,4-13C]Malate,在处理24 h时分别达到对照的5.6倍和6.0倍(表1),这表明[3-13C]Ser和[3,4-13C]Malate是菌R1 H13CHO代谢的主要产物。除此之外,相较于处理2 h时,处理24 h时的甲酸增加了2倍,[2-13C]Gly增加了6倍,PGA增加了4倍(表1)。
为了进一步探讨菌R1吸收代谢液体甲醛的生理机制,收集4 mmol/L液体H13CHO处理液进行核磁共振分析。由图7可知,在2 h时,处理液中本身含有H13CHO,但除此之外还出现了新的13C共振峰,解谱后我们发现其归属为甲酸,且此时的甲酸浓度是对照的34倍。说明R1在代谢甲醛的过程中不仅可以产生大量甲酸,而且还能将甲酸分泌到处理液中。随着处理时间的增加,甲酸的信号峰逐渐减弱,下降至2 h时的44%。说明随着时间的增加,分泌的甲酸又可以被R1作为碳源加以吸收代谢。
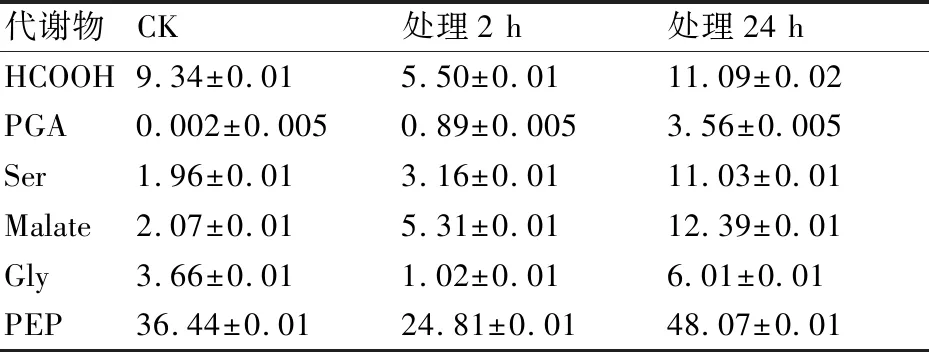
表1 4 mmol/L H13CHO处理4 h、24 h的菌R1中H13CHO代谢物的相对含量
2.5 菌Y1液体H13CHO代谢图谱分析
如图8所示,在4 mmol/L H13CHO胁迫下,Y1各物质信号峰在2 h时都有所下降,这可能是因为在早期甲醛对菌Y1产生了毒害作用。但之后在24 h时信号峰又出现回升,尤其是[3-13C]Ser、PEP、[2-13C]Gly、GSH等的信号峰回升较为明显,其中[3-13C]Ser是2 h时的1.75倍,[2-13C]Gly是2 h时的1.73倍,GSH是2 h时的1.27倍(表2)。
用0.5 mL无菌水溶解,加入5 μL去离子甲酰胺(5 mmol/L)作为内参,通过13C-NMR分析处理液中是否含有分泌的代谢产物,以不加甲醛处理的溶液为对照。结果(图9)发现:处理4 h后处理液中出现了游离甲酸,且此时的甲酸浓度是对照的30倍,说明Y1在代谢甲醛的过程中同样产生了大量甲酸,而且还能将甲酸分泌到处理液中。随着处理时间的增加,甲酸的信号峰逐渐减弱,下降至2 h时的90%,说明随着处理时间的增加部分分泌的甲酸又可以被Y1作为碳源加以吸收代谢。
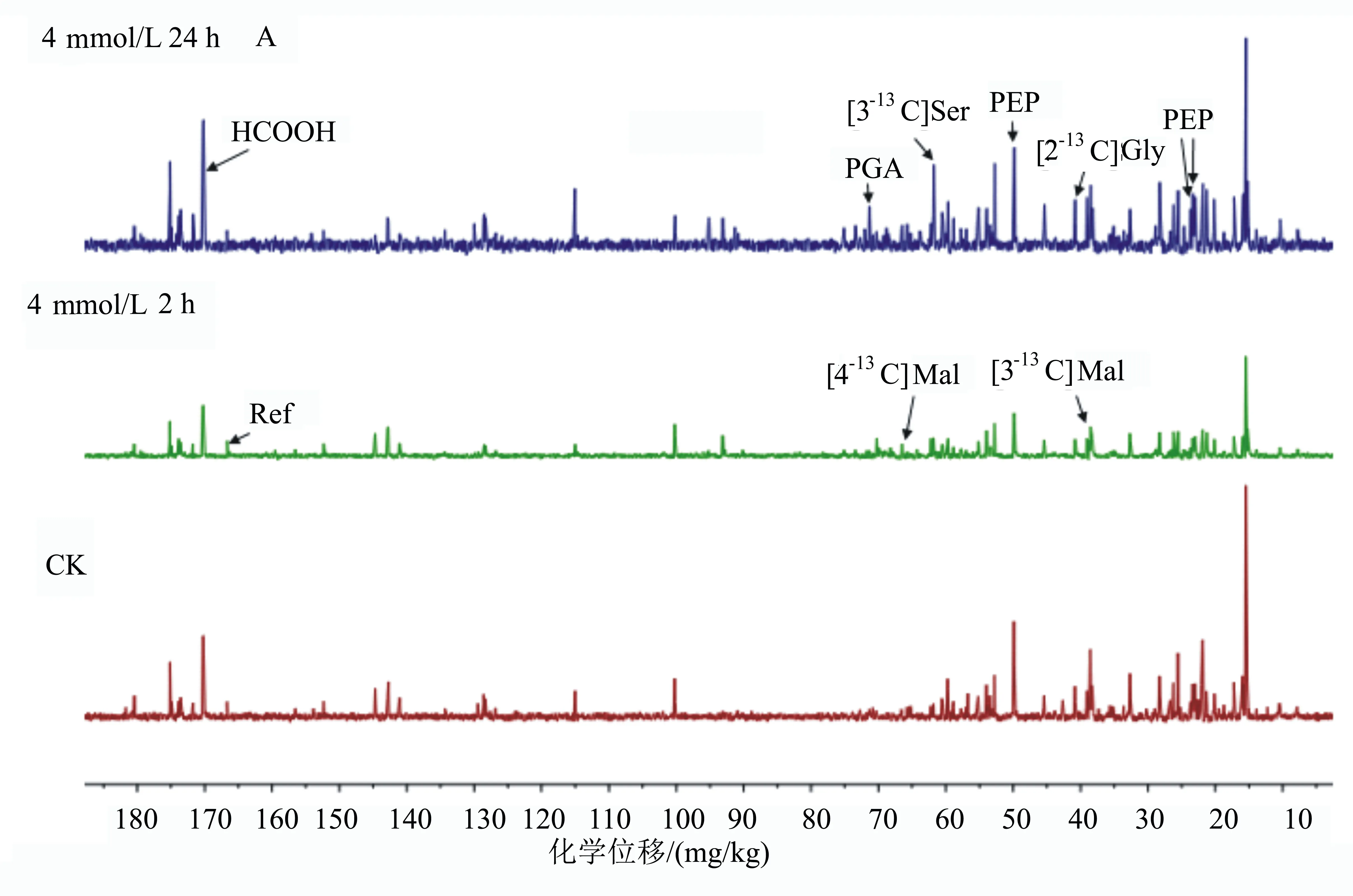
菌株R1代谢H13CHO的13C NMR全谱(H13CHO处理时间如图左端所示)。CK为未处理的菌株R1。13C NMR谱中各个共振峰的归属如下: Ref, 166.660 mg/kg (甲酰胺); H13COOH, 170.69 mg/kg; [3-13C]Ser, 60.08 mg/kg; [2-13C]Ser, 56.94 mg/kg; [2-13C]Gly, 40.41 mg/kg; [4-13C]Malate, 37.25 mg/kg; [3-13C]Malate, 66.88 mg/kg; PGA,71.42 mg/kg; PEP 27.13、50.19 mg/kg。
图6 菌株R1代谢H13CHO的中间产物分析结果
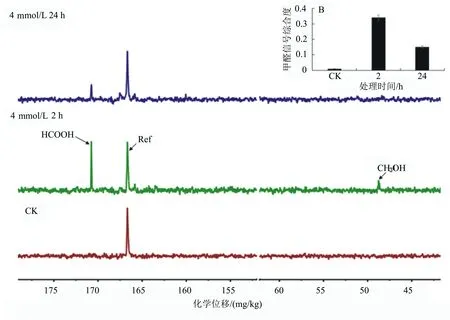
菌株R1 H13CHO处理液的13C NMR全谱(H13CHO处理时间如图左端所示)。其中B图为H13COOH的相对积分。13C NMR谱中各个共振峰的归属如下: Ref, 166.660 mg/kg (甲酰胺); H13COOH, 170.69 mg/kg。
图7 菌株R1 H13CHO处理液的13C-NMR分析结果
3 讨论
本研究在不同来源的活性污泥中分离鉴定出两种菌株,其中R1为甲基营养型的甲基杆菌(Methylobacterium),甲基杆菌又称为甲基营养菌(Methylotrophy),是一种能够利用低碳化合物如甲醛、甲醇、甲烷等碳源和能源的生物[11]。目前甲基杆菌主要被用来生产商业单细胞蛋白等物质以及环境的净化等[12]。我们筛选的甲基杆菌R1在20 mmol/L甲醛处理液中能去除36%的甲醛。相较于国内李章良等[13]筛选的菌株,菌R1有更好的吸收效率。Y1为非甲基营养型的蜡样芽孢杆菌(Bacilluscereus)。蜡样芽孢杆菌常见于土壤灰尘和污水中,在自然界广泛存在。大多数蜡状芽孢杆菌利用鞭毛运动,在固体培养基上呈不规则菌落,使用葡萄糖作为碳源但不能利用甘露糖、阿拉伯糖或木糖,可水解淀粉和明胶,具有溶血活性,可抗氨苄青霉素,并显示明显的卵磷脂酶活性。Kostka等[14]发现,革兰氏阳性菌如蜡样芽孢杆菌可用于石油等多环芳烃的降解。如蜡样芽孢杆菌ACE4可降解几乎所有的正烷烃污染物[15]。蜡样芽孢杆菌DRDU1在四周内可降解64%的原油和71%的柴油[16]。此外,Rupa Rani等[17]研究发现蜡状芽孢杆菌还可以用于硫丹等杀虫剂的降解。这些结果说明蜡状芽孢杆菌有降解有机物的作用。

菌株Y1代谢H13CHO的13C NMR全谱(H13CHO处理时间如图左端所示)。CK为未处理的菌株Y1。13C NMR谱中各个共振峰的归属如下: Ref, 166.660 mg/kg (甲酰胺); [3-13C]Ser, 60.08 mg/kg; [2-13C]Gly, 40.41 mg/kg; [4-13C]Malate, 37.25 mg/kg; [3-13C]Malate, 66.88 mg/kg; PGA, 71.42 mg/kg; PEP, 27.13、50.19 mg/kg; GSH,26.38、31.60、38.91、43.76、52.07、54.58、76.32 mg/kg。
图8 菌株Y1代谢H13CHO的中间产物分析结果
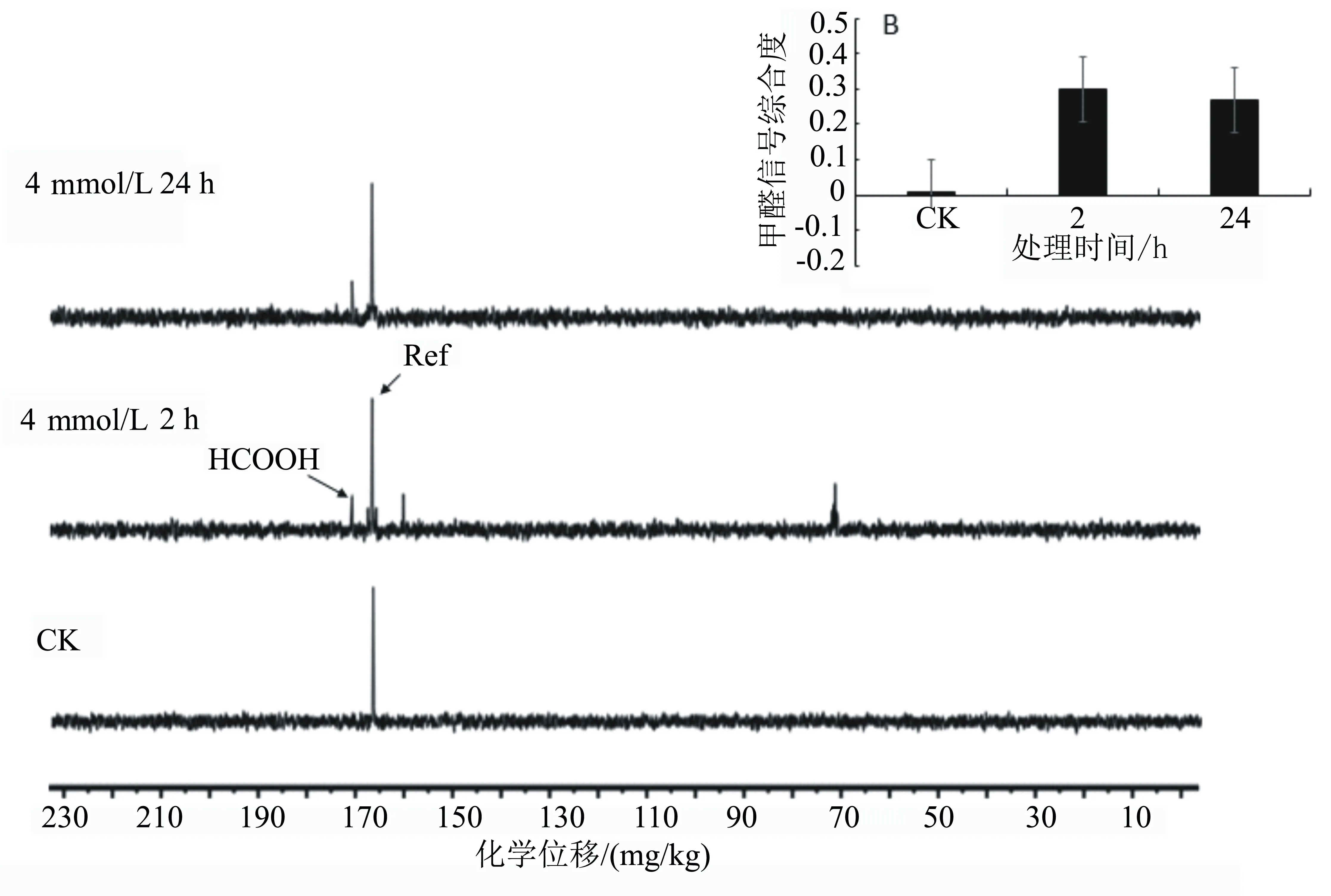
菌株Y1 H13CHO处理液的13C NMR全谱(H13CHO处理时间如图左端所示)。其中B图为H13COOH的相对积分。13C NMR谱中各个共振峰的归属如下: Ref, 166.660 mg/kg (甲酰胺); H13COOH, 170.69 mg/kg。
图9 菌株Y1 H13CHO处理液的13C-NMR分析结果
尽管早在20世纪初第一次发现了具有甲基营养能力的细菌,但是直到20世纪60年代至70 年代才对其生物化学性质有了初步的了解。近几十年的研究发现,甲基营养菌存在多种代谢形式,并对其代谢体系有了更深入的研究。甲基菌是一类可以利用非C-C键低碳化合物的微生物。C-C化合物在甲基菌体内首先被氧化成甲醛,随后甲醛有两种代谢途径:一种是甲醛异化途径,最终被氧化生成二氧化碳;另一种是在同化途径下最终转变为其自身组成[18]。13C NMR代谢谱表明菌株R1、Y1可以将甲醛同化为有机酸,因此菌株R1、Y1存在甲醛同化途径。很多甲基营养菌都有同化甲醛的丝氨酸途径,例如晁红军等[11]从沼气池残渣中分离出1株Methylobacteriumsp. MB200的甲基杆菌,研究发现其具有丝氨酸代谢途径,该途径会产生5,10-亚甲基四氢叶酸、丝氨酸、乙醛酸、苹果酸、甘氨酸等有机酸[19]。本研究筛选的菌株MethylobacteriumR1在代谢过程中产生了大量的关键产物[3-13C]Ser,随后在[3,4-13C]Malate以及[2-13C]Gly等产物中出现了13C标记,这与Quayle等[20]采用14C标记甲醇培养兼性甲基营养细菌(PseudomonasAM1)的结果类似,因此推测菌株R1可能存在丝氨酸途径。在BacilluscereusY1代谢过程中出现了大量的甲酸、谷胱甘肽等产物,说明菌株Y1同样有代谢甲醛的能力。
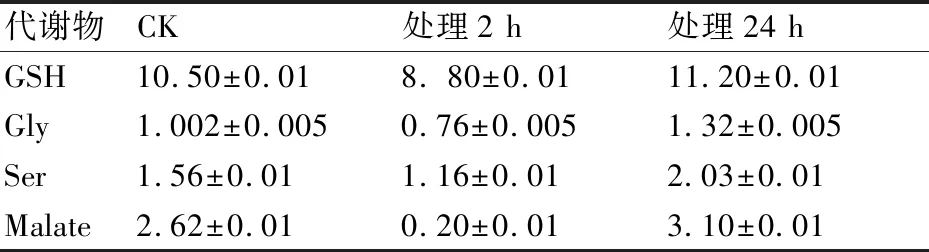
表2 4 mmol/L H13CHO处理4 h、24 h的菌Y1中H13CHO代谢物的相对含量
4 结论
本研究从采集的活性污泥中筛选得到两株具有高效吸收甲醛能力的菌株R1、Y1,根据其形态特征以及16s rRNA鉴定,判定菌株R1为甲基杆菌(Methylobacterium),菌株Y1为蜡样芽孢杆菌(Bacilluscereus)。
当甲醛初始浓度<4 mmol/L时,菌株R1和Y1都能够完全吸收溶液中的甲醛。当甲醛浓度增高至8、10、15 mmol/L时,菌株R1在72 h时的甲醛吸收率分别为100%、91%、70%;菌株Y1在72 h时的甲醛吸收率分别为84%、62%、36%。
13C NMR分析发现,用4 mmol/L H13CHO处理筛选的菌株R1,其主要代谢产物为HCOOH、PGA、[3-13C] Ser、[2-13C] Gly、[3,4-13C] Malate;处理筛选的菌株Y1,其主要代谢产物为GSH、[2-13C] Gly、[3-13C] Ser、PEP。进一步研究发现菌株R1、Y1在代谢甲醛的过程中会产生大量甲酸,并且会将甲酸分泌到处理液中;此后随着处理时间的增加部分分泌的甲酸又可以被菌株作为碳源加以吸收代谢。

