雷公藤甲素普通脂质体与包合物脂质体体外释药特点对比分析*
罗国平,闫梦茹,孟会宁,张孟丽,陈 程,王小宁
(1.西安医学院 药学院,陕西 西安 710021; 2.山东步长医药销售有限公司,山东 菏泽 274418)
脂质体是一种具有类生物膜结构的双分子层微囊,可作为水溶性药物和疏水性药物的载体,前者包载于脂质体的内水相,后者包载于脂质体双分子层内。目前,脂质体主要用于包载水溶性药物,而疏水性药物易受到药脂比等因素的限制,且某些疏水性药物还会干扰脂质双分子层的结构,从而影响脂质体的稳定性,使其在贮存过程发生药物泄漏。近年来有研究发现,利用环糊精(CD)与脂质体各自具备的优点,制备环糊精包合物脂质体,可以提高脂质体的稳定性,减少药物泄漏,提高载药量,改变药物的体内行为,同时使其在人体体内释药过程中具有缓释性,延长药物的作用时间[1]。在环糊精材料中,β-环糊精(β-CD)应用范围广,但水溶性较差;羟丙基-β-环糊精(HP-β-CD)为环糊精衍生物,是在β-CD母体结构基础上引入羟丙基,打破了β-环糊精的分子内环状氢键,在保持环糊精空腔的同时克服了β-环糊精水溶性差的缺点。雷公藤甲素是从雷公藤的根部中提取而来,是一个具有多种生物活性的环氧二萜内酯化合物,为治疗类风湿病制剂的主要有效成分,其水溶性差,生物利用度较低[2-3]。作者分别将雷公藤甲素包载于普通脂质体、β-CD包合物脂质体和HP-β-CD包合物脂质体中[4-5],采用透析法进行体外释药实验,对比分析雷公藤甲素3种不同脂质体的体外释药特点,为制备稳定性好、载药量大、生物利用度高和缓释长效的雷公藤甲素皮肤外用型制剂打基础[6]。
1 实验部分
1.1 试剂与仪器
雷公藤甲素原料药:质量分数96.8%,西安汇林生物科技有限公司;雷公藤甲素对照品:批号B20709,上海源叶生物科技有限公司;卵磷脂、胆固醇:药用规格,山东巨荣生物工程有限公司;β-CD,HP-β-CD:药用辅料,北京奥博星生物技术有限责任公司;乙醇:体积分数95%,1,2-丙二醇:分析纯,天津永晟精细化工有限公司;甲醇:色谱纯,无水乙醇、磷酸二氢钠、磷酸氢二钠:分析纯,天津市科密欧化学试剂有限公司;透析袋:6 mm,截留相对分子质量14 000,上海源叶生物科技有限公司。
集热式恒温加热磁力搅拌器:DF-101S,巩义市予华仪器有限责任公司;紫外分光光度计:Agilent Tech.Cary60UV-Vis,高效液相色谱仪:Agilent Tech.1260,美国安捷伦科技有限公司;台式高速离心机:TG-1650-WS,上海卢湘仪离心机仪器有限公司;超声波清洗机:SB-5200DT,宁波新芝生物科技股份有限公司;电子天平:BT125D,赛多斯科学仪器(北京)有限公司;马尔文激光粒度仪:ZEN-3600Malvern,英国马尔文仪器有限公司;恒温培养振荡器:ZHWY-100B,上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 雷公藤甲素3种脂质体的制备
(1)雷公藤甲素普通脂质体的制备[7]
精密称取雷公藤甲素、卵磷脂和胆固醇适量,置100 mL烧杯中,加入10 mL无水乙醇,超声(200 W,80 kHz)溶解后备用;搅拌(100 r/min)条件下将12 mL磷酸盐缓冲溶液(PBS)(pH=7.4,后同)缓慢注入上述溶液中,继续搅拌20 min,取出,超声(200 W,80 kHz)处理2 min,离心(离心力7 172×g)15 min,取沉淀另器保存,即得雷公藤甲素普通脂质体。
(2)雷公藤甲素β-CD包合物脂质体的制备[8-9]
参考文献[2],m(β-CD)∶m(雷公藤甲素)=10∶1制得的包合物有较高的包封率。精密称取β-CD粉末,加入45 ℃蒸馏水溶解制成饱和溶液;另精密称取雷公藤甲素粉末,加适量无水乙醇溶解后搅拌(800 r/min)条件下加入到上述制备好的β-CD饱和溶液中,保温45 ℃并继续搅拌2 h,然后冷藏24 h,取出,离心(离心力7 172×g)10 min,沉淀干燥(45 ℃)后另器保存,即得雷公藤甲素β-CD包合物。
精密称取卵磷脂和胆固醇适量,置100 mL烧杯中,加入10 mL无水乙醇,超声(200 W,80 kHz)溶解后备用;取上述雷公藤甲素β-CD包合物适量,加12 mL PBS溶液溶解,搅拌(100 r/min)条件下缓慢注入上述卵磷脂、胆固醇无水乙醇溶液中,继续搅拌20 min,取出,超声(200 W,80 kHz)处理2 min,离心(离心力7 172×g)15 min,取沉淀另器保存,即得雷公藤甲素β-CD包合物脂质体。
(3)雷公藤甲素HP-β-CD包合物脂质体的制备
精密称取HP-β-CD粉末,加入45 ℃蒸馏水溶解;另精密称取雷公藤甲素粉末,加适量无水乙醇溶解后搅拌(800 r/min)条件下加入到上述制备好的HP-β-CD溶液中,保温45 ℃并继续搅拌2 h,取出,冷冻干燥后另器保存,即得雷公藤甲素HP-β-CD包合物。
精密称取卵磷脂和胆固醇适量,置100 mL烧杯中,加入10 mL无水乙醇,超声(200 W,80 kHz)溶解后备用;取上述雷公藤甲素HP-β-CD包合物适量,加12 mL PBS溶液溶解,搅拌(100 r/min)条件下缓慢注入上述豆卵磷脂、胆固醇无水乙醇溶液中,继续搅拌20 min,取出,超声(200 W,80 kHz)处理2 min,离心(离心力7 172×g)15 min,取沉淀另器保存,即得雷公藤甲素HP-β-CD包合物脂质体。
1.2.2ρ(雷公藤甲素)测定
(1)雷公藤甲素最大吸收波长的检测
取雷公藤甲素对照品溶液,用紫外分光光度计在波长200~400 nm扫描吸收曲线。
(2)ρ(雷公藤甲素)的测定方法[10]
采用HPLC法,色谱柱:Agilent 5 TC-C18,150 mm×4.6 mm,流动相:V(水)∶V(甲醇)=50∶50,检测波长:218 nm,流速:1.0 mL/min,柱温:25 ℃,进样量:20 μL分别取对照品溶液、供试品溶液和阴性对照溶液,分别进样20 μL,记录色谱图。另取雷公藤甲素对照品,加甲醇分别配成质量浓度为6.64、19.92、33.20、53.12、79.68 μg/mL的对照品溶液,分别进样20 μL,记录峰面积(A),以雷公藤甲素的质量浓度(ρ)为横坐标,峰面积(A)为纵坐标,进行线性回归。
1.2.3 体外释药实验
采用透析袋扩散法进行体外释药实验[11-14],释放介质通常为生理盐水和PBS溶液,由于雷公藤甲素的溶解度小,故选择PBS溶液、φ(乙醇)=20%生理盐水和φ(乙醇)=40%生理盐水3种释放介质。具体操作为分别取1.2.1制得的雷公藤甲素3种脂质体沉淀(均相当于雷公藤甲素1.25 mg),各加入1 mL甲醇(破囊剂)和1 mL PBS溶液,置透析袋中,将透析袋放入装有20 mL释放介质的离心管中(注意透析袋内外液面一致),再将离心管置于37 ℃恒温培养振荡器中,控制转速为100 r/min,恒温释放24 h,分别于第1、2、4、6、8、12、24 h 7个时间点吸取1 mL释放介质(同时补充等体积新鲜释放介质),过滤(0.45 μm微孔滤膜),取续滤液20 μL进样,用HPLC法测定ρ(雷公藤甲素),并按照式(1)计算各时间点雷公藤甲素的累积释药率。以取样时间为横坐标,累积释药率为纵坐标绘制释药曲线。
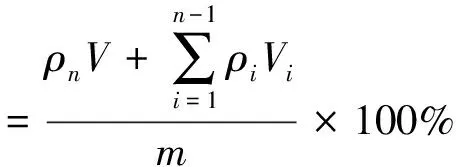
(1)
式中:ρi和ρn分别为第i次和第n次取样时,释放介质中ρ(雷公藤甲素),mg/mL;V为释放介质的体积,mL;Vi为第i次的取样体积,mL;m为脂质体样品中雷公藤甲素的总质量,mg。
2 结果与讨论
2.1 ρ(雷公藤甲素)测定
2.1.1 雷公藤甲素最大吸收波长的检测
雷公藤甲素对照品溶液波长200~400 nm吸收曲线见图1。
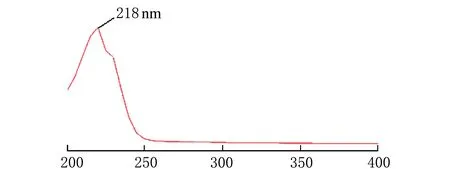
λ/nm图1 雷公藤甲素对照品吸收曲线
2.1.2ρ(雷公藤甲素)测定方法
雷公藤甲素对照品溶液、供试品溶液和阴性对照溶液HPLC图见图2。
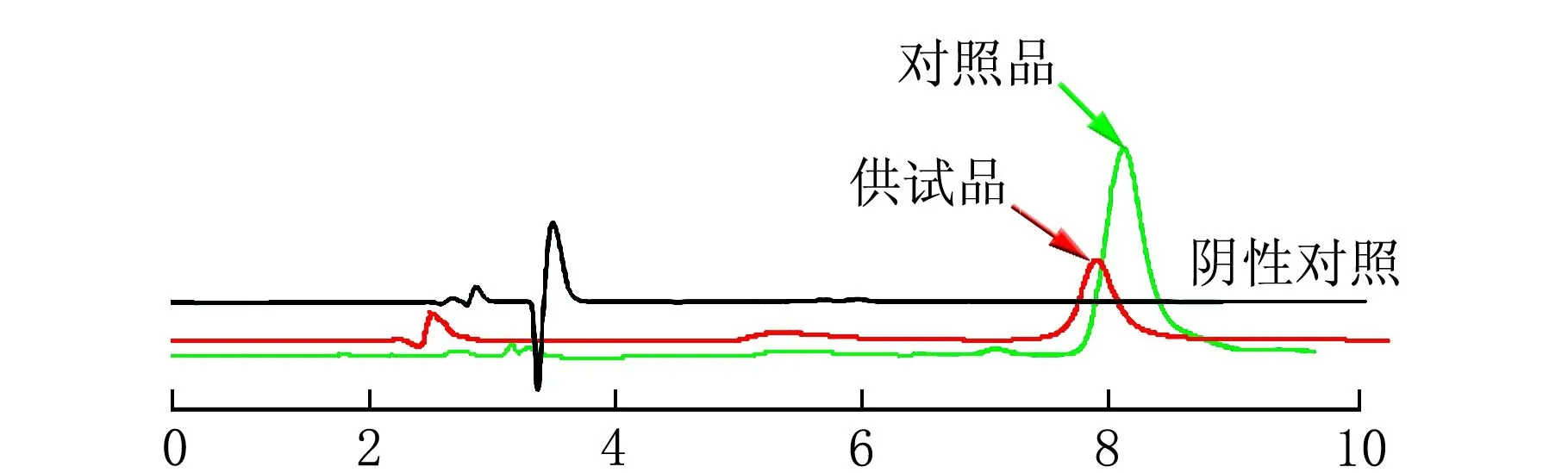
t/min图2 对照品、供试品与阴性对照溶液的色谱图
由图2可知,供试品溶液中雷公藤甲素的色谱峰与杂质峰之间能得到很好的分离,且辅料对主药的测定无干扰,方法专属性良好。以雷公藤甲素质量浓度(ρ)为横坐标,峰面积(A)为纵坐标,进行线性回归得回归方程:y=253 82x-9.201 6,r=0.999 9,说明ρ(雷公藤甲素)=6.64~79.68 mg/mL线性关系良好。
2.2 体外释药实验
2.2.1 不同释放介质对释药的影响
雷公藤甲素同一种脂质体分别在3种不同的释放介质中的释药曲线,见图3。
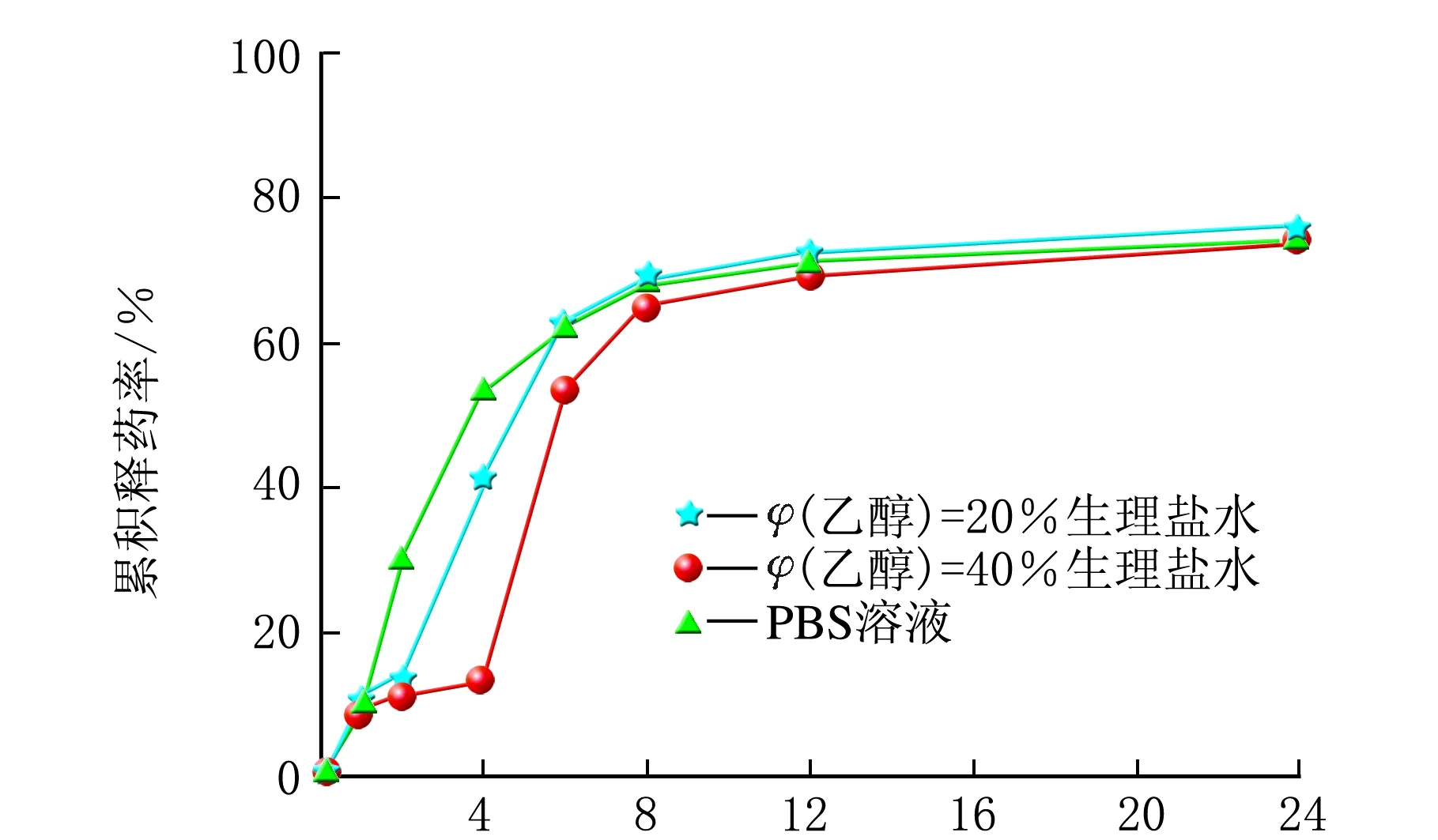
t/ha 雷公藤甲素普通脂质体
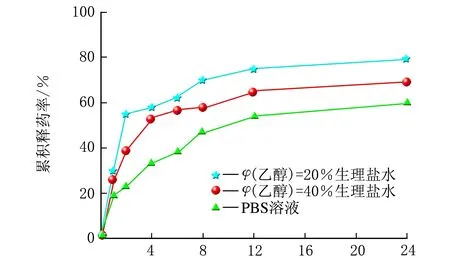
t/hb 雷公藤甲素β-CD包合物脂质体
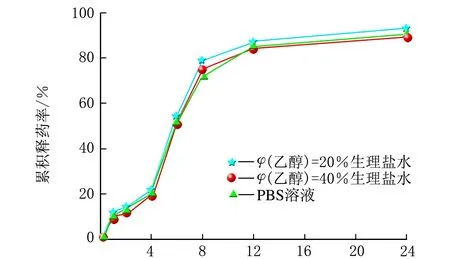
t/hc 雷公藤甲素HP-β-CD包合物脂质体图3 雷公藤甲素3种脂质体分别在3种释放介质中的释药曲线
由图3可知,t=0~1 h,雷公藤甲素普通脂质体在3种释放介质中的释药速度相当;t=1~8 h,释药速率有差异,排序为PBS溶液>φ(乙醇)=20%生理盐水>φ(乙醇)=40%生理盐水;t=8~24 h,释药速率较慢,基本趋于平稳;24 h内的累积释药率均约为70%。雷公藤甲素β-CD包合物脂质体在3种释放介质中的释药速率和各时间点的累积释药率排序均为φ(乙醇)=20%生理盐水>φ(乙醇)=40%生理盐水>PBS溶液,24 h内的累积释药率分别约为80%、70%和60%。雷公藤甲素HP-β-CD包合物脂质体在3种释放介质中的释药速率和各时间点的累积释药率都相当,无显著差异,且24 h内的累积释药率均约为90%。由此可见,同一种脂质体在不同释放介质中的释放曲线不尽相同,有时差异还很大。
2.2.2 不同脂质体对释药的影响
雷公藤甲素3种不同的脂质体分别在同一种释放介质中的释药曲线,见图4。
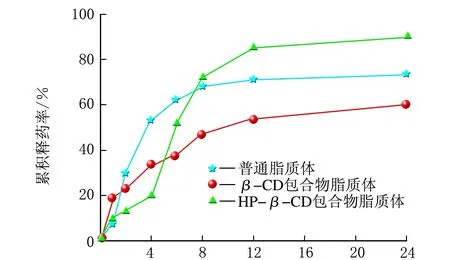
t/ha PBS溶液
t/hb φ(乙醇)=20%生理盐水
t/hc φ(乙醇)=40%生理盐水图4 雷公藤甲素3种脂质体分别在3种释放介质中的释药曲线
由图4可知,3种脂质体分别在φ(乙醇)=20%生理盐水和φ(乙醇)=40%生理盐水中的释药曲线差异很小,与在PBS溶液中的释药曲线差异较大,主要原因是φ(乙醇)=20%生理盐水和φ(乙醇)=40%生理盐水的组成相似。同时也可以看到,在同一种释放介质中,不同种类脂质体的释药曲线也不同,分析其主要原因是不同种类脂质体的构成有差异,雷公藤甲素普通脂质体中药物包载在脂质双分子层内,而雷公藤甲素β-CD包合物脂质体和HP-β-CD包合物脂质体中药物包载在内水相中,导致普通脂质体与包合物脂质体的释药过程会有差异;另外,同样是包合物脂质体,不同包合材料由于溶解性的差异和空间位阻效应也会造成释药过程的变化。
通过上述分析可知,不同释放介质会对3种雷公藤甲素脂质体的体外释药曲线造成不同程度的影响,影响最大的是β-CD包合物脂质体、其次是普通脂质体,影响最小的是HP-β-CD包合物脂质体。考虑到体外实验的条件应尽可能与人体体液条件接近,因此最终确定PBS溶液作为雷公藤甲素3种脂质体体外释药实验的释放介质。
2.2.3 3种载药脂质体在PBS溶液中的释药特点
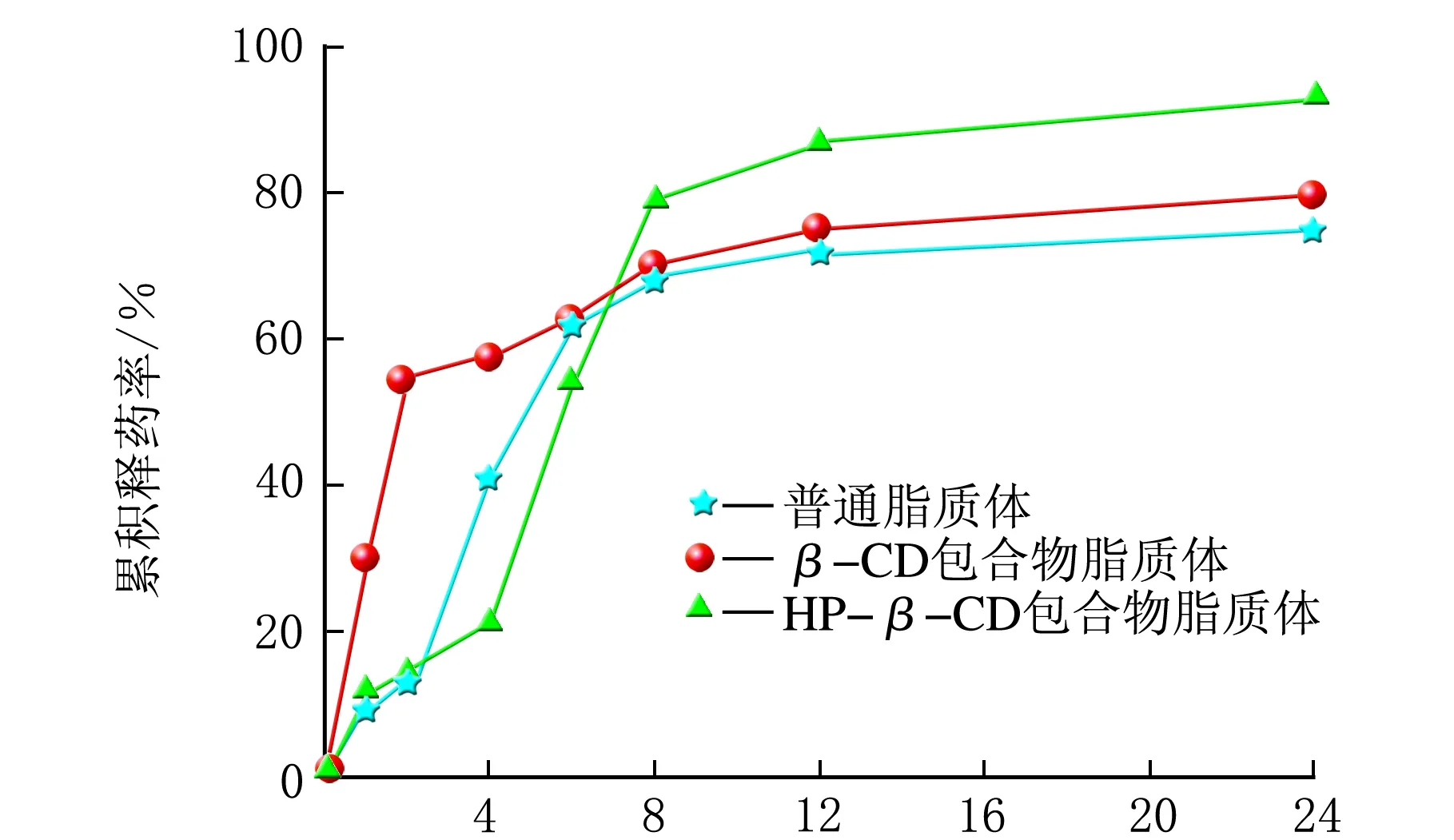
雷公藤甲素3种脂质体在PBS溶液中的释药特点对比分析,结果见图5。
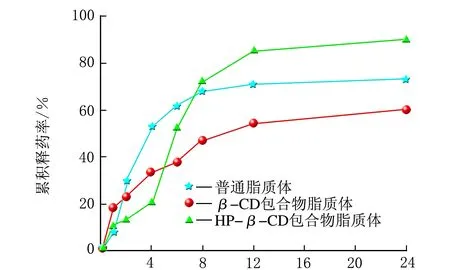
t/h图5 3种脂质体在PBS溶液中的累积释药率趋势图
由图5可知,t=0~4 h,雷公藤甲素普通脂质体的释药速率最快,其次为雷公藤甲素β-CD包合物脂质体,雷公藤甲素HP-β-CD包合物脂质体释药速率最慢;从4 h开始,雷公藤甲素HP-β-CD脂质体释药速率明显加快,在约5 h,累积释药率超过雷公藤甲素HP-β-CD包合物脂质体,在约8 h,累积释药率超过雷公藤甲素普通脂质体;t=8~24 h,雷公藤甲素普通脂质体的累积释药率基本达到平衡,而雷公藤甲素β-CD包合物脂质体和HP-β-CD包合物脂质体还持续缓慢释放;24 h内的累积释药率排序由高到低为雷公藤甲素HP-β-CD包合物脂质体>普通脂质体>β-CD包合物脂质体,累积释药率依次为90.0%、73.0%和60.0%。
3 结 论
作者将雷公藤甲素分别用β-CD和HP-β-CD包合后再包封于脂质体的内水相形成包合物脂质体,与制备的雷公藤甲素普通脂质体通过体外释药实验进行对比分析,发现(1)同一种脂质体在不同释放介质中的释药曲线会有差异,不同类型脂质体在同一种释放介质中的释药曲线也不一样;(2)与普通脂质体相比,β-CD包合物脂质体具有明显的持续缓释作用,而HP-β-CD包合物脂质体释药初期具有缓释作用,中期释药加速,后期又趋缓;β-CD包合物脂质体和HP-β-CD包合物脂质体释药行为差异的主要原因是不同包合材料的溶解度和空间位阻效应不同;(3)雷公藤甲素HP-β-CD包合物脂质体的释药最为充分,24 h内的累积释药率达90.0%,其原因是HP-β-CD具有良好的水溶性[15]。通过对比分析雷公藤甲素3种不同脂质体的体外释药特点,可为制备稳定性好、载药量大、生物利用度高和缓释长效作用的雷公藤甲素皮肤外用型制剂打基础。

