鸭沙门菌高密度发酵工艺的研究
任士飞 张林吉* 迟兰 房超
试验研究
鸭沙门菌高密度发酵工艺的研究
任士飞①张林吉①*迟兰①房超②
(①徐州生物工程职业技术学院 江苏 徐州 221006 ②中华人民共和国徐州海关 江苏 徐州)
为了提高鸭沙门菌的生产量,简化生产流程降,低生产成本。以GMP为生产指导原则,采用10L发酵罐对影响鸭印第安纳沙门菌高密度发酵的温度、pH值、相对溶氧量、接种量等7个方面进行单因子优化试验。研究结果显示,鸭印第安纳沙门菌在以4%接种量,培养温度为38℃,维持培养基的pH值为7.5,保持溶氧量为40%,150rpm/min的转速和连续补加葡萄糖的方式培养20h后,发酵菌数可达到53.7亿CFU/ml,本研究结果为沙门菌疫苗大规模发酵生产奠定了基础。
鸭沙门菌 高密度发酵 优化
鸭沙门菌病(Duck Salmonellosis)又称为鸭副伤寒,是鸭的一种急、慢性传染病,主要由于鸭感染了一种或几种沙门氏菌而引起,病原菌主要包括鼠伤寒沙门氏菌、肠炎沙门氏菌、鸭沙门氏菌和印第安纳沙门氏菌等[1, 2]。大多数情况下,鸭沙门氏菌病多发生于雏鸭,成年鸭感染沙门菌常属隐性感染,但有时也会出现严重的临床疾病,并伴有高死亡率。高密度发酵培养是进行细菌疫苗生产的一种主要发酵工艺。采用发酵罐培养,可以缩小生物反应器的体积,简化培养基的制备,提高单位体积菌体的密度及产量,从而降低疫苗生产成本。影响高密度发酵的因素很多,如细菌生长所需要的培养基成分及pH值、接种密度、培养温度及时间、溶氧浓度及搅拌速度和补料方式等。
本研究针对徐州地区鸭沙门菌主要流行血清型-印第安纳沙门菌,在GMP原则的指导下,对印第安纳沙门菌进行高密度发酵培养,对影响培养因素进行探究优化,有效提高疫苗的生产效率。
1 材料与方法
1.1 材料
1.1.1 菌种与培养基 印第安纳沙门菌为徐州动物疫病工程技术研究中心分离鉴定并保存,沙门菌合成培养主要成分:胰蛋白胨和酵母浸粉(购自OXOID公司)、葡萄糖、KH2PO4、NaH2PO4、NaCL、NaCO3、NaOH、赖氨酸等化学试剂(购自南京智睿生物科技有限公司)、LB固体培养基(购自青岛海博生物技术有限公司)。
1.1.2 主要仪器 10L发酵罐(镇江东方生物工程设备技术有限公司)、便携式酸度(上海雷磁仪器厂)、溶氧分析仪(希仕代仪器贸易(上海)有限公司)。
1.2 方法
培养条件的优化设计按照单因子顺序进行,每项优化的结果都用于以后的试验,共进行以下7个参数的优化,发酵结束时,按照现行中国兽药典方法进行活菌计数[3]。
1.2.1 培养温度优化 在6L合成培养基中,按照3%的接种量,200rpm/min,保持溶氧指数在40%,温度设定35~40℃之间,pH值为7.5的培养基中培养18h,分别进行活菌计数。
1.2.2 pH值优化 按照3%的接种量,38℃,200rpm/min,保持溶氧指数在40%,发酵培养基pH值分别调为6.0、6.5、7.0、7.5、8.0和8.5,发酵过程中采用通过滴加NaOH溶液、NaCO3溶液或赖氨酸溶液三种方式来维持培养基pH值恒定,培养18h,分别进行活菌计数。
1.2.3 接种量优化 按照不同的接种量1.5%、2%、2.5%、3%、4%和5%,38℃,200rpm/min,保持溶氧指数在40%,在pH值为7.5为培养基中培养18h,分别进行活菌计数。
1.2.4 通气量优化 按照4%的接种量,38℃,200rpm/min,在pH值为7.5为培养基中培养。发酵过程中以不同的通气量,使溶氧指数到达20%、30%、40%、50%和60%,培养18h,分别进行活菌计数。
1.2.5 转速优化 按照4%的接种量,38℃,保持溶氧指数在40%,转速设为100rpm/min、150rpm /min、200rpm/min、300rpm/min,在pH值为7.5为培养基中培养18h,分别进行活菌计数。
1.2.6 培养时间优化 按照4%的接种量,38℃,保持溶氧指数在40%,转速150rpm/min,在pH值为7.5为培养基中培养8h后,每隔2h取样,进行活菌计数。
1.2.7 补加碳源优化 按照4%的接种量,培养温度38℃,保持溶氧指数在40%,转速为150rpm /min。培养8h后,开始补加浓度为50%的葡萄糖溶液0.5L,补加采用三种方式:一次性补加;分4次补加,每次间隔2h;连续流加至发酵培养结束,培养20h,分别进行活菌计数。
2 结果与分析
2.1 培养温度优化
沙门菌发酵培养菌体密度随温度升高而升高,但在37.5~38℃时增长速度最佳,温度超过38℃后,活菌数量开始减少,不同温度下菌体密度如表1所示。综合沙门菌培养特性、温度和最终菌体密度等因素,本试验设定培养温度为38℃。

表1 培养温度对菌体密度的影响 (亿CFU/ml)
2.2 pH值优化
细菌计数结果显示,pH值在7.5~8.0时最终菌体密度达到最大,pH值过低或过高,最终菌体密度都降低,均达不到良好的培养效果(见表2)。保持培养基的pH值在7.5时,所得到的菌体密度相对最高,故沙门菌发酵培养的最适pH值为7.5。
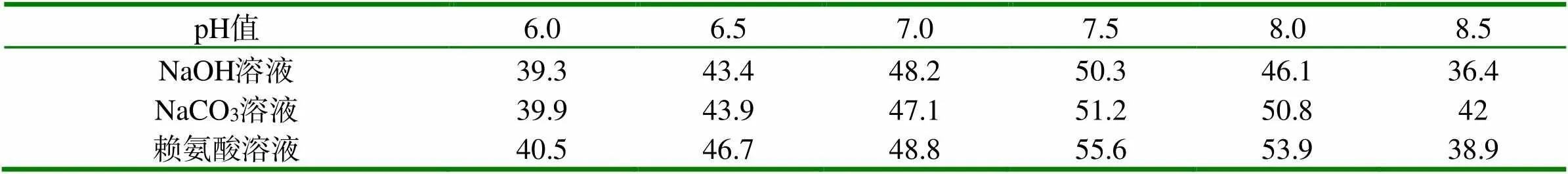
表2 pH值对菌体密度的影响(菌体计数) (亿CFU/ml)
2.3 接种量优化
接种量可以对细菌生长产生较大的影响(见表3)。适宜的接种密度有助细菌的生长,过低的接种密度会使菌体生长缓慢,过高的接种密度会使营养物质在发酵早期大量消耗,不利于细菌在对数生长期的生长,并且造成种子菌种的浪费。所以,选择4%的接种量较为适宜。

表3 接种量对菌体密度的影响 (亿CFU/ml)
2.4 通气量优化
根据不同溶氧指数得到的发酵系统的菌体密度(见表4)。结果表明,菌体密度随着溶氧指数的增加而增加,但40%以后菌体密度增加缓慢。

表4 通气量对菌体密度的影响 (亿CFU/ml)
2.5 转速优化
细菌计数结果表明,随着转速的增加菌体密度增加,当转速到达300rpm/min时,细菌计数反而降低(见表5)。不同的搅拌速度会对溶氧产生一定的影响,但随着转速的增加会产生大量的气泡,会对菌体的生长产生不利影响,所以,后续试验采用的最佳转速为150rpm/min。
2.6 培养时间优化
不同培养时间的菌体密度测定结果显示(见表6),18~20h为最佳培养时间,表明细菌正处于对数生长期末期,超过20h以后菌体密度增加缓慢。为缩短发酵培养时间,细菌的收获应在尚未进入衰退期前,选择发酵时间为20h为宜。

表6 培养时间对菌体密度的影响 (亿CFU/ml)
2.7 补加碳源优化
补加碳源有利于细菌的生长,但不同的碳源补加方式对菌数的影响明显不同(见表7),结果显示以连续补加方式效果最好。

表7 补加碳源对菌体密度的影响 (L、亿CFU/ml)
3 讨论与小结
(1)发酵罐发酵培养已广泛应用于兽用细菌类疫苗的生产,但发酵工艺是一个复杂的系统,不仅涉及到所采用发酵培养的方式,而且还涉及到具体的发酵参数,如温度、pH值、通气量等因素[4, 5]。本试验通过对沙门菌的培养温度、时间、pH值、通气量、接种密度、转速和补加碳源等7项参数进行优化,基本确定了10L发酵罐的高密度培养条件。(2)细菌的生长发育受到其环境pH值影响,pH值的改变会直接影响菌体密度及产量,因此,在发酵培养过程中要保持一定的pH值[6]。试验中发现在pH值下降时采用不同碱性溶液调节的效果有一定的差异。采用强碱氢氧化钠溶液时,因为碱性太强,可使培养基pH值在瞬间有较大幅度的回升,反而不利于菌体的生长。碳酸钠对pH值调整能力弱,用量较大。赖氨酸为碱性氨基酸,既可以调节pH值,又可以明显促进菌体生长,适合做为培养基pH值调节剂。(3)接种量是指接种的种子液体积与发酵液体积的比列。接种量的大小决定了发酵初始时菌体的菌体密度以及菌体后续生长速度[7]。试验结果显示,过低的接种量会使菌体生长缓慢,发酵结束时菌体密度过低。但过高的接种量会使菌体生长过快,大量营养物质在对数生长期前被消耗,反而会影响后续生长,造成菌体死亡增加,活菌数量减少。因此,接种量的确定要根据发酵的实际情况,最终确定为4%。(4)溶解浓度是影响细菌高密发酵的重要因素之一[8]。溶氧浓度过低或过高都会影响菌体的生长。在一定范围内,溶氧浓度随着通气量增加和搅拌速度增加而增大。但,随着通气量和转速的增加,会产生大量的泡沫,反而会导致溶氧浓度的降低。所以,发酵培养过程中,可以通过调节转速和通气量将溶氧指数控制点维持恒定。本实验采用逐渐增大通气量,由发酵开始时的1m2/h,逐渐增加到1.8m2/h,维持发酵体系溶氧指数稳定在40%。(5)分批补料发酵是最近流行的一项新技术,已被广泛应用与细胞高密度发酵。主要包括恒反馈补料和非反馈补料。由于流加方式的不同,它们对菌体生长的影响也不相同。因为,指数恒速流加法比较简单,不需要复杂设备,所以该技术已广泛用于大肠杆菌高密度发酵生产[9]。(6)疫苗发酵生产用的发酵罐体积较大,一般从几百升至上千升,不同体积的发酵罐,其发酵参数也不尽相同[10]。未来将在10L发酵罐高密度发酵条件的基础上,进一步尝试在200L至500L发酵罐中进行发酵优化,并探索一套标准化的生产工艺,使沙门菌的发酵培养更加简便、快速和经济,进一步具备工业生产化的潜力。
[1] Saif YM, Barnes HJ, Glisson JR, et al. Diseases of poultry[M]. Ames: Iowa State University Press, 2003, 567-614.
[2] A A TyceB著, 杨锡林译. 禽沙门民共和国兽药点»三部(2010版)[S].
[4]李寅, 高海军, 陈坚. 高细胞密度发酵技术[M]. 北京:化学工业出版社, 2006: 6-340.
[5] 刘文波, 柴同杰. 大肠杆菌高密度发酵研究[J]. 动物科学与动物医学, 2001,18(1): 27-29.
[6] 陆庆泉, 深志强, 刘吉山等. 鸡致病性大肠杆菌高密度发酵条件优化的研究[A]. 中国畜牧兽医学会禽病分学会第十一次学术研讨会论文集[C], 2002.
[7] 陈国怀, 曹玲, 罗广等. 甲型副伤寒沙门菌培养条件的优化[J]. 微生物学免疫学进展, 2018, 42(4): 26-28.
[8] 朱良全, 孙晔, 刘延亭等. 仔猪副氏菌病的预防及减少微生物对禽侗体的污染[J]. 肉品卫生, 1998, 11: 28-29.
[3] 中国兽药典委员会. 中华人伤寒活疫苗合成培养基发酵工艺应用研究[J]. 中国兽医杂志, 2016, 50(3): 16-20.
[9] 霍向东, 石玉瑚. 大肠杆菌高密度发酵补料调控策略的研究进展[J]. 新疆农业科学, 2004, 41: 16-18.
[10] 张嗣良. 发酵过程中多水平问题及其生物反应器装置技术研究-基于过程参数相关的发酵优化与放大技术[J]. 中国工程科学, 2001, 3(8):37-44.
徐州市科技局重点研发计划项目 (KC18155)
(2019–10–21)
S852.61
A
1007-1733(2020)01-0001-03

