PD-1抑制剂致肌炎伴重症肌无力1例分析
郭凯 朱斌 汪丰

摘 要 PD-1抑制剂的广泛临床使用在改善肿瘤治疗效果的同时,其日渐增多的严重免疫相关不良反应也值得关注。本文对1例国产PD-1抑制剂(信迪利单抗)在肺癌患者治疗两周期后出现全身酸痛,伴胸闷、气促的案例进行了讨论分析。该患者考虑为PD-1抑制剂治疗后引起免疫相关性肌炎累及心肌、横纹肌溶解伴重症肌无力的重叠综合征。予以激素冲击联合免疫球蛋白抗炎治疗、溴吡斯的明对症治疗,期间行血浆置换治疗,患者治疗结果好转。因此,及时、足量的糖皮质激素,联合免疫球蛋白以及溴吡斯的明可以用于PD-1抑制剂引起的免疫相关性多发肌炎伴重症肌无力的治疗。
关键词 PD-1抑制剂 肌炎/心肌炎 重症肌无力 信迪利单抗 不良反应
中图分类号:R979.19; R969.3 文献标志码:C 文章编号:1006-1533(2020)03-0056-04
A case report of myositis and myasthenia gravis induced by PD-1 inhibitors treatment
GUO Kai*, ZHU Bin, WANG Feng**
(Department of Pharmacy, Shanghai Cancer Center, Fudan University; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
ABSTRACT The clinical widespread use of PD-1 inhibitors not only improves the therapeutic effect of tumors, but also its increasing number of serious immune-related adverse reactions is also worthy of attention. Some severe, potentially lifethreatening adverse reactions such as systemic soreness with chest tightness, shortness of breath and discomfort and ECG changes, rise of creatine kinase and myocardial markers occurred in a non-small cell lung cancer treated with home-made sintilimab for two treatment courses were analyzed. This patient was considered to be immune-related myositis involving myocardium and rhabdomyolysis with myasthenia gravis (MG) overlap syndrome caused by PD-1 inhibitor treatment and was treated with steroid, immunoglobulin and symptomatic treatment of pyridostigmine and meanwhile plasma exchange was performed. The patients condition was improved after treatment. Therefore, the occurrence of severe immune-related adverse reactions should be alerted when PD-1 inhibitors need to be used. Timely and sufficient glucocorticoids combined with immunoglobulins and pyridostigmine should be used for the treatment of immune-related polymyositis with myasthenia gravis caused by PD-1 inhibitor therapy.
KEY WORDS PD-1 inhibitors; myositis/myocarditis; myasthenia gravis; sintilimab; adverse events
近年来,免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的临床应用显示出了巨大的优势和发展潜力,对于肿瘤免疫治疗具有重大意义。程序性死亡受体-1(programmed cell death protein-1, PD-1)是重要的免疫检查点之一[1]。PD-1抑制剂能够特异性结合T细胞表面的PD-1分子,从而阻斷导致肿瘤免疫耐受的PD-1/程序性死亡受体配体-1(programmed death ligand-1, PDL1)通路、重新激活免疫细胞的抗肿瘤活性,达到治疗肿瘤的目的。目前,国内上市的PD-1抑制剂有纳武利尤单抗(欧狄沃)、帕博利珠单抗(可瑞达),以及国产特瑞普利单抗(拓益)、信迪利单抗(达伯舒)和卡瑞利珠单抗(艾立妥)。
ICIs在改善肿瘤治疗效果的同时也产生了许多免疫相关不良反应(immune-related adverse events, irAEs)[2]。一些威胁生命的免疫相关不良事件,包括心肌炎、心力衰竭,横纹肌溶解、继发呼吸困难肌炎以及致死性重症肌无力(myasthenia gravis, MG)的病例在PD-1抑制剂治疗中有报道[3-6]。因此,在使用ICIs的同时要警惕这些严重的免疫相关不良反应的发生。本文报道1例使用国产PD-1抑制剂信迪利单抗注射液用于肺癌术后复发治疗而诱发肌炎伴MG经治好转的案例,希望为临床相关不良反应的防治提供参考。
1 病史摘要
患者,男性,67岁,身高179 cm,体重75 kg。2017年10月无明显诱因出现咳嗽、咯血。胸部CT提示左肺占位。左肺经皮肺穿刺活检组织病理提示腺癌。分子生物学检测示:①约20%肿瘤细胞中MET基因状态(+),有扩增。②约80%肿瘤细胞中MET基因状态(-),无扩增。③PD-L122C3(约50%肿瘤细胞+)。确诊后行2次AP方案(培美曲塞+卡铂)化疗,化疗后出现少许皮疹,无其他明显不良反应。后行胸部放疗Dt:54 Gy/27 f。一年后复查胸部CT提示病情进展。遂调整治疗方案,分别于2019年3月和2019年4月给予信迪利单抗免疫治疗2个周期。第2周期用药后1周,患者出现全身酸痛,伴有胸闷、气促不适。胸部X线示:左肺上叶癌术后改变,两肺散在纤维灶;左肺下叶占位较前片明显缩小,右肺散在结节灶,较老片右肺下叶病灶较前增大,双肺少量胸腔积液。其他实验室检查提示:乳酸脱氢酶1 210 U/L,肌酸激酶11 919 U/L,肌钙蛋白T 0.916 ng/ml,肌红蛋白(MYO)>3 000 ng/ml,肌酸激酶同功酶(CK-MB)223.10 ng/ml,脑利钠肽117.4 pg/ml。考虑“横纹肌溶解综合征”可能性大。
患者2006年曾行“胸腺瘤及左肺上叶癌根治术”。术后病理为:胸腺瘤AB型,左肺为腺癌。术后行化疗3周期(具体方案不详),未行放疗。有MG病史。2014年发现右肺占位,胸腔镜(VATS)下右肺癌切术,再次化疗3次(具体方案不详)。患者无其他基础疾病,无食物药物过敏史,有吸烟史,60包/年,已戒13年。
体格检查:体温36.7 °C,脉搏53次/min,呼吸20次/min,血压141/91 mmHg。神志清醒,精神安静,营养良好,发育正常,自动体位,检查合作。心律不齐,未闻及病理杂音。其他未见异常。
尿常规:潜血3+,蛋白1+,pH 5.0;
心电图:窦性心律;完全性右束支传导阻滞;ST-T波改变;
CT:左肺癌术后复发后复片,左肺肿块范围较前稍增大,余两肺多发结节大致同前;左肺叶炎症较前吸收。左肺液气胸较前吸收;右侧胸腔积液较前稍吸收。
诊断:①左肺腺癌术后复发综合治疗后;②横纹肌溶解综合征;③完全性右束支传导阻滞,Ⅱ度房室传导阻滞。
2 治疗经过
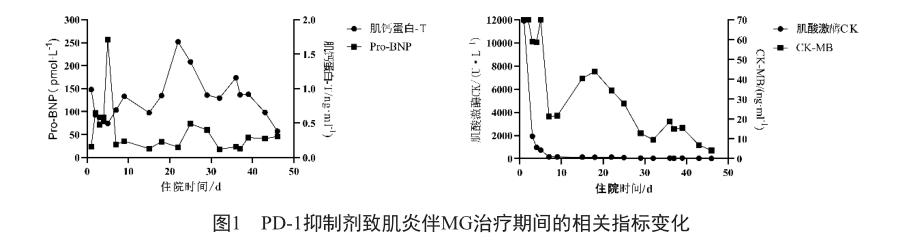
患者入住ICU后,持续心电监护、吸氧、保肝护胃等对症支持治疗。结合实验室检查,考虑免疫性肌炎累及心肌、横纹肌溶解。予注射用甲泼尼龙琥珀酸钠(D1—D9 160 mg qd、D10—D14 500 mg qd、D15—D18 240 mg qd、D19—D23 120 mg qd)+丙种免疫球蛋白(D2—D12 25 g qd),同时予异丙肾上腺素及临时心脏起搏器维持心率。同时,患者诉呼吸困难、吞咽乏力,测抗乙酰胆碱能受体抗体(anti-AChR-Ab)为8.97。考虑PD-1抑制剂相关性MG,予溴吡斯的明(D3—D9 120 mg qid→120mg bid维持)改善肌无力。后气管插管接呼吸机辅助通气,溴吡斯的明治疗20 d后复查anti-AchR-Ab为3.71。注射用甲泼尼龙琥珀酸钠减量(D24—D25 60 mg qd)后病情一度出现反复。TNT、BNP进行性升高,考虑心肌炎复发、肌无力较前加重,重新调整注射用甲泼尼龙琥珀酸钠剂量(D26—D37 120 mg qd),后予逐步减量(D38—D44 80 mg qd、D45 60 mg qd→ 继续减量)。并于D37、D40行2次血浆置换治疗,后anti-AchR-Ab及CK均恢复正常,其他指标逐渐缓解(图1)。目前患者气管切开呼吸机辅助通气中,规律吸痰,肠内营养支持,生命体征相对平稳。
3 讨论
本案例患者肺癌术后复发,所用的ICIs信迪利单抗注射液(商品名:达伯舒)是第二款国产PD-1抑制剂。据查阅文献,本案例是信迪利单抗在肺癌患者治疗中出现多发肌炎伴MG的首例报道。信迪利单抗于2018年底获批上市,目前一项Ⅰb期队列C临床研究结果显示[7],信迪利单抗单药在经治失败后的晚期非小细胞肺癌中显示出良好的抗肿瘤活性。
PD-1抑制剂通过抑制免疫检查点PD-1/PD-L1通路,激活效应T细胞,在发挥抗肿瘤作用的同时也伴有irAEs的发生[8]。其一般是由免疫增强引起的,包括皮肤、胃肠道、肝脏、内分泌以及其他罕见的炎症反应。其中,心肌炎是ICIs使用后一个潜在的致命并发症,来自WHO药物警戒数据库系统(Vigilyze)的回顾性数据分析[9],131例致死性免疫治疗相关不良反应中,52例(39.7%)是归因于心肌炎,且这些心肌炎致死的患者中,超过四分之一的患者伴发肌炎和MG[4]。虽然肌炎/心肌炎伴发MG之间的具体机制尚不清楚,但Suzuki等[10]報道0.8%的MG患者伴有复杂的肌炎和/或心肌炎。另外,帕博利珠单抗诱导的致死性多发肌炎[6,11];单剂量纳武利尤单抗治疗后诱发肌无力危相和多发肌炎[12-13]等案例也有报道。PD-1抑制剂相关的肌炎/心肌炎伴发MG多发生在治疗早期且迅速恶化,纳武利尤单抗相关的MG伴肌炎和心肌炎发病时间与第1次用药间隔从6 d到106 d不等[13]。
信迪利单抗安全性评价与国内已批准上市的PD-1抗体(帕博利珠单抗、纳武利尤单抗)具有一致性,且无意料之外的脱靶引起的安全性问题[14-15]。该患者在信迪利单抗治疗第2个周期后1周之内出现全身酸痛,伴有胸闷、气促不适,并且血生化检查提示心肌标志物、肌酸激酶、氨基转移酶明显增高,其中,肌酸激酶达正常值上限50倍以上,考虑“多发肌炎”、“横纹肌溶解综合征”可能性大。虽然,也有阿托伐他汀和纳武利尤单抗合用引起的肌炎的报道[16],但该患者没有服用任何他汀类及其他可能导致“横纹肌溶解”的药物。
該患者10余年前因“发现MG”行“胸腺瘤及左肺上叶癌根治术”,此次免疫治疗后患者诉呼吸困难、吞咽乏力,并发抗乙酰胆碱受体抗体水平升高,排除其他因素,考虑PD-1抑制剂相关的MG。Lau等[17]报道有MG病史的75岁男性患者,在使用帕博利珠单抗治疗转移性黑色素瘤后出现行走困难、颈软和眼睑下垂的情况;Zhu等[18]也报道过1例59岁女性患者在使用帕博利珠单抗治疗转移性黑色素瘤后迅速出现声音嘶哑、吞咽困难、劳力性呼吸困难,该患者30年前曾有MG病史。另外,有在纳武利尤单抗治疗前anti-AChR-Ab亚临床增加,后续导致肌无力危象的报道[19],所以有人认为在纳武利尤单抗治疗前监测anti-AChR-Ab可以作为一种MG发生的预测指标[12]。总之,对于有MG病史的患者,ICIs的使用激活T细胞自身免疫反应[20],或可更易诱发MG。
因此,该患者考虑为PD-1抑制剂(信迪利单抗)治疗后引起免疫相关性肌炎累及心肌、横纹肌溶解伴MG重叠综合征。
一般而言,中至重度irAEs需要中断ICIs治疗并施用皮质类固醇免疫抑制剂治疗。对于3~4级的免疫相关心肌炎/肌炎[21],应尽快启动强的松1 mg/kg或同等剂量治疗。如果伴有严重损害(虚弱严重限制活动、心脏呼吸功能不全、吞咽困难),考虑1~2 mg/kg的甲泼尼龙静脉注射或大剂量口服;也可考虑血浆置换、联合静脉注射免疫球蛋白(intravenous immunoglobulins, IVIg)治疗。如果在4~6周后没有改善或恶化,可以提供其他免疫抑制剂治疗,如甲氨蝶呤、硫唑嘌呤或霉酚酸酯。
本案例中患者使用大剂量类固醇激素——甲泼尼龙冲击联合丙种免疫球蛋白作为主要治疗药物,期间行血浆置换治疗,患者治疗结果好转。需要注意的是,糖皮质激素在减量过程中需警惕病情反复,该患者在甲泼尼龙第2次减量过程中呼吸支持压力增加,肌红蛋白、肌钙蛋白进行性升高,考虑心肌炎复发、肌无力较前加重,甲泼尼龙加量至120 mg维持好转后再行减量。
虽然目前irAEs相关的治疗药物还是以免疫抑制剂,如糖皮质激素类药物作为主要治疗药物,但是广谱免疫抑制剂对许多类型的免疫细胞有影响,并与许多不良事件相关;此外,与CTLA-4和PD-1/PD-L1信号通路的相关性也不明确。近日有文献报道了2例免疫治疗相关的心肌炎患者,给予阿仑单抗和阿巴西普处理后病情到控制[4-5]。后续仍然期待更多irAEs相关治疗药物的研究。
MG的治疗通常采用双重途径[22]:对症治疗与免疫抑制治疗。乙酰胆碱酯酶抑制剂——溴吡斯的明应作为绝大多数MG患者初始治疗的一部分。所有已使用足量溴吡斯的明仍未达到治疗目标的MG患者应当使用糖皮质激素或免疫抑制剂。该患者为PD-1抑制剂疗后引起免疫相关性肌炎累及心肌伴发MG,因此,是在免疫制剂治疗基础上使用溴吡斯的明对症治疗。静脉注射免疫球蛋白(IVIg)及血浆置换治疗,可以用作MG危及生命情况的短期治疗;当有必要预防或尽可能减少激素可能带来的病情加重时,在激素使用前使用。目前,患者仍需要呼吸机辅助通气,影像学提示肺部感染、肺不张较前好转,考虑患者有MG病史,肌力因素还需要进一步改善。
在PD-1抑制剂的使用过程中,尤其是有MG病史及其他免疫相关疾病史的患者,要警惕免疫激活引起的严重免疫相关不良反应。及时、足量的激素,联合免疫球蛋白以及溴吡斯的明可以用于PD-1抑制剂引起的免疫相关性多发肌炎伴MG的治疗。
参考文献
[1] Boussiotis VA. Molecular and biochemical aspects of the PD-1 checkpoint pathway[J]. N Engl J Med, 2016, 375(18): 1767-1778.
[2] Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group[J]. J Immunother Cancer, 2017, 5(1): 95.
[3] Moslehi JJ, Salem J-E, Sosman JA, et al. Increased reporting of fatal immune checkpoint inhibitor-associated myocarditis[J]. Lancet, 2018, 391: 933.
[4] Esfahani K, Buhlaiga N, Thebault P, et al. Alemtuzumab for immune-related myocarditis due to PD-1 therapy[J]. N Engl J Med, 2019, 380(24): 2375-2376.
[5] Salem JE, Allenbach Y, Vozy A, et al. Abatacept for severe immune checkpoint inhibitor-associated myocarditis[J]. N Engl J Med, 2019, 380(24): 2377-2379.
[6] March KL, Samarin MJ, Sodhi A, et al. Pembrolizumabinduced myasthenia gravis: A fatal case report[J]. J Oncol Pharm Pract, 2018, 24(2): 146-149.
[7] 信達生物制药有限公司. 信达生物公布信迪利单抗用于标准治疗失败的晚期非小细胞肺癌治疗的研究结果[EB/ OL]. (2018-09-21). https://www.prnasia.com/story/223551-1. shtml.
[8] Postow MA, Sidlow R, Hellmann MD. Immune-related adverse events associated with immune checkpoint blockade[J]. N Engl J Med, 2018, 378(2): 158-168.
[9] Wang DY, Salem JE, Cohen JV, et al. Fatal toxic effects associated with immune checkpoint inhibitors: a systematic review and meta-analysis[J]. JAMA Oncol, 2018, 4(12): 1721-1728.
[10] Suzuki S, Utsugisawa K, Yoshikawa H, et al. Autoimmune targets of heart and skeletal muscles in myasthenia gravis[J]. Arch Neurol, 2009, 66(11): 1334-1338.
[11] Tay SH, Wong AS, Jeyasekharan AD. A patient with pembrolizumab-induced fatal polymyositis[J]. Eur J Cancer, 2018, 91: 180-182.
[12] Kimura T, Fukushima S, Miyashita A, et al. Myasthenic crisis and polymyositis induced by one dose of nivolumab[J]. Cancer Sci, 2016, 107(7): 1055-1058.
[13] Suzuki S, Ishikawa N, Konoeda F, et al. Nivolumab-related myasthenia gravis with myositis and myocarditis in Japan[J]. Neurology, 2017, 89(11): 1127-1134.
[14] Shi Y, Su H, Song Y, et al. Safety and activity of sintilimab in patients with relapsed or refractory classical Hodgkin lymphoma (ORIENT-1): a multicentre, single-arm, phase 2 trial[J]. Lancet Haematol, 2019, 6(1): e12-e19.
[15] Ansell SM. Sintilimab: another effective immune checkpoint inhibitor in classical Hodgkin lymphoma[J]. Lancet Haematol, 2019, 6(1): e2-e3.
[16] Yoshioka M, Kambe N, Yamamoto Y, et al. Case of respiratory discomfort due to myositis after administration of nivolumab[J]. J Dermatol, 2015, 42(10): 1008-1009.
[17] Lau KH, Kumar A, Yang IH, et al. Exacerbation of myasthenia gravis in a patient with melanoma treated with pembrolizumab[J]. Muscle Nerve, 2016, 54(1): 157-161.
[18] Zhu J, Li Y. Myasthenia gravis exacerbation associated with pembrolizumab[J]. Muscle Nerve, 2016, 54(3): 506-507.
[19] Shirai T, Sano T, Kamijo F, et al. Acetylcholine receptor binding antibody-associated myasthenia gravis and rhabdomyolysis induced by nivolumab in a patient with melanoma[J]. Jpn J Clin Oncol, 2016, 46(1): 86-88.
[20] Suzuki S, Tanaka K, Yasuoka H, et al. Autoreactive T cells to the P3A+ isoform of AChR alpha subunit in myasthenia gravis[J]. J Neuroimmunol, 2003, 137(1-2): 177-186.
[21] Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of immune-related adverse events in patients treated with immune checkpoint inhibitor therapy: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768.
[22] Sanders DB, Wolfe GI, Benatar M, et al. International consensus guidance for management of myasthenia gravis: executive summary[J]. Neurology, 2016, 87(4): 419-425.

