单中心连续性胸腔镜治疗小儿肺隔离症30例经验
祁海杰 汪 力 皮名安
(华中科技大学同济医学院附属武汉儿童医院心胸外科,武汉 430016)
肺隔离症(pulmonary sequestration,PS)是仅次于肺囊性腺瘤样畸形(congenital cystic adenomatoid malformation)的第二常见的先天性肺发育异常,主要病理改变是无呼吸功能的肺组织、气管支气管树与正常肺组织无交通,形成分隔,并接受体循环供血。隔离的肺组织易继发感染,对正常肺组织产生压迫,还可发生咯血、恶变等,因此一经诊断即有手术指征[1]。外科手术切除隔离肺组织是主要的治疗方法。随着小儿胸腔镜技术的发展,其在肺隔离症中的应用逐年增加。本研究回顾性分析我院2018年1~12月连续30例胸腔镜治疗小儿肺隔离症资料,总结经验。
1 临床资料与方法
1.1 一般资料
本组30例,男19例,女11例。年龄2天~13岁4个月,中位数7.5月。其中2例<30天,胎儿期超声提示左侧膈疝,出生后出现呼吸困难行呼吸机支持通气,行左侧膈疝修补,术中见合并左侧膈肌内隔离肺;7例孕期超声检查提示肺部包块影,怀疑隔离肺,出生后行CT明确诊断;1例因胸痛行CT检查,提示隔离肺并胸腔积液;其余20例均因“呼吸道感染”行胸片检查提示异常影,进一步行CT检查明确诊断。28例术前诊断隔离肺,CT提示隔离肺位于右下肺10例,左下肺18例。2例隔离肺感染,术前均有发热,血常规白细胞和C反应蛋白(CRP)升高,给予抗感染治疗,感染控制后手术。1例因“呼吸道感染”行胸部CT检查提示下叶隔离肺合并感染,抗生素治疗1个月,血常规白细胞、CRP正常,无发热。
病例选择标准:隔离肺一经诊断则安排胸腔镜手术,如有感染症状,需感染控制后手术。
1.2 麻醉方法
3个月以下患儿原则上使用带气囊或不带气囊的气管插管行双肺通气,术侧胸腔采取低流量CO2人工气胸[2](2~6 L/min,4~8 mm Hg)暴露操作空间;3个月以上患儿采取不带气囊的气管插管,在纤维支气管镜(直径2.8 mm)引导下行健侧肺支气管插管单肺通气,操作视野暴露欠佳时亦可建立CO2人工气胸。
均采取定容型呼吸模式,潮气量6~8 ml/kg,呼吸频率25~45次/min,吸呼比1∶1.5~2.0,呼气末正压通气(PEEP)2~4 cm H2O,维持最大气道压力(Pmax)<35 cm H2O[2]。均行颈内静脉置管,行心电、脉搏氧饱和度(SpO2)、有创血压、呼气末CO2分压(PetCO2)、气道压力、压力-容量曲线监测,结合术中视野暴露情况调整呼吸参数,维持心率(HR)婴幼儿100~140次/min、>3岁80~100次/min,平均动脉压(MBP)50~80 mm Hg,SpO2>90%,PetCO2<70 mm Hg,Pmax<35 cm H2O。通气氧合不佳者(SpO2<90%、PetCO2>60 mm Hg)行动脉血气分析,若动脉血氧分压(PaO2)<60 mm Hg或动脉血CO2分压(PaCO2)>70 mm Hg则暂停手术,待通气氧合好转后继续手术;若通气氧合和操作视野仍不能维持,则中转开胸手术。
1.3 手术方法
胸腔镜手术取患侧三孔法,根据隔离肺的位置选择肋间隙进胸。下肺居多,多采用腋中线第8或9肋间为观察孔,腋后线第6或7肋间和腋前线第4或5肋间隙为操作孔。叶外型多用Hem-o-lok结扎滋养血管后完整切除隔离肺组织。叶内型Hem-o-lok结扎滋养血管后采取切割吻合器切除隔离肺组织。切除的隔离肺组织经观察孔或腋后线操作孔取出,必要时将组织剪成小条块状取出。中转开胸者取腋后线与腋前线的连线切开皮肤和肌层,经第4肋间隙入胸腔。
2 结果
30例均顺利完成手术,术中证实叶内型17例,叶外型13例,其中膈肌内3例(图1)(包括2例术前诊断左侧膈疝的新生儿术中见合并左侧膈肌内隔离肺,1例术前诊断左下肺隔离肺)。1例术前CT提示叶内型隔离肺,可疑肺囊肿,术中行隔离肺叶楔形切除,术后病理提示隔离肺合并肺囊肿;2例术前隔离肺合并感染者术中证实;1例因胸痛行CT检查,提示叶外型隔离肺,行腔镜探查时见胸腔积血,进一步探查见滋养血管扭转,隔离肺组织出血梗死(图2);其余均为单纯性隔离肺。单滋养血管27例(图3)(其中胸主动脉供血24例,膈肌血管供血3例),2支或3支血管供血2例(图4),肺循环体循环双重供血1例。全胸腔镜下隔离肺切除25例,1例叶内型隔离肺滋养血管和肺血管双重供血,胸腔镜下行滋养血管夹闭。4例中转开胸手术:1例为叶内型隔离肺合并感染,经规范抗生素治疗10天后高热控制,仅间断低热(<38 ℃),白细胞计数和CRP下降,但肺部病灶无明显吸收,行胸腔镜探查,见胸腔粘连严重,中转开胸行左下肺叶切除;1例为新生儿,孕后期超声提示左侧膈疝,生后呼吸困难,于生后第2天手术,腔镜探查左侧膈疝合并膈肌内隔离肺,膈肌血管供血,术中胸腔容积小,疝还纳困难,中转开胸行膈疝修补+膈肌内隔离肺切除术;1例为叶内型隔离肺单肺通气困难,低流量人工气胸仍暴露欠佳,中转开胸行右下叶肺切除术;1例为叶外型隔离肺,游离滋养血管时破裂出血,开胸结扎滋养血管后行右下隔离肺叶切除术,未输血。
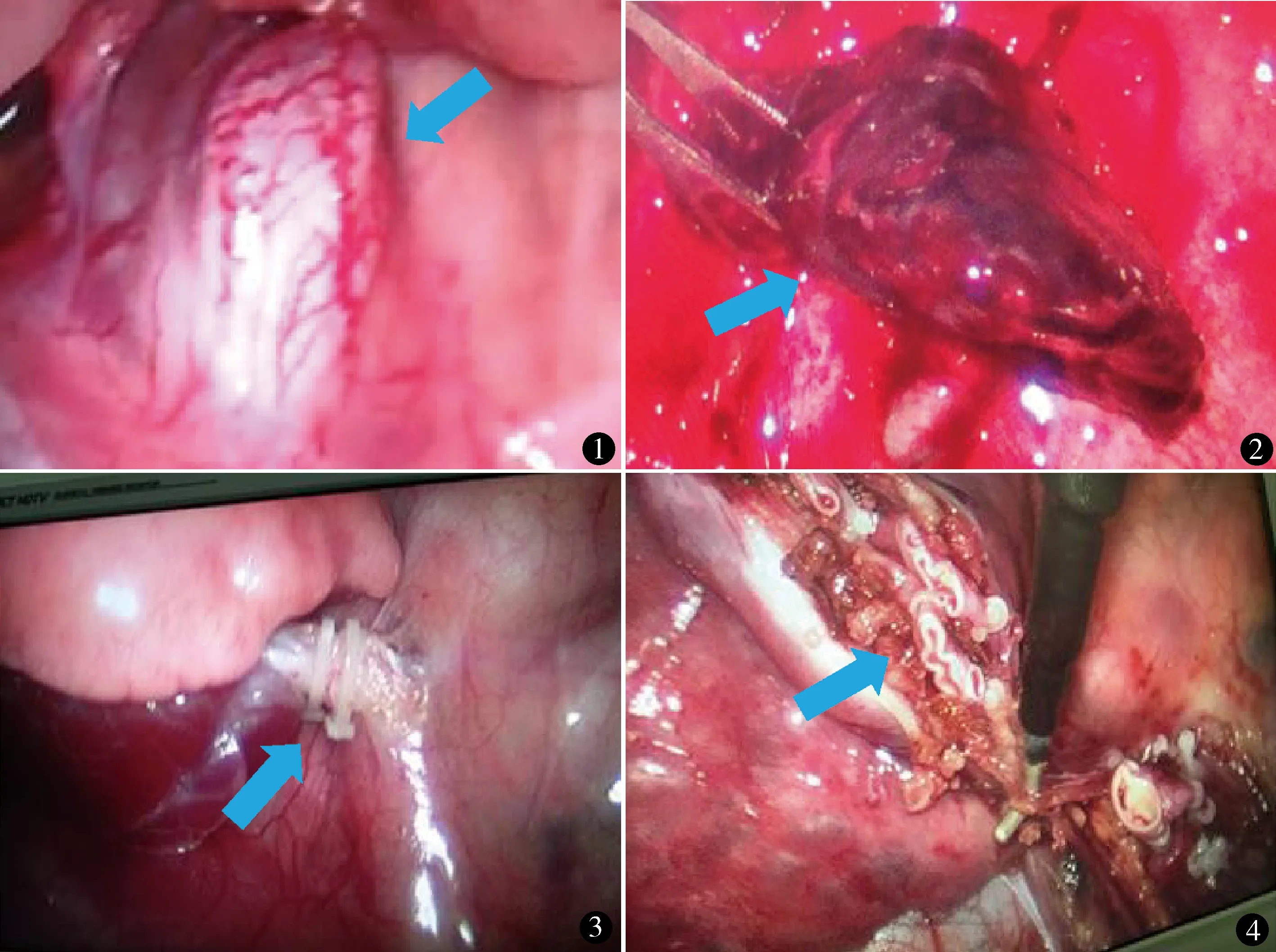
图1 膈肌内隔离肺 图2 叶外型隔离肺出血梗死 图3 隔离肺单滋养血管图4 隔离肺多滋养血管
手术时间11例叶外型胸腔镜肺叶切除术(41.3±23.4)min,4例叶内型胸腔镜肺叶切除术75、45、81和91 min,10例叶内型胸腔镜肺叶楔形切除术(54.2±28.6)min,1例滋养血管夹闭23 min,4例中转开胸分别为59、105、82和85 min。无支气管胸膜瘘、呼吸衰竭等严重并发症,无死亡。25例胸腔镜手术MBP(63.45±18.51)mm Hg,SpO2(96.54±4.5)%,PetCO2(40.62±16.58)mm Hg,Pmax(21.52±8.95)cm H2O。术后住院(8.2±3.9)d,均顺利出院。术后随访4~15个月,中位数10.2月,均恢复顺利,无反复肺部感染,无咯血。
3 讨论
小儿肺部疾病多为先天性疾病,肺部发育不完善,胸腔小,对手术的耐受力和操作便捷性均不及成人。20世纪90年代后期小儿胸腔镜技术逐渐开展,随着麻醉通气技术的提高,小儿胸腔镜技术近10来年发展迅速,与成人胸腔镜间的差距逐渐缩短[3,4]。我科2018年共收治30例肺隔离症,其中胸腔镜下顺利完成26例,因此我们认为大部分肺隔离症患儿可在胸腔镜下完成手术。小儿肺通气生理的特殊性如下[5]:①胸廓软,侧卧位时易压缩健侧肺,使功能残气量变小,造成健侧肺在潮气呼吸下部分气道闭合;②体型小,健侧和患侧肺之间的流体压力梯度小,相比成人而言患侧肺血流灌注增加,而健侧肺血流灌注减少,造成通气/血流比值(V/Q)失衡;③需氧量较成人高,婴幼儿为6~8 ml/(kg·min),成人为2~3 ml/(kg·min);④气管支气管内径小,最小号的双腔气管导管为26号,仅可用于8岁以上的儿童。小儿肺的生理特点对胸腔镜手术和麻醉提出了更高要求。
良好的麻醉和术中通气氧合控制是小儿胸腔镜手术顺利完成的先决条件。原则上所有年龄患儿均可在超细纤维支气管镜的引导下完成支气管插管行单肺通气,然而我们对小婴儿行支气管插管,当变动体位为侧卧位时易出现插管移位,滑脱至气管,造成单肺通气失败,故在改变体位后应通过听诊和纤维支气管镜检查再次确认导管位置。此外,小婴儿单肺通气时易出现气道压高、CO2潴留和低氧血症,甚至循环不稳定。因此,我们对3个月以下的小婴儿常规不使用单肺通气,而是采取双肺通气结合低流量CO2人工气胸的方法完成胸腔镜手术。术中可采取允许性高碳酸血症(permissive hypercapnia,PHC)管理,即允许PetCO2<70 mm Hg或PaCO2<70 mm Hg,维持pH≥7.20,有利于减少由于过高压力或过大潮气量所导致的机械通气相关性肺损伤。PHC可增加心排血量,提高肺顺应性,减少肺内分流,改善通气/血流比;引起氧解离曲线右移,促使氧释放;引起微血管扩张,改善组织灌注[6]。术中还可给予PEEP 2~4 cm H2O,可增加功能残气量,扩张萎陷的肺泡,改善氧合。术中控制PetCO2<70 mm Hg,根据情况可每30 min行动脉血气监测,控制PaO2>60 mm Hg、PaCO2<70 mm Hg和pH≥7.20。同时,术中生命体征监测非常重要,我们常规行心电、SpO2、有创血压、PetCO2、气道压力、压力-容量曲线监测,并结合术中视野暴露情况调整呼吸参数,维持HR婴幼儿100~140次/min、3岁以上80~100次/min,MBP 50~80 mm Hg,SpO2>90%,PetCO2<70 mm Hg,Pmax<35 cm H2O。本组1例叶内型隔离肺单肺通气困难,PaO2<60 mm Hg,建立人工气胸后循环不稳定,中转开胸手术顺利。在通气模式方面,我们认为可在严密气道压力监测下采取定容通气模式,因为小儿胸廓软,侧卧位时易压缩健侧肺造成健侧肺在潮气呼吸下出现部分气道闭合,定容通气有利于保证氧合。
手术操作方面,因小儿胸腔容积小,操作空间有限,如单肺通气效果不理想可以采取低流量CO2人工气胸,有助于暴露视野。叶外型隔离肺体积常较叶内型小,对操作空间需求低,一般Hem-o-lok结扎滋养血管后即可顺利完整切除隔离肺组织。本组1例叶外型隔离肺,游离滋养血管时发生破裂出血,中转开胸手术。滋养血管通常直接由降主动脉发出,直径粗或多支血管供血,肌层薄,弹力纤维发育差,常与下肺韧带粘连,是造成游离时破裂出血的主要原因,操作时需谨慎。一旦发生出血,常不易控制,建议立即中转开胸手术,避免出现失血性休克。同时,叶外型易出现膈肌内隔离肺和合并膈疝、血管扭转等情况,胸腔镜处理时需仔细操作,尽量避免膈肌破裂或出血[7]。本组1例因胸痛行CT检查,提示叶外型隔离肺,行腔镜探查时见胸腔积血,进一步探查见滋养血管扭转,隔离肺组织出血梗死(图2)。3例叶外型隔离肺位于膈肌内,2例顺利胸腔镜下切除,包括1例新生儿,另1例新生儿隔离肺合并膈疝,因操作困难而中转开胸手术。
叶内型隔离肺通常与正常肺组织分界不清,可采取楔形切除、肺叶切除或肺段切除。叶内型隔离肺较叶外型有较高的感染机率,一旦出现感染,将显著增加操作难度,且合并感染时行肺叶切除的机率较楔形切除、肺段切除高,易出现支气管胸膜瘘。故建议叶内型隔离肺尽早手术,减少感染发生的机率[8]。一般可在3~6月龄行手术切除,此阶段患儿多数没有出现肺部感染等并发症,局部粘连较轻,解剖清晰,手术操作相对容易,且单肺通气较小婴儿成功率高,耐受性好[9]。一旦出现隔离肺感染,建议感染控制1~2个月后择期手术;对于规范抗生素治疗1~2周后仍反复发热,病灶无明显吸收,感染仍控制欠佳者,也可考虑手术切除,但感染期常出现胸腔粘连,组织脆,滋养血管显露欠佳,易出血,中转开胸手术机率增高。本组1例叶内型隔离肺合并感染的13岁儿童,经规范抗生素治疗10天后高热控制,仅间断低热(<38 °C),但肺部病灶无明显吸收,行胸腔镜探查,因胸腔粘连严重、广泛渗血而中转开胸行肺叶切除。另1例因“呼吸道感染”行胸部CT检查提示下叶隔离肺合并感染,给予抗生素治疗7天后体温恢复正常,血常规白细胞下降,复查CT病灶有吸收,口服抗生素1个月后再次复查血常规白细胞、CRP正常,无发热等感染症状,顺利在胸腔镜下行隔离肺切除术。
综上,我们认为胸腔镜治疗小儿肺隔离症安全可行,绝大部分患儿可首选胸腔镜手术,术中可根据年龄选择不同的麻醉肺通气策略。允许性高碳酸血症策略和严密的生命体征监测是小儿胸腔镜手术顺利实施的保证。如新生儿胸腔小,合并其他操作困难,或感染,胸腔粘连,或隔离肺体积大,单肺通气或人工气胸仍暴露欠佳,或滋养血管出血,应及时中转开胸手术。

